抗杀螟硫磷纳米抗体表达、纯化策略研究及检测方法建立
郭鹏燕,徐振林,陈子键 ,沈 兴,
(1.华南农业大学食品学院,广东广州 510642;2.肇庆学院食品与制药工程学院,广东肇庆 526061)
我国作为传统农业大国,农业生产规模巨大,农药滥用及不合理施用的现象也比比皆是[1]。农药在水、土壤以及农作物中的残留严重威胁了人类的生命健康[2-3]。杀螟硫磷作为一种广谱的有机磷类杀虫剂,因其高效的杀虫性能和低廉的价格被广泛地应用于蔬菜、水果、谷物等农产品的虫害防治[4-5],其不合理施用导致的农药残留严重威胁人类的生命健康安全。我国食品安全国家标准GB2763-2021 对杀螟硫磷在谷物、油类、蔬菜、水果和肉类等食品中的最大残留限量(MRLs)作出了规定,以蔬菜水果为例,最大残留限量均不超过0.5 mg/kg。近年来在各地农产品农药残留监测中,仍常有杀螟硫磷残留检出的报导,例如2017 年一项针对泉州地区蔬菜中有机磷农药残留的监测显示,几种残留超标的化合物杀螟硫磷、甲拌磷、丙溴磷和水胺硫磷的气相检测值分别为5.85、0.04、1.28、0.062 mg/kg,远远高于国标规定的蔬菜中最大残留限量,其中杀螟硫磷超标最为严重[6]。因此,应对杀螟硫磷残留进行监测,找到有效保障人民健康安全,高效、经济、实用的检测方法。
目前,我国食品安全国家标准检测方法(GB 23200.113-2018)规定的杀螟硫磷残留的检测方法是气相色谱-质谱联用仪器分析法[7],但是其需要繁琐的前处理、仪器操作相对复杂,对相关操作人员要求较高,不能满足现场大规模快速检测[8]。免疫分析方法由于其灵敏度高、特异性好、方便快捷、易操作等优点,被广泛应用于农药、兽药残留等食品安全监测[9-10]。近几年报道了很多食品中杀螟硫磷残留的免疫分析检测方法,其中应用较多的是单克隆抗体和多克隆抗体[11-14],但存在生产周期长、成本高、免疫效果不稳定、重复性较差等问题[15]。与传统抗体相比,基因工程抗体具有制作成本较低、制备周期短、抗体较稳定具有更好的实验重现性,并且可以通过基因工程的手段对抗体进行改造等诸多优势[16-17]。纳米抗体(Nbs)本质上属于基因工程抗体的一种,相较于传统抗体衍生来的Fab、scFv 等基因工程抗体,Nbs 分子极小、结构紧致,具有溶解度好、稳定性和亲和力高的优势[18-20],因而从被发现以来迅速地被应用于生物制药、医疗诊断和食品安全监测等领域,应用前景十分广阔。
目前常用的纳米抗体体外表达体系主要是大肠杆菌和酵母细胞,其中大肠杆菌是最早用于外源基因表达的宿主细胞,也是目前重组蛋白制备最常用的表达系统,有成熟的操作方法以及各类商业化表达载体和宿主[21],具有表达水平高,操作简单,培养成本低、周期短等优势[22]。Nbs 可以在细胞质表达或者通过信号肽介导到周质腔表达,后者处于氧化环境,有利于二硫键形成,促进Nbs 正确折叠表达,产生可溶性蛋白[23-24]。但是Nbs 在周质腔中的表达水平较低,往往难以富集,因此需要通过适宜的表达与纯化策略以达到高效获取Nbs 的目的。除了本实验室的前期研究之外,目前尚未见其他关于抗杀螟硫磷纳米抗体的报道,而本实验室前期构建的异源表达体系表达水平和纯度较低,抗体富集较为困难,无明确的表达及纯化策略用于制备高纯度的抗杀螟硫磷纳米抗体,制约了其在杀螟硫磷监测中的应用[25-26]。本研究在前期构建的一株低表达水平的抗杀螟硫磷纳米抗体工程菌基础上,通过对其表达条件进行优化以及对纯化策略进行研究,以期高效制备高纯度的抗杀螟硫磷纳米抗体,并验证其检测性能,为纳米抗体的制备与相关免疫检测方法的开发奠定基础。
1 材料与方法
1.1 材料与仪器
PINQ-VHH(sm6)质粒、杀螟硫磷检测抗原 实验室前期制备;质粒小提试剂盒 北京天根生化科技有限公司;表达菌株BL21(DE3)感受态 北京全式金生物技术股份有限公司;酵母提取物、胰蛋白胨美国Thermo 公司;琼脂糖 广州BioFroxx 公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)广州华奇盛生物公司;Tris、咪唑、甘氨酸、SDS 广州Bio-Froxx 公司;PAGE Gel Fast Preparation Kit 上海雅酶生物医药科技有限公司;Ni SepharoseTM 6 Fast Flow、Hiload Superdex 75 pg 16/600 层析柱 美国GE Healthcare 公司;DTT 上海阿拉丁生化科技股份有限公司;Protein Marker、DNA Marker 美国Thermo 公司;ultra GelRed(10000×)南京Vazyme公司;MonoRabTM Rabbit anti-Camelid VHH(HRP)南京金斯瑞科技有限公司;杀螟硫磷标准品 坛墨质检科技股份有限公司;白菜、生菜样品 购自华南农业大学三角市市场;其他化学试剂均为分析纯。
PowerPac TM 通用电泳仪 美国Bio-Rad 公司;AKTA pure 蛋白质层析系统 美国GE Healthcare公司;SW-CJ-IF 型净化工作台 苏州净化设备厂;HZQ-X100 恒温振荡培养箱 培英实验设备有限公司;-80 ℃超低温冰箱 Panasonic;LRH-150A 型生化培养箱 广东省医疗器械厂;高压灭菌锅 日本Hirayama 公司;Universal Hood II 多功能凝胶成像仪 美国Bio-Rad 公司;Nanodrop 2000c 微量分光光度仪 美国 Thermo 公司;Sorvall Lynx 4000 超高速冷冻离心机 美国Thermo 公司;Multiskan MK3酶标仪 美国 Thermo 公司;Wellwash MK2 洗板机上海艾研生物科技有限公司;HH W21-600 电热恒温水浴箱 上海悦丰仪器仪表有限公司;SKFG-01电热恒温鼓风干燥箱 黄石市恒丰医疗器械有限公司。
1.2 实验方法
1.2.1 PINQ-VHH-sm6 质粒提取与转化 实验室前期制备的含有sm6 重组质粒的冻存甘油菌[27],接种到10 mL Kana 抗性LB 液体培养基中活化,用质粒小提试剂盒进行质粒提取,提取完成后用核酸电泳进行验证。将1~2 μL 重组质粒加入到感受态中,轻弹混匀后置于冰水浴30 min,接着于42 ℃水浴锅热击90 s,立即冰水浴2 min,取出后加入600~800 μL LB 液体培养基,200 r/min、37 ℃振荡培养1 h。培养后的菌液12000 r/min 离心2 min 弃去大部分上清,留150 μL 进行菌体重悬,涂布于LB-Kana 平板,于37 ℃恒温培养箱中倒置培养12~16 h,待长出单一菌落。
1.2.2 抗杀螟硫磷纳米抗体表达条件优化 从转化后的平板上挑取单菌落到10 mL LB-Kana 液体培养基中,200 r/min、37 ℃振荡培养过夜。取活化的菌液以1:100 的比例加入到2×YT-Kana 液体培养基,37 ℃、250 r/min 振荡培养到对数期,将菌液以每管10 mL 分装到50 mL 离心管中进行诱导表达。诱导温度分别选择37、28、16 ℃,诱导剂IPTG 用量分别采用1、0.7、0.5、0.3、0.1 mmol/L[28],于250 r/min 振荡诱导表达16 h,以探索不同温度与诱导剂用量下的目的蛋白表达情况。将培养好的菌液在12000 r/min、4 ℃条件下离心5 min 收集菌体,弃去上清。采用蔗糖渗透压法提取周质蛋白[29],每管收集菌体中加入70 μL 5×TES,重悬菌体,-80 ℃冻存3 h,取出后加入210 μL 1×TES,室温解冻重悬菌体,16 ℃、200 r/min 振荡培养1 h 后,于12000 r/min、4 ℃条件下离心25 min,收集上清,即为周质蛋白。将不同表达条件下的周质蛋白跑SDS-PAGE 电泳验证表达情况。
1.2.3 抗杀螟硫磷纳米抗体纯化
1.2.3.1 亲和层析纯化 采用Ni Sepharose HP 5 mL亲和柱对上一步提取的周质蛋白进行第一步亲和纯化,首先使用结合缓冲液(20 mmol/L Tris-HCl、300 mmol/L NaCl,pH7.4)进行上样,继续冲洗5 个柱体积后,逐渐提高洗脱缓冲液(20 mmol/L Tris-HCl、300 mmol/L NaCl、500 mmol/L 咪唑,pH7.4)的浓度进行梯度洗脱,在50 min 内洗脱缓冲液的比例从0%增加到100%,对洗脱峰进行收集并用Nanodrop 测定蛋白浓度,跑SDS-PAGE 电泳对纯化效果进行验证。此外,为了提升亲和层析的纯化效果,同时采用在结合缓冲液和洗脱缓冲液中加入1 mmol/L DTT 的策略,探索对纯化效果的影响。
1.2.3.2 凝胶过滤层析法 采用Superdex 75pg 凝胶柱进行第二步纯化。将上一步纯化得到的蛋白溶液用3000 Da 的超滤管反复离心浓缩到5 mL,用1.2 个柱体积的平衡缓冲液(20 mmol/L Tris-HCl、100 mmol/L NaCl,pH7.4)平衡柱子后进行上样,继续冲洗1 个柱体积,不同分子量大小的蛋白在不同时间被洗脱下来,收集全部的洗脱峰进行SDSPAGE 电泳验证,用Nanodrop 测定目的蛋白浓度。
1.2.4 间接ELISA 检测方法建立 利用纯化得到的抗杀螟硫磷纳米抗体建立间接ELISA 方法(indirect competitive enzyme-linked immunesorbent assay,ic-ELISA),对纳米抗体的检测性能进行评价,建立标准曲线,具体操作步骤如下:用包被液将杀螟硫磷检测抗原稀释至0.5 μg/mL,加入到96 孔酶标板中,每孔100 μL,置于37 ℃恒温水浴锅中孵育12 h,用PBST洗板后用封闭液封闭3 h。在0.5 μg/mL 包被原条件下,测定波长450 nm 处的吸光值在0.8~1.5 之间的抗体浓度作为工作浓度。将50 μL 抗体工作溶液与50 μL 不同浓度杀螟硫磷标准溶液在微孔中混合,37 ℃孵育40 min 后洗板5 次。按照1:5000 的比例用PBST 稀释anti-VHH HRP 二抗,每孔加入100 μL二抗,37 ℃孵育30 min 后再次洗板5 次。每孔加入100 μL 显色液37 ℃孵育10 min,用10% H2SO4终止反应。用酶标仪测定波长450 nm 处的吸光值,以B/B0值为纵坐标,以杀螟硫磷药物浓度为横坐标,其中B 为相应浓度稀释的吸收值,B0为空白孔的吸收值,拟合函数的方程为:
式中,A 是药物浓度最低时对应的吸收值;D 是药物浓度最高时对应的吸收值;C 是中点浓度,当药物浓度等于C 是吸收值为(A+D)/2,处于曲线的拐点处,对应浓度即为IC50;B 是曲线的陡峭程度,即斜率因子。
1.2.5 实际样品检测 样品前处理方法参考GB 23200.113-2018 进行:白菜和生菜去除根部,分别打成匀浆,准确称取匀浆样品10 g 于50 mL 离心管,加入10 mL 乙腈、4 g 硫酸镁、1 g 氯化钠、1 g 柠檬酸钠、0.5 g 柠檬酸氢二钠和1 颗陶瓷搅拌子,振荡涡旋1 min,4200 r/min,离心5 min。吸取6 mL 上清液到15 mL 离心管中,加入885 mg 硫酸镁、150 mg乙二胺-N-丙基硅烷化硅胶(PSA)及15~45 mg 石墨化炭黑(GCB),涡旋混匀1 min,4200 r/min 离心5 min。为了简化前处理步骤,样品提取液不经过氮吹复溶,用PBS 稀释至一定倍数后直接用于ic-ELISA检测。
1.3 数据处理
采用Microsoft Excel 软件进行数据统计,所有数据均为3 次平行实验测定结果的平均值±标准差,并采用Origin 2018 软件(美国OriginLab 公司)对实验数据进行分析。
2 结果与分析
2.1 抗杀螟硫磷纳米抗体诱导表达条件优化
提升纳米抗体体外表达水平的方法有很多,如对基因编码序列进行密码子优化[30-31]、与分子伴侣(GroES、GroEL、DnaK 等)、折叠酶(PDI、Dsb 家族等)或可溶性蛋白融合表达[32-33],以及更换表达载体或宿主等,而优化培养条件是一种最为简单且有效的方法,可以通过低温诱导、调整诱导剂浓度或在培养基中加入营养物质等方式提高重组蛋白可溶性表达水平。
本研究以37 ℃、1 mmol/L IPTG 作为初始表达条件,首先进行温度优化,分别在37、28、16 ℃条件下进行诱导,同时设置不加IPTG 的样品作为对照,提取周质蛋白进行电泳验证,结果如图1(a)所示。在1 mmol/L IPTG 条件下,目的蛋白表达量随着诱导温度升高而降低,在16 ℃下诱导表达提取得到的周质可溶性蛋白量最多。与此同时,发现没有IPTG诱导的对照组也能正常表达,且表达量较高,说明该重组质粒存在泄露表达,因此接着对诱导剂的浓度进行优化。

图1 抗体表达条件优化Fig.1 Optimization of antibody expression conditions
通过在16 ℃下对0~1 mmol/L 浓度范围的IPTG用量进行探索,结果发现诱导剂的用量对于蛋白的表达量影响并不大,且与无IPTG 条件下的表达量接近,因此从节约成本和简化操作的角度考虑,选择不加诱导剂直接进行表达,并在此条件下重新确定最优表达温度。结果与预想不同,如图1(c)所示,目的蛋白表达量随温度升高而升高,在37 ℃下表达量最高,与1 mmol/L IPTG 下的结果正好相反,说明Nbsm6的表达水平随温度的变化趋势与IPTG 用量密切相关,不同的IPTG 含量使得Nbsm6 的表达水平随温度变化呈现相反趋势。高IPTG 条件下,可溶蛋白含量随温度的升高而降低;无IPTG 条件下,可溶蛋白含量随温度的升高而增加,同样在实验过程中观察到的菌体含量也呈现出相同的趋势。有研究表明IPTG在诱导蛋白表达的同时可能会具有影响表达菌生长的双重作用,原因在于IPTG 本身的毒性以及异源基因快速诱导表达消耗了大肠杆菌的营养成分,造成了大肠杆菌的代谢负担。此外,重组蛋白活性引起的副反应或其底物、产物和中间体的毒性都会影响菌体生长[34-35],因此蛋白的表达量不会随着IPTG 浓度的增加而无限增加,IPTG 浓度过高反而形成负面影响。除此之外,本研究发现在高温条件下,IPTG 对大肠杆菌的毒性作用更加明显,其原因可能是高温条件加速了早期重组蛋白表达以及半乳糖苷衍生物的积累,加大了对宿主的毒性以及胞内营养物质的消耗,进一步减缓了大肠杆菌生长[36-37],最终显著影响了蛋白表达水平;而在无IPTG 时,由于泄漏表达可以使重组抗体在较高培养温度下产量更高。
因此,在对重组蛋白进行表达制备时不能忽略IPTG 对大肠杆菌的负面作用及其对不同温度的响应情况,应同时考虑温度和诱导剂浓度的交互效应,以确定最优表达策略,不能只是通过单因素实验确定抗体的最佳表达条件,应该将不同温度和IPTG 浓度进行交叉研究。另外,在对抗体的表达条件进行优化时,不能忽略不同因素对抗体活性的影响,抗体活性的降低将直接影响其检测效果。本研究中Nbsm6的表达最终确定在37 ℃、无IPTG 条件下进行,相较于优化前在37 ℃、1 mmol/L IPTG 条件下蛋白表达量1.565 mg/L,优化后蛋白表达量为6 mg/L,是优化前的3 倍以上。
2.2 抗体纯化策略优化
将提取的周质蛋白,采用Ni 亲和柱层析方法进行第一步纯化,纯化结果如图2(a)所示。亲和层析后18 kDa 左右有明显目的蛋白富集,但依然存在较多杂蛋白,可能是在蛋白质浓度过高时发生了聚集[38],形成多聚体吸附在层析柱上随单体一起被洗脱下来,可以通过改变缓冲液体系、pH、加入还原剂等方法提高纯化效果[39]。本研究中采取在亲和层析的缓冲溶液中加入1 mmol/L DTT,利用其还原作用破坏杂蛋白的构象,减少杂蛋白与镍柱的结合能力,从而达到去除杂蛋白的目的。图2(b)显示了缓冲液中含有DTT 的纯化效果,可以看出在1 mmol/L DTT 的作用下,大大减少了杂蛋白的结合,但仍有少量杂蛋白残留,且分子量较大,因此进一步地采用分子筛色谱利用分子量差异去除杂蛋白。结果如图3 所示,经由分子筛纯化后,电泳结果显示在18.6 kDa 处得到了条带非常单一的目的蛋白,确定了两步法纯化方案,所获得的纳米抗体经Image J 软件分析纯度达到98%以上。

图2 亲和纯化分离蛋白峰图及SDS-PAGE 电泳图Fig.2 Peak diagram of protein isolated by affinity purification and SDS-PAGE electrophoresis
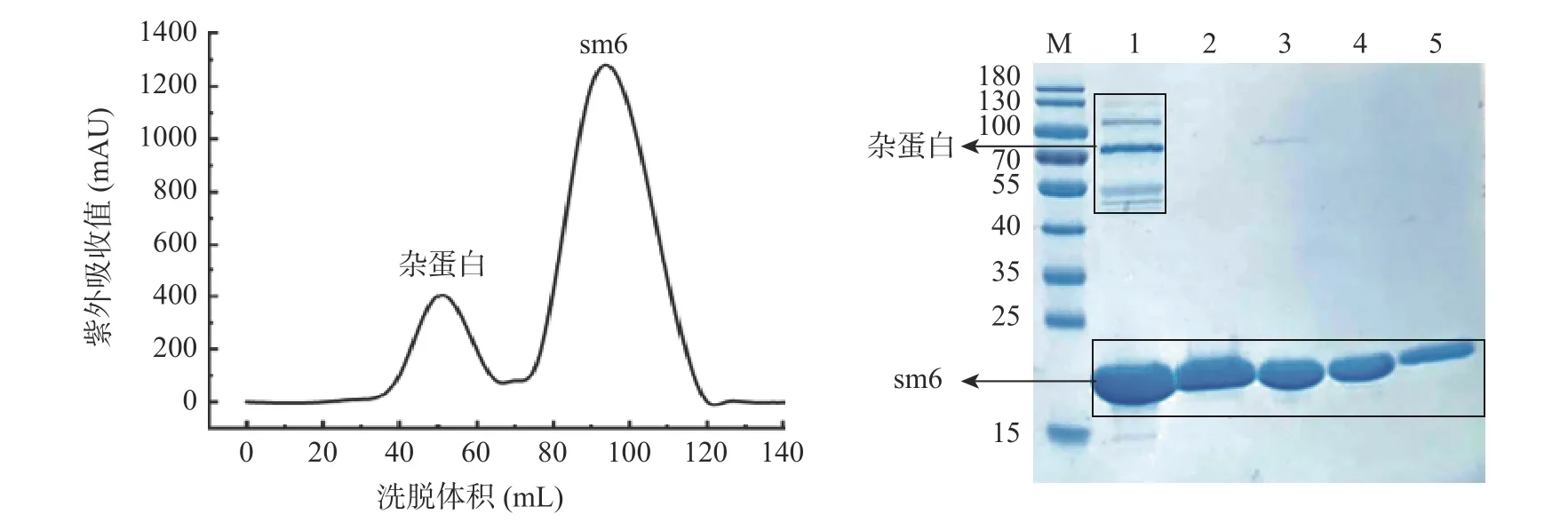
图3 凝胶过滤层析分离蛋白峰图及SDS-PAGE 电泳图Fig.3 Protein peaks separated by gel filtration chromatography and SDS-PAGE electrophoresis
2.3 间接ELISA 检测方法建立
在包被原浓度为0.5 μg/mL,抗体浓度为900 ng时,在PBS 缓冲溶液中建立抗杀螟硫磷纳米抗体的ic-ELISA 标准曲线,结果如图4 所示。优化前低表达抗体检出限(IC10)为0.8 ng/mL,线性范围为1.5~10.9 ng/mL[27];优化后抗体所建立的ic-ELISA 方法的IC50为5.81 ng/mL,检出限(IC10)为0.25 ng/mL,线性范围为0.78~43.07 ng/mL,相较于优化前所建方法在检出限和检测范围上都有提升。目前已经报道的基于杀螟硫磷单克隆抗体在缓冲体系中建立的ic-ELISA 方法IC50分别是为8.72 ng/mL[11]、120.7 ng/mL[40],多克隆抗体LOD 为12 ng/mL[12],基于scFv的ELISA 方法IC50为3.4 ng/mL[41],本研究经表达和纯化优化后制备的Nb 所建立的杀螟硫磷ic-ELISA 检测方法与目前已经报道的基于单克隆抗体ELISA 检测方法相比具有更高的灵敏度,与报道的基于多克隆抗体和scFv 的ELISA 方法灵敏度相当,表明本研究所制备获得的抗杀螟硫磷纳米抗体具有良好的检测活性。
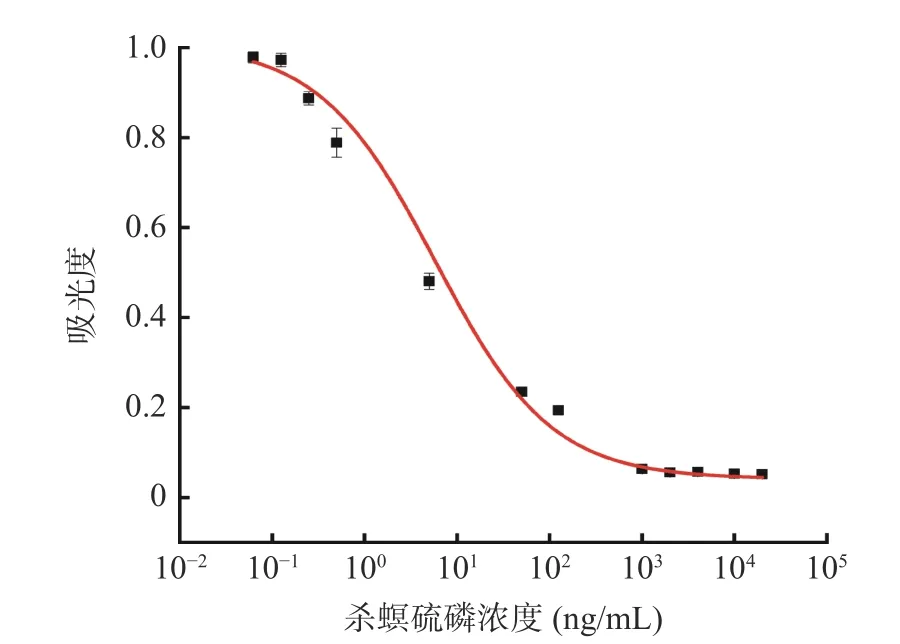
图4 抗杀螟硫磷纳米抗体ic-ELISA 标准曲线Fig.4 Anti-fenitrothion nanobody ic-ELISA standard curve
2.4 样品添加回收
经过QuEChERS 净化后的白菜和生菜样品提取液,用PBS 稀释10、20、30 倍后直接用于ic-ELISA检测。建立标准曲线(见图5)分析发现,两种蔬菜样品提取液稀释20 倍后标准曲线与PBS 标准曲线重合,而稀释10、30 倍的标准曲线与PBS 标准曲线重合度较差,影响样品中杀螟硫磷的定量检测效果。最终确定稀释20 倍为消除基质效应的最小稀释倍数,其检测线性范围为0.33~46.08 ng/mL,满足国家标准GB 2763-2021 中规定的最大残留限量标准的检测。
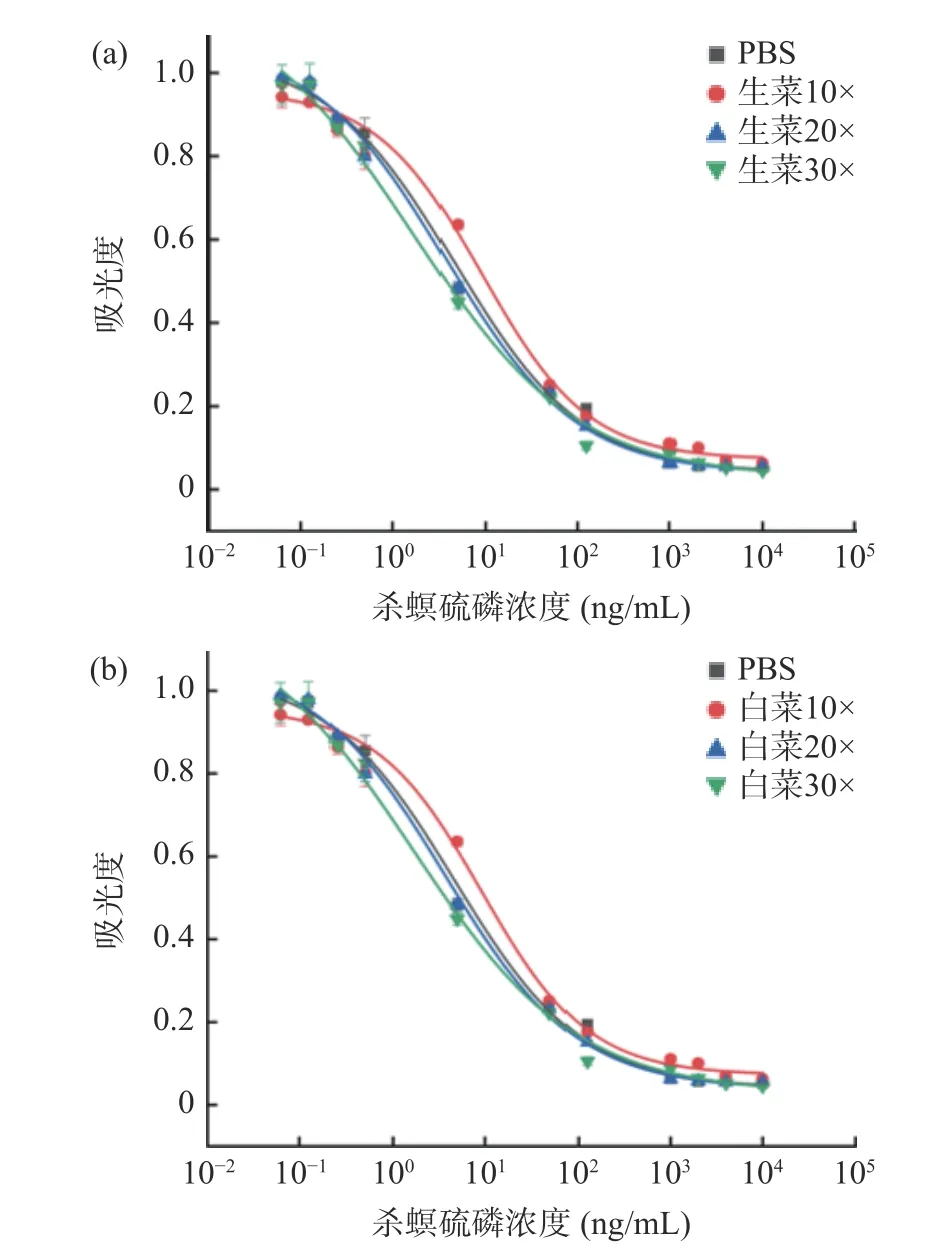
图5 基质效应消除Fig.5 Elimination of matrix effect
在样品中添加低中高三个水平的杀螟硫磷标准药物,采用上述的前处理方法处理样品,ic-ELISA 检测样品中的杀螟硫磷,结果如表1 所示,两种果蔬样品的回收率在93.3%~111.7%之间,变异系数(CV)值在2.3%~18.2%之间,说明方法准确性较高,误差在可接受范围内。
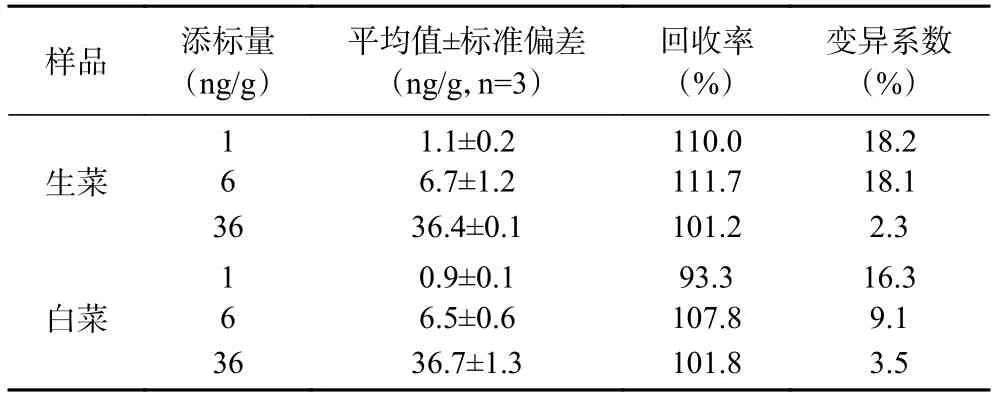
表1 两种蔬菜样品添加回收实验Table 1 Additive recovery experiment of two vegetable samples
3 结论
本研究通过优化抗杀螟硫磷纳米抗体在大肠杆菌表达体系中的培养条件,增加了重组蛋白在周质腔中的可溶性表达量,建立了获得高纯度抗杀螟硫磷纳米抗体的两步纯化法。经过优化后,可以成功高效表达并纯化得到高纯度抗杀螟硫磷纳米抗体,表达量为6 mg/L,纯度达到98%以上。此外,ic-ELISA 对纯化得到的纳米抗体建立标准曲线进行活性鉴定,结果显示IC50为5.81 ng/mL,检出限LOD 为0.25 ng/mL。选择生菜和白菜样品进行实际样品检测,其检测线性范围为0.33~46.08 ng/mL,能够满足国标规定的杀螟硫磷最大残留限量监测需求,为开发杀螟硫磷快速免疫检测方法做了准备,也为后续抗杀螟硫磷纳米抗体结构、功能及相互作用机制研究奠定了基础。此外,研究过程中发现在诱导温度过高时IPTG 诱导剂浓度对表达水平的影响巨大,不利于宿主菌正常生长,不利于蛋白质可溶表达;相反温度较低时IPTG 诱导剂的用量对可溶性蛋白的表达量没有太大影响,且诱导剂浓度与诱导温度对纳米抗体的表达存在交互效应,为之后纳米抗体的异源表达提供了参考。

