玻璃化法超低温高效保存‘Gala’苹果组培苗
徐娜,陈桂玲,杨磊,朱子涵,陈丽,韩亚丁,刘飞
玻璃化法超低温高效保存‘Gala’苹果组培苗
徐娜,陈桂玲,杨磊,朱子涵,陈丽,韩亚丁,刘飞*
济宁医学院, 山东 日照 276800
本试验以苹果‘Gala’苹果为材料,从低温锻炼时间、预培养基蔗糖浓度、预培养时间和玻璃化溶液及处理时间4个方面优化玻璃化超低温保存体系,获得‘Gala’苹果茎尖超低温保存的最佳体系。结果表明,将生长30 d的组培苗在4 ℃的条件下低温锻炼5周,剥取茎尖,将其置于含0.4 mol/L蔗糖的预培养基中培养5 d,渗透装载液渗透30 min,0 ℃的条件下用PVS3玻璃化溶液处理60 min,放入液氮中冷冻24 h,取出后置于40 ℃水浴中1 min快速化冻,卸载液清洗2次,每次10 min,然后在恢复培养基上培养,茎尖的再生率最高达到96.6%且生长稳定性好。本试验成功建立了‘Gala’苹果的玻璃化法超低温保存体系,为苹果种质资源的长期保存提供了一条有效途径。
‘Gala’苹果; 超低温处理; 组培
苹果富含糖类、蛋白质、有机酸、维生素和微量元素等多种有益于身体健康的物质,是深受大众喜爱的一种水果。中国是野生苹果主要起源地之一,也是世界上最大的苹果生产国[1,2]。农业生产上,一个优良的品种是决定苹果产量与品质的关键因素。据统计,目前世界上的苹果品种约有1000个,其中已有几十个品种在生产中广泛栽培,但没有一个品种能够完全满足生产者和消费者的所有需求。现已发现许多具有优良性状的自然突变体,并将其引入到生产中,成功改善了苹果的品质。苹果的野生种、半野生种和栽培种等种质资源,是苹果传统育种和基因工程育种的基础,也是培育优良苹果品种的保障[3]。因此,建立安全、有效的苹果种质资源保存方法是非常必要的。
苹果既可利用种子繁殖也可无性繁殖,因无性繁殖具有能够保存母本优良性状且耗时较短的优点,生产上苹果以无性繁殖为主。田间保存和试管保存是用来保存无性繁殖植物种质的传统方法[4]。中国、美国、德国、意大利等多个国家通过建立苹果种质圃保存了多份苹果材料[5-8]。田间保存的优点是可原位保存且操作简易,但田间保存需占用大面积的土地、耗费大量的劳力、受自然灾害和病虫害的影响大,容易造成珍贵种质材料的丧失。试管苗保存法可有效节省空间、避免了自然环境的威胁,但所需成本高,且需不断继代培养,继代培养次数增多易引起材料污染和遗传变异,致使保存材料丢失[9-11]。超低温保存法是将植物的组织或器官保存在-196 ℃的液氮中,在此温度下,被保存植物材料的生命活动几乎完全停止,延长了保存时间,避免了反复继代培养,有效地保持了植物组织的遗传稳定性,并且无需占用土地,节省了大量的空间和劳力[4,12,13]。超低温保存法克服了传统保存法存在的问题,被认为是长期保存无性繁殖植物材料的最有效、最理想的方法[3,14]。
1960年Sakai首次在Nature上报道了超低温冷冻法保存桑树材料[15]。随后不断对超低温保存体系进行优化,发展了两步冷冻法和快速冷冻法[3,4,13,16]。迄今已报道了多种果树如柑橘、杏、桃、柿子等的材料成功利用超低温法获得保存[17-20]。近年来,多个国家已建立并成功使用超低温种质资源基因库,如秘鲁的马铃薯超低温基因库[21]、比利时的香蕉种质资源超低温库[22]、韩国和德国的大蒜超低温基因库[23,24]、美国的甘薯种质资源超低温库[25]等。
1985年Kuo and Lineberge首次使用超低温保存法成功保存了苹果试管苗茎尖材料[26],之后相继报道了多种优化的苹果超低温保存技术,如:两步冷冻法[27]、玻璃化法[28,29]、小滴-玻璃化法[30]等。超低温保存法通常包含培养、预处理、预培养、低温锻炼、液氮冷冻、解冻、再生等几个步骤[31,32]。不同的超低温保存技术体系会影响苹果组织的再生和遗传稳定性,因此我们以‘Gala’苹果组培苗为材料,在保证苹果材料遗传稳定性的基础上,通过不断改进和优化玻璃化法超低温保存试验条件,进一步提高苹果种质冷冻保存的效率及稳定性。
1 材料与方法
1.1 试验材料
以‘Gala’苹果的离体茎尖为材料,组培苗在继代培养基上生长30 d,每天16 h光照,光强为75 μmo1/(m2·s),培养温度为25 ℃。
1.2 试剂
继代培养基(pH=5.8):MS、6-BA(0.5 mg/L)、NAA(0.05 mg/L)、sucrose(0.5 mol/L)、agar(0.7%);
预培养液(蔗糖浓度梯度):MS、sucrose(0~1.2 mol/L);
装载液:MS、sucrose(0.4 mol/L)、甘油(2 mol/L);
PVS2:MS、乙二醇(15%)、甘油(30%)、二甲基亚砜(15%)、sucrose(0.4 mol/L);
PVS3:甘油(50%)、sucrose(50%);
卸载液:MS、sucrose(1.2 mol/L);
恢复培养基(pH=5.8):MS、6-BA(0.5 mg/L)、sucrose(0.5 mol/L)、agar(0.7%);
1.3 ‘Gala’苹果茎尖玻璃化超低温保存步骤
4 ℃条件下,低温驯化继代生长30 d的组培苗0~8周。取含顶芽的茎段,在显微镜下剥取茎尖(长度约1.5 mm,含1~2个叶原基),放入含蔗糖(0~1.2 mol/L)的预培养液中0~7 d,每组茎尖至少30个;预培养后的茎尖放入装载液中30 min;除去装载液,添加玻璃化溶液PVS2或PVS3,0 ℃放置0~90 min;去除玻璃化溶液,再加入新的玻璃化溶液至恰好浸没茎尖,投入液氮中冷冻24 h。取出液氮中保存的材料,放入40 ℃水浴中快速化冻1 min;添加卸载液,放置10 min,重复1次;将茎尖转至恢复培养基中,暗培养1周后光照培养,光强75 μmo1/(m2·s)光周期12 h/d,温度25 ℃。
光照培养2周后统计存活率,绿色或黄绿色、长出小叶或者脱分化形成愈伤组织的茎尖均视为存活,存活率(%) = 存活的茎尖个数/总茎尖数×100,重复3次,取平均值。
2 结果分析
2.1 低温锻炼时间对超低温保存的影响
低温处驯化组培苗能诱发植物的自然休眠,提高细胞内的溶质浓度,降低自由水含量,增强试管苗的抗寒能力,有助于提升试管苗冷冻后的再生能力[33,34]。为获得‘Gala’苹果试管苗的最佳低温锻炼时间,进行了低温炼苗的时间进程试验。结果显示苹果茎尖存活率随低温锻炼时间的延长呈现逐渐上升的趋势。没有经过低温处理的试管苗茎尖存活率只有46.2%,处理1周后的茎尖存活率显著提高,达到62.7%;随着低温处理时间增长至5周,苹果茎尖存活率都逐渐升高,且升高趋势显著;处理5周后,苹果茎尖的存活率升高趋势变缓,变化不明显(图1)。随着低温处理时间增长,培养瓶内养分、水分不断减少,致使试管苗开始萎蔫、发黄甚至死亡,不利于后续茎尖的剥取,因此‘Gala’苹果的低温锻炼的最佳时间为5周。

图 1 不同低温锻炼时间对苹果茎尖超低温保存后存活率的影响
2.2 预培养液蔗糖浓度和时间对超低温保存的影响
植物材料细胞中的自由水含量是超低温保存成功的关键因素。自由水含量过高,细胞内易形成冰晶,造成细胞机械损伤;含量过低,细胞会因过度脱水而死亡[35]。按冰冻保护剂能否渗透到细胞内,可将其分为渗透性和非渗透性两类,蔗糖属于非渗透性冰冻保护剂,是目前预培养培养基中常添加的冰冻保护剂[36,37]。为研究‘Gala’苹果茎尖预培养的最适蔗糖浓度,进行了蔗糖浓度梯度实验。由图2A可知,苹果茎尖存活率随蔗糖浓度的升高呈现先上升再下降的趋势,预培养液中蔗糖浓度为0.3 mol/L时,存活率达到最高,说明预培养液中蔗糖浓度显著影响苹果茎尖玻璃化法超低温保存的成活率。
植物组织的预培养时间对玻璃化超低温保存的成功率有很大的影响。如图2B所示,苹果茎尖玻璃化法超低温保存后的存活率随预培养天数的延长表现出先上升后下降的趋势,在预培养5天时苹果茎尖存活率达到最高,之后随着时间延长,再生率开始下降。
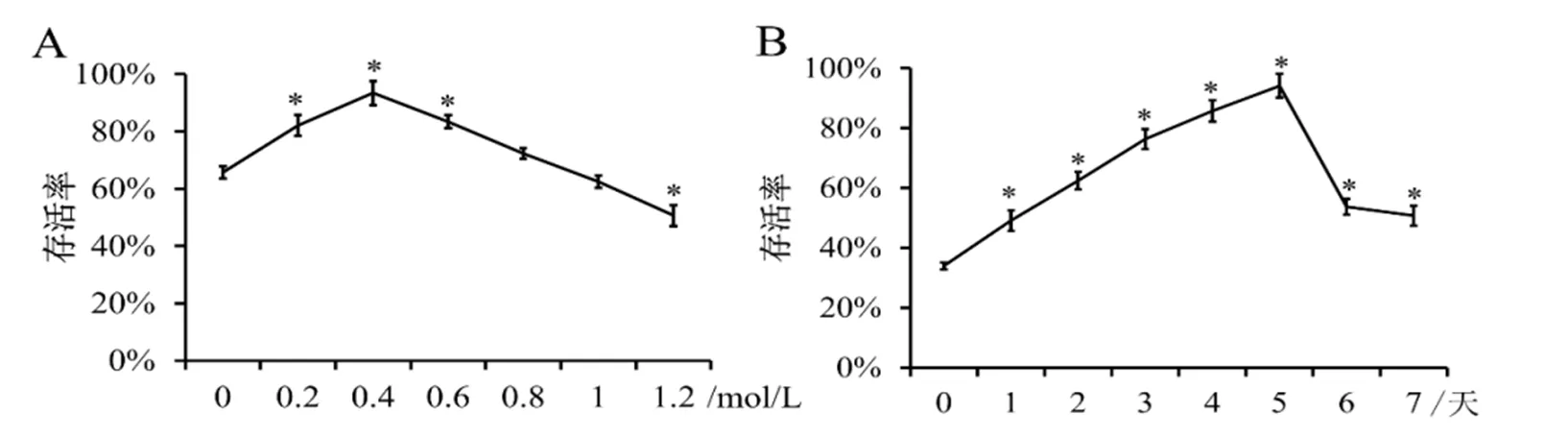
图 2 预培养基蔗糖浓度和预培养时间对苹果茎尖超低温保存后存活率的影响
A:不同蔗糖浓度预培养苹果茎尖,超低温保存后存活率的统计;B:苹果茎尖预培养不同时间,超低温保存后存活率的统计。
A: Effect of sucrose concentration of preculture on survival rate of cryopreserved ‘Gala’ shoot tips; B: Effect of preculture duration on survival rate of cryopreserved ‘Gala’ shoot tips.
2.3 玻璃化溶液及处理时间对超低温保存的影响
玻璃化溶液对茎尖细胞有渗透保护的作用,降低细胞的自由水含量,减少冷冻时细胞内冰晶的形成,进而保护细胞的完整性,因此玻璃化法可提高超低温保存的存活率[38]。目前常用的玻璃化溶液主要有PVS2[39]和PVS3[40]两种。由于玻璃化溶液的浓度及处理时间影响植物细胞的状态及再生效果,需不断优化试验条件,寻找最佳的玻璃化溶液和处理时间。由图3所知,与没有经过玻璃化溶液处理的材料相比,玻璃化处理的茎尖材料的再生率显著提高,就‘Gala’苹果茎尖材料而言,玻璃化溶液PVS3的效果要明显优于PVS2,且处理60 min时,冷冻保存后的再生率高达96.6%,效果最好。

图 3 玻璃化溶液及处理时间对苹果茎尖超低温保存后存活率的影响
2.4 ‘Gala’苹果茎尖玻璃化超低温冷冻保存后的生长状态分析
为探究优化的玻璃化超低温保存技术是否影响再生后组培苗的生长状态,将超低温保存的苹果茎尖与未经超低温保存的茎尖在恢复培养基上进行生长并观察其生长状态(图4)。通过统计对比发现,玻璃化超低温冷冻保存的苹果茎尖再生苗在叶片长宽比、叶片颜色、扩繁系数和生根能力等方面均与未经超低温保存的茎尖再生苗无显著差异(表1)。说明优化的‘Gala’苹果茎尖玻璃化超低温冷冻保存法不影响植物材料的生长状态,能保持其生长的稳定性。

图 4 苹果茎尖再生苗
A:超低温冷冻保存复活后的组培苗;B:未冷冻保存处理的苹果茎尖组培苗。
A: Regrowth of cryopreserved ‘Gala’ shoot tips; B: Regrowth of apple stem tip without cryopreservation treatment.

表 1 超低温冷冻保存后苹果茎尖组培苗生长状态观察
3 讨 论
超低温保存技术的成功率与被保存植物材料的生理特性有密切关系,因此必须对材料进行预处理。预处理通常有反复继代、低温锻炼和预培养3种方法,进而减少细胞内的自由水含量,增强被保存材料的抗冻能力,提高超低温保存材料的再生力[41]。我们的研究发现低温锻炼和预培养都对‘Gala’茎尖的超低温保存效果有显著的影响。‘Gala’茎尖的存活率随低温锻炼时间的延长而提高,而吴传金等[42]发现超低温冷冻的新疆野苹果的成活率随低温锻炼时间的延长呈下降趋势,说明低温锻炼的效果与苹果的品种有关。由于不同苹果树种对超低温保存的要求和条件差异较大,并且整个超低温保存过程耗时较长,致使现今仍缺乏高效、广谱的苹果茎尖超低温保存技术[43],限制了苹果种质资源超低温保存库的建立。今后,在保持苹果茎尖存活率的基础上,仍需简化超低温保存技术的操作,建立简易、高效的保存体系。
多个茎尖超低温保存的研究中发现,不同实验室利用相同的技术体系保存同一基因型材料,统计的再生率表现出极大差异[44,45]。这可能是由受试材料的带毒状况不同导致的,病毒对试管苗的分化、生长及生理代谢等都有显著的影响[46]。在研究茎尖超低温保存技术时可以与脱毒技术相结合,建立新型的脱毒技术,保存苹果无毒苗,为苹果的无毒生产开辟新的途径。
4 结 论
玻璃化超低温保存法是目前果树资源种质保存的常用方法。本研究从低温锻炼时间、预培养基蔗糖浓度、预培养时间和玻璃化溶液及处理时间四个方面对‘Gala’苹果茎尖的玻璃化超低温保存体系进行了优化,获其保存的最佳体系为:将生长30 d的组培苗在4 ℃的条件下低温锻炼5周,剥取茎尖,放置于含0.4 mol/L蔗糖的预培养基中,预培养5 d,在渗透装载液中渗透30 min,0 ℃条件下,用PVS3玻璃化溶液处理60 min,放入液氮中冷冻24 h,取出后置于40 ℃水浴中1 min快速化冻,卸载液清洗两次,每次10 min,然后在恢复培养基上培养,茎尖的再生率最高且生长稳定性好。
[1] 李育农.世界苹果属植物的起源演化研究新进展[J].果树科学,1999,16(S1):8-19
[2] 汪景彦,程存刚,鲍玉院,等.论我国苹果生产类型与技术特点[J].果农之友,2008,2:4
[3] Wang QC, Perl A. Cryopreservation in floricultural plants [M]//Silva JT (ed) Floriculture, ornamental and plant biotechnology: advances and topical issues. Global Science Book, London, 2006:524-539
[4] Engelmann F. In vitro conservation methods [M]//Callow JA, Ford-Lloyd BV, Newbury HJ (eds) Biotechnology and plant genetic resources. CAB International, Oxon, 1997:119-161
[5] 刘凤之,王昆,曹玉芬,等.我国苹果种质资源研究现状与展望[J].果树学报,2006,23(6):1009-9980
[6] Gao Y, Liu FZ, Wang K,. Genetic diversity ofcultivars and wild relatives in the Chinese National Repository of Apple Germplasm Resources [J]. Tree Genetics & Genomes, 2005,11(5):106
[7] Hanke MV, Flachowsky H, Hofer M,. Collecting fruit genetic resources in the North Caucasus region [J]. Journal Fur Kulturpflanzen, 2012,64(4):126-136
[8] Sartori A, Grassi F, Vitellozzi F,. The conservation activity on fruit tree germplasm in Italy [J]. Acta Horticulturae, 2003,623(23):217-224
[9] Hao YJ, Deng XX. Genetically stable regeneration of apple plants from slow growth [J]. Plant Cell Tissue and Organ Culture, 2003,72(3):253-260
[10] Negri V, Tosti N, Standardi A. Slow-growth storage of single node shoots of apple genotypes [J]. Plant Cell Tissue and Organ Culture, 2000,62(2):159-162
[11] Kovalchuk I, Lyudvikova Y, Volgina M,. Medium, container and genotype all influence in vitro cold storage of apple germplasm [J]. Plant Cell Tissue and Organ Culture, 2009,96(2):127-136
[12] Benson EE. Cryopreservation of phytodiversity: a critical appraisal of theory & practice [J]. Critical Reviews in Plant Science, 2008,27(3):141-219
[13] Reed BM, Uchendu E. Controlled rate cooling [M]//Reed BM. Plant cryopreservation: A practical guide. London: Springer Press, 2008:77-92
[14] Feng CH, Yin ZF, Ma YL,. Cryopreservation of sweet potato () and its pathogen eradication by cryotherapy [J]. Biotechnology Advances, 2011,29(1):84-93
[15] Sakai A. Survival of the twigs of woody plants at -196 ℃ [J]. Nature, 1960,185:392-394
[16] Wang RR, Gao XX, Chen L,. Shoot recovery and genetic integrity ofshoot tips following cryopreservation bydroplet-vitrification [J]. Scientia Horticulturae, 2014,176:330-339
[17] 艾鹏飞,罗正荣.柿和君迁子试管苗茎尖玻璃化法超低温保存及再生植株遗传稳定性研究[J].中国农业科学,2004,37(12):2023-2027
[18] 王子成.柑橘种质资源的离体保存研究[D].武汉:华中农业大学,2002
[19] 赵艳华,吴雅琴.桃离体茎尖的超低温保存及植株再生[J].园艺学报,2006,33(5):1042-1044
[20] Channuntapipat C, Collins G, Bertozzi T,. Cryopreservation of in vitro almond shoot tips by vitrification [J]. Journal of Horticultural Science & Biotechnology, 2000,75(2):228-232
[21] Panta A, Panis B, Ynouye C,. Improvement of potato cryopreservation for the long-term conservation of Andean landraces at the International Potato Center (CIP) [J]. Cryobiology, 2006,53(3):401-403
[22] Panis B. Cryopreservation of Musa germplasm [M]//Engelmann F, Benson E. Technical Guidelines No. 9. 2nd edition. Bioversity International, 2009
[23] Zanke C, Zamecnik J, Kotlińska T,. Cryopreservation of garlic for the establishment of a European core collection [J]. Acta Horticulturae, 2011,908:431-438
[24] Kim HH, Popova E, Shin DJ,. Cryobanking of Korean Allium germplams collections: results from a 10 year experience [J]. Cryo Letters, 2012,33(1):45-57
[25] Vollmer R. Criopreservación de yemas apicales del tallo de camote ((L.) Lam.) conel método de “Vitrificación en la gota pequeña de PVS2” [D]. Lima: National University for Agronomic Science, 2013.
[26] Kuo CC, Lineberger RD. Survival of in vitro cultured tissue of ‘Jonathan’ apples exposed to -196 ℃ [J]. Hort Science, 1985,20(4):764-767
[27] Wu YJ, Engelman F, Zhao YH,. Cryopreservation of apple shoot tips: importance of cryopreservation technique and of conditioning of donor plants [J]. Cryo Letters, 1999,20(2):121-130
[28] Liu YG, Wang XY, Liu LX. Analysis of genetic variation in surviving apple shoots following cryopreservation by vitrification [J]. Plant Science, 2004,166(3):677-685
[29] Kushnarenko SV, Romadanova NV, Reed BM. Cold acclimation improves regrowth of cryopreserved apple shoot tips [J]. Cryo Letters, 2009,30(1):47-54
[30] Condello E, Caboni E, Andrè E,. Cryopreservation of apple in vitro axillary buds usingdroplet-vitrification [J]. Cryo Letters, 2011,32(2):175-185
[31] Harding K. Genetic integrity of cryopreserved plant cells: areview [J]. Cryo Letters, 2004,25(1):3-22
[32] González-Arnao MT, Engelmann F. Current development and application of plant cryopreservation in Latin America and the Caribbean [J]. Acta Horticulturae, 2011,908(908):447-452
[33] Bilavčík A, Zámečník J, Faltus M,. Dormancy development during cold hardening of in vitro cultured Malus domestica Borkh. plants in relation to their frost resistance and cryotolerance [J]. Trees, 2012,26(4):1181-1192
[34] Kushnarenko S, Kovalchuk I, Mukhitdinova Z,. Ultrastructure study of apple meristem cells during cryopreservation [J]. Asian Aust J Plant Sci Biotechnol, 2010,4(1):10-20
[35] Keefe PD, Moore KG. Freeze desiccation: a second mechanism for the survival of hydrated lettuce (L.) seed at sub-zero temperatures [J]. Annals of Botany, 1981,47(5):635-645
[36] Niino T, Tashiro K, Suzuki M,. Cryopreservation of in vitro gown shoot tips of cherry and sweet cherry by one-step vitrification [J]. Sci-Hortic, 1997,70(2-3):155-163
[37] Leena R. Effect of abscisic acid, cold hardening, and photoperiod on recovery of cryopreserved in vitro shoot tips of silver birch [J]. Cryobiology, 1998,36(1):32-39
[38] Niino T, Sakai A, Yakuwa H,. Cryopreservation of in vitro-grown shoot tips of apple and pear by vitrification [J]. Plant Cell Tissue and Organ Culture, 1992,28(3):261-266
[39] Sakai A, Kobayashi S, Oiyama I. Cryopreservation of nucellar cells of navel orange (Osb. var.Tanaka) by vitrification [J]. Plant Cell Reports, 1990,9(1):30-33
[40] Nishizawa S, Sakai A, Amano Y,. Cryopreservation of asparagus (L.) embryogenic suspension cells and subsequent plant regeneration by vitrification [J]. Plant Science, 1993,91(1): 67-73
[41] Sopalun K, Thammasiri K, Ishikawa K,. Vitrification-based cryopreservation of grammatophyllum speciosum protocorms [J]. CryoLetters, 2010,31(4):347-357
[42] 吴传金,陈学森,曾继吾,等.新疆野苹果()超低温保存及其植株再生[J].遗传资源学报,2008,9(2):243-247
[43] Condello E, Caboni E, Andrè E,. Cryopreservation of apple in vitro axillary buds using droplet-vitrification [J]. Cryo Letters, 2011,32(2):175~185
[44] Hao YJ, Liu QL, Deng XX. Effect of cryopreservation on apple geneticresources at morphological, chromosomal, and molecular levels [J]. Cryobiology, 2001,43(1):46-53
[48] Feng CH, Cui ZH, Li BQ,. Duration of sucrose preculture is critical for shoot regrowth of in vitro-grown apple shoot-tips cryopreserved by encapsulation-dehydration [J]. Plant Cell Tissue and Organ Culture, 2013,112:369-378
[46] Li JW, Wang B, Song XM,. Potato leafroll virus (PLRV) and Potato virus Y (PVY) influence vegetative growth, physiological metabolism, and microtuber production of in vitro-grown shoots of potato (L.) [J]. Plant Cell Tissue and Organ Culture, 2013,114:313-324
Cryopreservation of 'Gala' Apple in Vitro by Vitrification
XU Na, CHEN Gui-ling, YANG Lei, ZHU Zi-han, CHEN Li, HAN Ya-ding, LIU Fei*
276800,
We optimized the vitrified cryopreservation system from low-temperature trained time, sucrose concentration of pre-culture medium, pre-culture time, vitrification solution and treatment time for cryopreservation of 'Gala' apple stem tip. Tissue culture seedlings grown for 30 days were subjected to cold acclimation at 4℃ for 5 weeks; the shoot tips were stripped, cultured in the preculture solution containing 0.4 mol/L sucrose for 5 days; followed by permeating in loading solution for 30 min; vitrified by PVS3 for 60 min at 0 ℃;frozen in liquid nitrogen for 24 h; thawed in water bath at 40 ℃for 1 min; washed twice by dilution solution, 10 min each time; finally recovered in the medium, the shoot tips grew stably and the regeneration rate was up to 96.6%. The study has successfully established effective vitrification cryopreservation protocol of 'Gala' shoot tips, and provided an innovative way for long-term conservation of apple germplasm.
‘Gala’ apple; cryopreservation; tissue culture
S602.4
A
1000-2324(2023)05-0718-06
10.3969/j.issn.1000-2324.2023.05.011
2023-06-21
2023-10-19
国家自然科学基金(32000194);山东省自然科学基金(ZR2017BC081);作物生物学国家重点实验室开放项目(2017KF08);山东省高等学校青年创新团队(2022KJ102);山东省教育科学规划创新素养专项课题(2022CYB210);济宁医学院教师国内访学项目
徐娜(1985-),女,博士研究生,研究方向:植物营养学及果树种质资源保存. E-mail:xuna828@163.com
Author for correspondence. E-mail:liufei092531@163.com

