金龟子绿僵菌对入侵性害虫椰子织蛾的致病力
万依依,张华峰,倪德芳,赵普凡,胡莎莎,童应华
金龟子绿僵菌对入侵性害虫椰子织蛾的致病力
万依依,张华峰,倪德芳,赵普凡,胡莎莎,童应华*
福建农林大学林学院, 福建 福州 350002
椰子织蛾是危害棕榈科植物的一种入侵性害虫。为评价金龟子绿僵菌(Metarhizium anisopliae (Metschnikoff))对椰子织蛾幼虫的致病情况,室内采用浸液法测定了5株绿僵菌菌株对椰子织蛾3龄幼虫的致病力,结果表明:以浓度(1.0±0.5)×106个孢子∙mL-1的孢子悬液接菌7 d后,各菌株对椰子织蛾幼虫的致病力差异较大,校正死亡率范围在5.00~95.00%之间。其中,MaHA-01菌株对其致病力较强,校正死亡率和僵虫率分别为(95.00±0.00)%和(94.00±2.24)%,均极显著高于其它菌株处理,且LT50较短为4.20 d;其次是Ma1775。MaHA-01菌株接菌后5 d对椰子织蛾3龄幼虫的LC50为3.62×104个孢子∙mL-1。通过时间-剂量-死亡率(TDM)模型参数估计,MaHA-01菌株对椰子织蛾幼虫的致死效应较强的时间在接菌后3~5 d。可见,MaHA-01菌株对椰子织蛾幼虫有较强的致病力,在该害虫生物防治中可以应用。
金龟子绿僵菌; 椰子织蛾; 生物防治
椰子织蛾Walker,隶属于鳞翅目(Lepidoptera),织蛾科(Oecophoridae)[1,2],又名椰子木蛾、椰子黑头履带虫、椰蛀蛾[3]。是我国第四批公布的一种入侵性害虫[4](环境保护部办公厅2016年12月20日发布),并在2014年由国家林业局根据《植物检疫条例实施细则(林业部分)》,将其增补为全国林业危险性有害生物[5](2014年第6号)。该虫原产地在印度和斯里兰卡[6],后扩散至缅甸、泰国、印度尼西亚等国[7-9]。2013年在我国海南万宁首次发现,目前在我国广西、广东、福建沿海等地均有分布[10]。椰子织蛾主要以幼虫取食危害棕榈科植物的叶片,偶尔危害甘蔗和香蕉[9]。该虫在海南一年发生5代,世代重叠严重[11],以高龄幼虫在蛀道中越冬[12]。雌成虫产卵于叶片之间或叶片背部[13],卵5~7 d孵化,幼虫取食叶片表面叶肉,并吐丝与自己的粪便混合筑成虫道,粘连在叶片上,幼虫在虫道内生活取食,直至化蛹[14,15]。幼虫初期聚集,而后分散危害,3龄后由下层叶片逐渐向中、上层危害[11]。该虫危害影响寄主植物的生长,导致花穗量减少而减产[16],严重时,寄主叶片卷曲发黄,树冠干枯,形似火烧[11,17]。
目前椰子织蛾的防治主要以化学防治和生物防治为主。化学防治方面,Shivashankar T运用印楝素水剂进行树干注射,对椰子织蛾幼虫有显著控制作用[18];崔义等用4.5%高效氯氰菊酯乳油2000倍液对绿化带的椰子树进行处理,用药后5 d的防治效果为89.85%[19];李东等用20%好年冬乳油1200倍液、44%多虫清乳油1 200倍液、50%甲刻水分散粒剂800倍液对种植基地的霸王棕、贝叶棕进行处理,用药后10 d的防治效果达到93.16~95.24%[12]。刘向蕊等用5种杀虫剂对椰子织蛾幼虫进行室内毒力测定,筛选出甲维盐的毒力最强,以20 mg/L浓度处理后72 h致死率为86.67%[20];杨崇慧等研究表明阿维菌素对椰子织蛾有良好的致死效果,室内试验以5 mg/L浓度用药后72 h致死率可达92.85%[21];曾宪海等用营养灌根结合苦参碱乳油和甲维盐等综合处理大王椰子树7个月后,发现该处理对椰子织蛾有明显的防治效果,植株生长正常,并新增健康叶片[22];敖苏等测定了3种入侵植物乙醇提取物对椰子织蛾的杀虫活性,以40 mg/mL浓度的3种植物乙醇提取物处理后72 h杀虫活性均超过50%[23]。生物防治方面,海南林间调查发现了6种椰子织蛾的寄生性天敌,已鉴定出4种:褐带卷蛾茧蜂(Minamikawa)、广大腿小蜂(Walker)、广黑点瘤姬蜂(Fabricius)、周氏啮小蜂(Yang);其中广黑点瘤姬蜂和广大腿小蜂为蛹寄生蜂,林间寄生率分别为3.6%和6.0%;褐带卷蛾茧蜂为幼虫寄生,林间寄生率为12.2%[11],室内寄生率为83%[24]。可见,化学农药存在高残留、高毒性、对人畜安全性低等问题;生物农药林间防治效率低,药效作用缓慢;寄生蜂林间种群寄生率低,且寄生蜂种群不稳定,因此,亟待寻找对椰子织蛾安全、有效的控制方法。
绿僵菌是较早应用于害虫生物防治的虫生真菌之一,寄主范围广[25],可寄生5个目30个科约200多种昆虫、螨类及线虫[26-28]。绿僵菌主要通过分生孢子吸附于昆虫体表,萌发产生芽管,形成附着胞,产生侵染钉穿透昆虫体壁,消耗寄主营养、破坏组织并释放毒素而致死昆虫[29]。调查发现,椰子织蛾3~4月开始繁殖,5~7月为爆发期[17],绿僵菌最适生长温度为20~30 ℃[30],有利诱发其流行性真菌病,从而控制虫口密度,减少林间经济损失。目前绿僵菌对椰子织蛾的致病力研究与应用较少,国外未有相关报道,国内仅有1篇报道[31]。因此,本研究选用金龟子绿僵菌菌株,测定其对椰子织蛾幼虫的致病力,为椰子织蛾的林间生物防治提供理论依据和菌种资源。
1 材料与方法
1.1 供试虫
供试椰子织蛾幼虫采集于福建省厦门市湖里区汤屿路五缘湾湿地公园(N24°52′45.6″,E118°18′14.3″)。将采集的幼虫放入塑料盒(15×10×10 cm)内,置于温度(25±1)℃、相对湿度70%的人工气候箱内(LTC-450),以新鲜的蒲葵((Jacq.)R.Br.)叶片喂食饲养。每2 d更换一次食物。
1.2 供试菌种
供试的5株金龟子绿僵菌菌株基本情况见表1。

表 1 供试菌株来源
1.3 孢子悬液的制备
供试菌在PPDA斜面培养基(200 g去皮马铃薯,琼脂18 g,蛋白胨10 g,葡萄糖20 g,加水至1000 mL,pH值自然)上充分产孢后,用含0.05% Tween-80的无菌水洗下孢子于100 mL的锥形瓶中,置于振荡器(SHZ-B水浴恒温振荡器)上充分震荡20 min(150 r·min-1)。用血球计数板计数,将孢子悬液配制成所需浓度。
1.4 致病力测定
采用浸液法接菌。选择椰子织蛾3龄健康幼虫,用毛笔挑取,在浓度为(1.0±0.5)×106个孢子·mL-1的孢子悬液中浸泡3 s后,挑入有新鲜蒲葵叶片的培养皿中,用浸有无菌水的脱脂棉保湿,贴上标签,置于温度(26±1) ℃,RH(90±1)%的人工气候箱内饲养。每1菌株为1处理,每处理5个重复,每个重复20头供试虫。以浸泡相同时间无菌水的幼虫为对照。每天定时观察并记录幼虫死亡情况,以毛笔触碰不动的为死亡,并及时将死亡虫体移至无菌培养皿中,培养皿底部用滤纸浸无菌水保湿,置于恒温培养箱中(26±1) ℃培养,以虫体表面长出菌丝或分生孢子的为有效致死。连续观察统计9 d。
1.5 高致病力菌株对幼虫的LC50
采用浸液法接菌。选择高致病力的菌株,分别以浓度(1±0.5)×104、(1±0.5)×105、(1±0.5)×106、(1±0.5)×107和(1±0.5)×108个孢子·mL-15个梯度浓度的孢子悬液,接菌3龄健康幼虫,每种浓度为1处理,每处理5个重复,每重复供试幼虫20头。以浸泡相同时间无菌水的幼虫为对照。接菌后幼虫饲养和观察方法同1.4。
1.6 数据处理
数据用Excel2016处理,用SPSS Statistics 22.0软件统计分析[32],通过Duncan’s新复极差法多重比较。计算出毒力回归方程、致死中时LT50、半致死浓度LC50。用DPS数据处理系统(v7.05)对时间—剂量—死亡率模型(TDM模型)进行模拟分析[33]。计算公式如下:
2 结果与分析
2.1 椰子织蛾幼虫感染绿僵菌病症
以浓度(1±0.5)×106个孢子·mL-1菌悬液接菌后2 d,发现部分幼虫行动迟缓,食欲减退,虫体体表失去光泽;接菌后3 d开始死亡;接菌后4 d部分存活幼虫于气孔附近出现褐色斑点,感病严重幼虫体表出现黑色斑块。幼虫感染死亡初期,虫体体表为暗黄褐色,皱褶处长出白色菌丝(图1B),幼虫感染死亡中期,白色菌丝开始变绿,并向虫体无褶皱处生长,虫体体表有无色水滴状(图1C)。幼虫感染后期,死亡虫体被菌丝完全覆盖,并全部变绿(图1D)。

图 1 椰子织蛾感染绿僵菌症状
(A:健康幼虫;B:感染初期;C:感染中期;D:感染后期)
(A: Healthy larva; B: Lethal early stage; C: Lethal middle stage; D: Lethal late stage)
2.2 绿僵菌对椰子织蛾的致病力
2.2.1 椰子织蛾的累计死亡率动态统计分析椰子织蛾幼虫的累计死亡率动态,结果如图2。由图2可知,总体上,以浓度(1±0.5)×106孢子·mL-1接菌后3 d,幼虫开始死亡,3~6 d死亡率迅速上升,6 d后趋于稳定。不同菌株对幼虫的致病力差异较大,其中MaHA-01菌株处理,幼虫累计死亡率上升最快,并于接菌后7 d到达100%。其次是,Ma1775菌株处理,接菌后8 d累计死亡率可达65%。菌株MaYT-04和MaFZND-07致死效果较弱,接菌后8 d累计死亡率低于30%。Ma23-2菌株处理累计死亡率最低。可见,MaHA-01菌株对椰子织蛾幼虫有较强的致病力。

图 2 不同绿僵菌菌株处理椰子织蛾幼虫累计死亡率动态
2.2.2各菌株对幼虫致病力的比较 进一步分析比较各菌株处理7 d后椰子织蛾幼虫的死亡率,结果见表2。由表2可知,以浓度(1±0.5)×106个孢子·mL-1的孢子菌悬液接菌后7 d,MaHA-01菌株处理,幼虫校正死亡率和僵虫率最高,分别为(95.00±0.00)%、(94.00±2.24)%,极显著高于其它菌株处理,致死中时最短,LT50为4.20 d。其次是Ma1775菌株处理,校正死亡率和僵虫率均极显著高于其它3株菌株,LT50为6.71 d,其它3株菌株对椰子织蛾幼虫的致病力效果较弱,校正死亡率低于30 %,僵虫率低于20 %。可见,5株菌株中,MaHA-01对椰子织蛾幼虫的致病力较强,其次是Ma1775菌株。
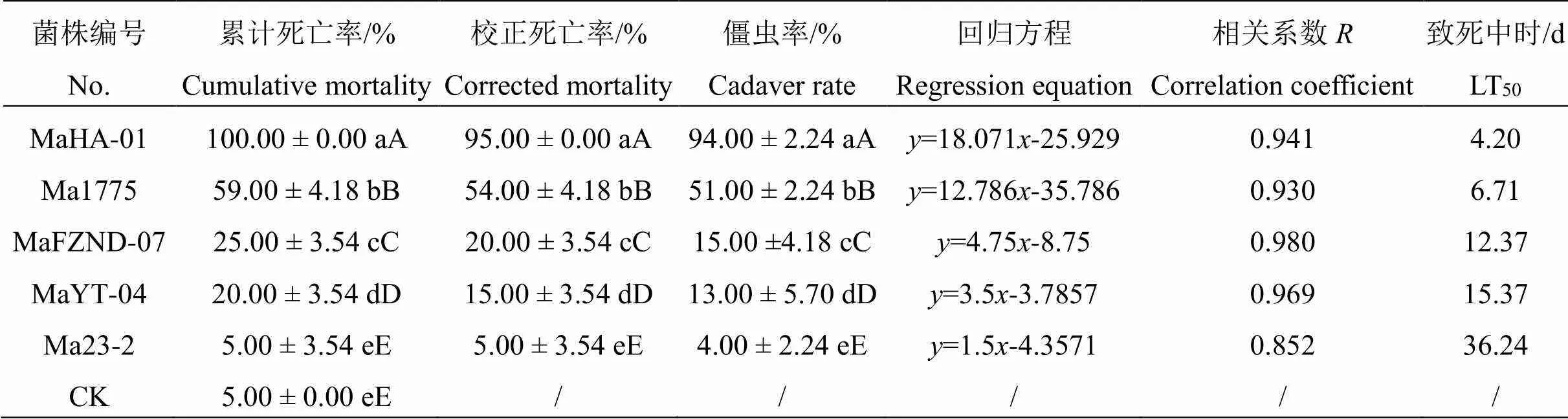
表 2 不同绿僵菌菌株对椰子织蛾幼虫的致死效果(7d)


2.3 高致病力MaHA-01菌株对幼虫的LC50
2.3.1 MaHA-01菌株对幼虫的LC50统计分析MaHA-01菌株各浓度对幼虫的致死情况,结果见表3。由表3可知,MaHA-01菌株不同浓度处理对椰子织蛾幼虫致病力差异较大,其中以浓度(1.0±0.5)×108孢子·mL-1和(1.0±0.5)×107孢子·mL-1孢子悬液处理的致病力最强,处理后5 d累计死亡率分别为(100.00±0.00)%和(91.00±4.18)%。分析MaHA-01的LC50见表4,MaHA-01菌株对椰子织蛾3龄幼虫处理后3 d和5 d的LC50分别为2.30×108孢子·mL-1,3.62×104孢子·mL-1。

表 3 MaHA-01菌株不同浓度对椰子织蛾幼虫的致死效果(5 d)

表 4 菌株MaHA-01不同浓度对椰子织蛾幼虫的LC50
2.3.2 时间-剂量-死亡率模型 分析MaHA-01菌株对椰子织蛾幼虫致病力测定的时间-剂量-死亡率模型(TMD模型),结果见表5。经过拟合度检验,卡方统计量为9.5374,值为7,值为0.21634,模型拟合无显著差异性,TMD模型拟合成功。结果中=0.523,说明各浓度MaHA-01孢子悬液对椰子织蛾幼虫均有一定致死效果;参数为表示条件死亡概率的时间效应参数,椰子织蛾幼虫在接种MaHA-01菌株3~5 d后,较前后显著要大,说明该菌株处理椰子织蛾幼虫,在3~5 d死亡数量较多,MaHA-01菌株对椰子织蛾幼虫致死效应较强。
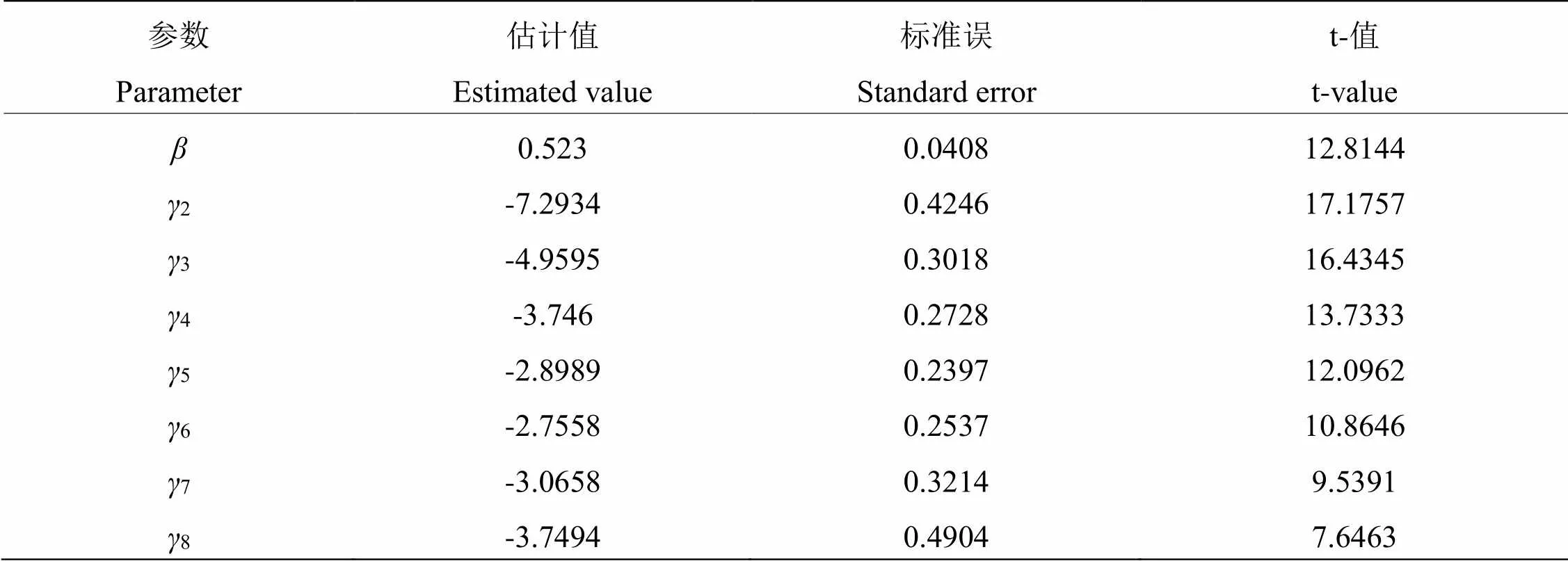
表 5 菌株MaHA-01对椰子织蛾幼虫致病力测定时间—剂量—死亡率模型模拟及参数估计
注:参数符号下标表示接种后天数。
Note: The subscripts represent the number of days after treatment.
3 讨论
棕榈科植物不仅是重要的经济作物,而且是重要的园林绿化植物。椰子织蛾的入侵和传播对我国棕榈科植物资源和产业发展构成了巨大的危害,造成严重的经济损失[17,34]。椰子织蛾的生物防治主要集中在寄生蜂的应用,用绿僵菌对椰子织蛾的致病力及其应用的相关研究较少。绿僵菌对昆虫致病力强、药效持久,对人畜、农作物无毒,无残留,且可连年发挥作用,具有广阔的市场前景[35]。孙晓东等从野外采集到的椰子织蛾僵虫上分离并筛选出高致病力绿僵菌菌株LS-Y1,以1×108个孢子·mL-1的孢子悬液处理椰子织蛾3龄幼虫后,4 d的累计死亡率为(66.67±6.66)%,6 d的LC50为4.41×106个孢子·mL-1,致死中时为3.36 d[31]。本研究的金龟子绿僵菌MaHA-01菌株以(1.0±0.5)×108个孢子·mL-1的孢子悬液对椰子织蛾3龄幼虫接菌,5 d的累计死亡率为(100.00±0.00)%。说明菌株MaHA-01对椰子织蛾致病效果较好,具有良好的生防潜力。
金龟子绿僵菌对鳞翅目幼虫的致死率其浓度呈正相关[36]。本研究为了更好评价不同绿僵菌菌株对椰子织蛾幼虫的致病力,选用浓度较低的(1.0±0.5)×106个孢子·mL-1孢子悬液对椰子织蛾幼虫进行接菌。虫龄也影响着虫生真菌对鳞翅目幼虫的致病力,虫龄越小越利于虫生真菌侵染[37]。椰子织蛾低龄幼虫发育历期较短,为避免低龄幼虫蜕皮对试验造成误差,因而选用3龄椰子织蛾幼虫进行试验。本研究分离出的5株金龟子绿僵菌菌株皆为虫生真菌,不同来源的菌株对椰子织蛾幼虫的致病力存在显著差异。分离自土壤的MaHA-01菌株对椰子织蛾幼虫有较强的致病性,说明土壤中宿存有对椰子织蛾幼虫具有致病性的绿僵菌,为椰子织蛾生物防治提供了新途径。绿僵菌分生孢子附于昆虫体表,是其成功侵染的首要环节。椰子织蛾幼虫聚集取食危害过程中,吐丝与自身粪便筑成蛀道,幼虫在蛀道中取食危害并结蛹[14,15]。因此,林间防治应用中,如何有效施菌,使绿僵菌分生孢子吸附于椰子织蛾幼虫体表而诱发流行病等问题,有待进一步研究。
4 结论
本研究以浸液法,应用了5株绿僵菌菌株对椰子织蛾进行侵染试验,发现MaHA-01对椰子织蛾幼虫具有较高的致病力,以(1.0±0.5)×106个孢子·mL-1的孢子悬液施菌,7 d累计死亡率可达100%,僵虫率为94%,LT50为4.20 d,该菌株5 d对椰子织蛾幼虫的LC50为3.62×104个孢子·mL-1,而且对椰子织蛾幼虫的致死效应较强的时间在接菌后3~5 d。可见,该菌株在生产中具有良好的应用前景。
[1] Becher VO. Identities and provenance of the gelechioid moths originally described by Francis Walker from ‘unknown countries’[J]. Systematic Entomology, 1981,6:137-141
[2] 李后魂,尹艾荟,蔡波,等.重要入侵害虫——椰子木蛾的分类地位和形态特征研究(鳞翅目,木蛾科)[J].应用昆虫学 报,2014,51(1):283-291
[3] 吕宝乾,严珍,金启安,等.警惕椰子织蛾(鳞翅目:织蛾科)传入中国[J].生物安全学报,2013,22(1):17-22
[4] 环境保护部.关于发布《中国自然生态系统外来入侵物种名单(第四批)》的公告(2016年第78号)[EB/OL].[2016-12-26].https://www.mee.gov.cn/gkml/hbb/bgg/201612/t20161226_373636.htm.
[5] 国家林业局.国家林业局公告(2014年第6号)[EB/OL].[2014-06-26].http://www.forestry.gov.cn/main/72/content-663834.html.
[6] Rao YR. An outbreak ofat Mangalore [R]. In report on the Proceedings of the fifth entomology meeting. Pusa, New Delhi.1924:92-98
[7] Alam M. A list of insects and mites of eastern Pakistan [Z]. Report of the Agriculture Department, Dhaka.1962:107
[8] Venkatesan T, Jalali SK, Murthy KS,A novel method of field release of(Muesebeck), an important primary parasitoid ofWalker on coconut [J]. Journal of Biological Control, 2003,17(1):79-80
[9] 阎伟,吕宝乾,李洪,等.椰子织蛾传入中国及其海南省的风险性分析[J].生物安全学报,2013,22(3):163-168
[10] 方萍.椰子木蛾对不同品种椰子树取食适应性研究[D].海口:海南大学,2018
[11] 李洪,刘丽,阎伟.新入侵害虫椰子织蛾的发生及防治[J].中国森林病虫,2015,34(4):11-13
[12] 李东,徐家雄.椰子织蛾生物学特性观察和防治[J].林业与环境科学,2020,36(4):68-72
[13] 金涛,李应梅,林玉英,等.椰子木蛾的产卵节律及其对寄主植物的产卵选择性[J].生物安全学报,2016,25(1):39-43
[14] 杨崇慧.椰子木蛾的生物学生态学初步研究[D].海口:海南大学,2015
[15] Mohan C, Radhakrishnan CP, Nampoothiri CK,. Leaf-eating caterpillar (-induced yield loss in coconut palm [J]. International Journal of Tropical Insect Science, 2010,30(3):132-137
[16] Mulampurath ASK, Asoke BM. Growth Discruption inWalker by Plumbagin, a naturally occurring insect growth regulator [J]. lnsect Science Application, 2002,22(4):321-323
[17] 岳建军,陈毅青,孙秀东,等.椰子木蛾对海南省不同生境园林植物的危害调查及分析[J].农业科技通讯,2017(7):160-163
[18] Shivashankar T, Annadurai RS, Srinivas M,. Control of coconut black-headed caterpillar (Walker) by systemic application of “Soluneem"-A new water-soluble neem insecticide formulation [J]. Current science, 2000,78(2):176-179
[19] 崔义,陈运金,王三勇,等.几种药剂防治椰子织蛾的效果评价[J].中国热带农业,2018(4):45-46,48
[20] 刘向蕊,吕宝乾,金启安,等.5种杀虫剂对入侵害虫椰子织蛾的室内毒力测定[J].生物安全学报,2014,23(1):13-17
[21] 杨崇慧,阎伟,刘丽,等.5种药剂对椰子木蛾的室内毒力测定[J].中国农学通报,2015,31(13):191-195
[22] 曾宪海,刘钊,唐真正,等.海南儋州大王椰子椰子织蛾综合防治效果比较试验初报[J].中国热带农业,2016(3):34-36
[23] 敖苏,林小漫,张旭,等.3种入侵植物乙醇提取物对椰子木蛾的杀虫活性研究[J].中国果树,2018(3):19-22
[24] 黄山春,李朝绪,阎伟,等.海南发现椰子织蛾的重要天敌褐带卷蛾茧蜂[J].生物安全学报,2017,26(3):256-258
[25] 王记祥,马良进.虫生真菌在农林害虫生物防治中的应用[J].浙江林学院学报,2009,26(2):286-291
[26] 王露露,王辉,熊焰,等.虫生真菌防治农作物害虫的研究进展[J].热带生物学报,2022,13(3):309-314
[27] 张娜.金龟子绿僵菌对绵羊痒螨(兔亚种)的致病力及致病机制初探[D].成都:四川农业大学,2018
[28] MOST SS.金龟子绿僵菌对根结线虫病和灰霉病的生物防治及其机理研究[D].武汉:华中农业大学,2020
[29] 王海川,尤民生.绿僵菌对昆虫的入侵机理[J].微生物学通报,1999(1):71-73
[30] 宋漳.防治马尾松毛虫绿僵菌的应用基础研究[D].福州:福建农林大学,2008
[31] 孙晓东,李富恒,阎伟,等.椰子织蛾高毒力金龟子绿僵菌菌株的筛选[J].植物保护,2016,42(6):215-218
[32] 贾春生.利用SPSS软件计算杀虫剂的LC_(50)[J].昆虫知识,2006(3):414-417
[33] 冯明光.时间—剂量—死亡率模型取代机率分析技术[J].昆虫知识,1998(4):233-237
[34] 阎伟,刘丽,李朝绪,等.入侵害虫椰子织蛾对海南椰子造成的经济损失评估[J].中国南方果树,2015,44(4):156-159
[35] 裘晖,吴振强,梁世中.金龟子绿僵菌及其杀虫机理[J].农药,2004(8):342-345
[36] 谭格,李天铭,周志成,等.金龟子绿僵菌对斜纹夜蛾幼虫的生防效果、抗氧化酶活性和肠道细菌群落的影响[J].微 生物学报,2021,61(5):1171-1183
[37] 崔璟辉,谭周进,陈浩涛.不同温湿度下球孢白僵菌对甜菜夜蛾幼虫的致病力[J].江西农业学报,2012,24(5):41-43
Pathogenicity ofto Invasive InsectWalker
WAN Yi-yi, ZHANG Hua-feng, NI De-fang, ZHAO Pu-fan, HU Sha-sha, TONG Ying-hua*
350002,
In this thesis, the pathogenicity of five(Metschnikoff) strains to the 3rd instar larvae ofwas evaluated to find high-quality control strain resources by dipping method. The results showed that the pathogenicity ofstrains to the larvae ofwas significantly different after inoculation with spore suspension at a concentration of (1.0 ± 0.5) ×106 spores·mL-1for 7 days, and the corrected mortality ranged from 5.00% to 95.00%, the MaHA-01 strain had the strongest pathogenicity, with the corrected mortality and cadaver rate of (95.00 ± 0.00)% and (94.00 ± 2.24)%, respectively, and the LT50 was 4.20 d, followed by Ma1775. The LC50 of the MaHA-01 against the 3rd instar larvae ofof 5 days after inoculation was 3.62 × 104 spores·mL-1. As estimated by the time-dose-mortality (TDM) model parameters, the lethal effect of the MaHA-01 strain on the larvae ofwas strongest 3-5 days after inoculation. MaHA-01 strain has a strong biocontrol potential for the prevention and control of. It can be seen that the strain has a strong biocontrol potential for the prevention and control of.
(Metschnikoff);Walker; biological control
S763
A
1000-2324(2023)05-0663-07
10.3969/j.issn.1000-2324.2023.05.004
2023-06-15
2023-11-11
福建省林业科学研究项目闽林科[(2017)3号]
万依依(1998-),女,硕士研究生,从事森林保护学研究. E-mail:1348369299@qq.com
Author for correpondence. E-mail:fjtongyh@163.com

