高产9α-OH-AD偶发分枝杆菌的诱变选育及其转化工艺优化
高华义,杨佳浩,何蔓,苏振华,周海杰,申雁冰,王敏
高产9α-OH-AD偶发分枝杆菌的诱变选育及其转化工艺优化
高华义,杨佳浩,何蔓,苏振华,周海杰,申雁冰*,王敏*
工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院, 天津 300457
偶发分枝杆菌()作为重要的9-羟基雄甾-4-烯-3,17-二酮(9-OH-AD)生产菌株,在甾体药物的生产中起着重要的作用。为了进一步提高偶发分枝杆菌的9-OH-AD生产水平,对原始菌株进行常压室温等离子体(ARTP)诱变处理。在最佳诱变处理时间(35 s)下,筛选得到一株高产9-OH-AD的诱变株AR-2。当投加10 g/L植物甾醇时,转化96 h,该菌株9-OH-AD摩尔生成率达87.6%,较原始菌株提高14.9%。进一步,对AR-2进行ARTP-LiCl复合诱变,确定最佳LiCl诱变浓度为3.5%,得到一株高产9-OH-AD的诱变菌株#91。当RM-β-CD添加量与底物摩尔比为1:1,投加10 g/L植物甾醇时,该菌株9-OH-AD摩尔生成率达95.7%,较原始菌株提高34.9%,具有良好的应用前景。
偶发分枝杆菌; 诱变选育; 诱变菌
9-羟基-4-雄甾烯-3,17-二酮(9-OH-AD )是生产9位上有卤素的皮质激素的重要前体,利用9-OH-AD可以合成氢化可的松、依普利酮、地塞米松、倍他米松、可的松、醋酸氟轻松、氟羟泼尼松龙等多种重要的甾体药物,它们被广泛用作抗肿瘤、抗炎、抗病毒和抗真菌药物,具有重要的商业价值[1-3]。目前9-OH-AD的生产方法主要以微生物转化法为主,以解决化学合成较难完成的C-9α位羟基的引入[4,5]。分枝杆菌,红球菌和诺卡氏菌等可以使用甾醇作为唯一的碳源和能源的微生物,常用于生产9-OH-AD[3,6-8]。
但是,目前微生物选择性侧链降解植物甾醇()制备9-OH-AD存在底物溶解度低、菌种退化,导致菌种转化率低、转化周期较长等问题[3],因此提高菌株降解生产9-OH-AD的能力具有重要的现实意义。诱变育种是利用合理有效的诱变方法及诱变剂处理微生物细胞,提高突变频率,再通过适当的筛选方法获得优质菌株的育种方法[9]。常压室温等离子体(ARTP)诱变育种,可以通过产生的等离子流改变细胞壁的结构和通透性,并引起DNA损伤,使细菌,真菌,酵母和其他微生物发生突变。与其他传统方法相比,ARTP具有突变速度快、操作方便等优势[9]。当与其他突变方法结合使用时,其突变效率将显着提高[10,11]。本研究以偶发分枝杆菌()为研究对象,采用常压室温等离子体(ARTP)和ARTP-LiCl复合诱变技术,基于2,4-二硝基苯肼(DNPH)能与9-OH-AD发生显色反应的特性进行诱变菌株的筛选[10],以摇瓶转化进行复筛,筛选得到一株遗传稳定的高效9-OH-AD生产菌株,对提高9-OH-AD产量,促进相关行业发展具有重要意义。
1 材料和方法
1.1 材料和试剂
1.1.1 菌株偶发分枝杆菌()TCCC 111744,天津科技大学系统微生物与生物制造工程研究室保藏。
1.1.2 培养基斜面培养基(g/L):蛋白胨5.0,牛肉浸膏3.0,氯化钠5.0,葡萄糖1.0,琼脂20.0,pH6.8。灭菌条件121℃,20 min。
种子培养基(g/L):磷酸氢二铵1.5,酵母粉9.0,甘油20.0,磷酸二氢钠0.5,磷酸氢二钠0.5,吐温80 0.5,碳酸钙10.0,pH调至7.2。
发酵培养基(g/L):硫酸铵1.8,尿素0.3,磷酸二氢钠0.8,磷酸氢二钠0.7,吐温80 0.2,葡萄糖9.0,PS适量,pH7.0。灭菌条件121 ℃,20 min。
1.1.3 主要试剂购自中粮天科生物工程(天津)有限公司,9-OH-AD购自Sigma Aldrich公司,甲基--环糊精购自广州泰隆国际贸易有限公司;色谱纯甲醇购自天津市康科德科技有限公司,其他试剂均为分析纯。
1.2 仪器
ARTP诱变系统,北京思清源生物科技有限公司;Agilent 1260型HPLC仪,美国Agilent;Epoch2 微孔板分光光度计,美国BioTek。
1.3 方法
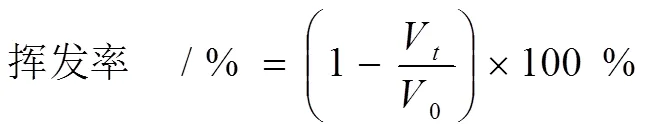
0为培养前发酵液体积(mL),V为每12 h取样时发酵液体积(mL)。
1.3.2 菌悬液的制备0.5%吐温80水溶液洗下新鲜偶发分枝杆菌斜面,调整OD600=1.2±0.2,以3%的接种量接种于容量为250 mL装有50 mL种子培养液的摇瓶中,30℃、200 r/min振荡培养至对数期(约22~24 h)。取适量菌液于无菌的2 mL EP管内,9000 r/min离心2 min,将收集的菌体重新悬浮于吐温80-生理盐水的水溶液中,调整其菌液OD600=0.6~0.8,作为诱变时的菌悬液。
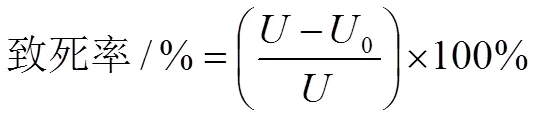
为未经诱变处理活菌数,0为诱变处理活菌数。
1.3.4 ARTP与LiCl复合诱变[10]ARTP诱变完成后,向各装有诱变后载片的EP管中加入1 mL 3~4%的LiCl溶液,37 ℃水浴处理30 min,间歇震荡1 min,加1 mL 0.9%吐温80-生理盐水终止反应。对复合诱变菌悬液进行适当梯度稀释,分别取100 µL涂布在琼脂培养基上,30 ℃培养72 h。
1.3.5 诱变菌株的初筛及复筛挑取诱变后的单菌落,另取出发菌株作为对照,在24深孔板培养至OD600约为0.8,向孔板中加入2 g/L AD,转化12 h后取0.5 mL样品。每个样品用2倍乙酸乙酯萃取,取25 μL萃取液加入至96孔板中,然后加入100 μL DNPH溶液进行显色反应[10],选择颜色浅的菌株进行PS摇瓶发酵复筛。
1.3.6 甾醇转化与检测[7]将步骤诱变培养得到的菌落接种于斜面培养基,用0.5%的吐温80无菌水溶液洗下,调整OD600在1.0 ± 0.2左右。以3%的接种量接种于装有50 mL种子培养液的250 mL摇瓶中,30 ℃,200 r/min培养至对数生长期(22~24 h),以8%接种量接种于50 mL发酵液的挡板瓶中,30 ℃,140 r/min,培养4 d,定时取样萃取,使用高效液相色谱法(HPLC)进行定量分析。
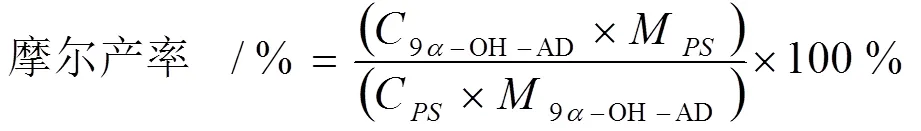
9α-OH-AD为9-OH-AD浓度(g/L),C为浓度(g/L),M9α-OH-AD为9-OH-AD相对分子质量,M为相对分子质量。
C1为9-OH-AD在时间1时的浓度(g/L),C2为9-OH-AD在时间2时的浓度(g/L),Δ为1与2的时间差(h)。
1.3.7 诱变菌株的遗传稳定性实验将复筛得到的高产菌株转接斜面扩大培养5次,每次采用1.3.6的方法对诱变获得的高产菌株进行稳定性验证生物转化实验,以获得遗传稳定性较好的突变菌株。
1.3.8 偶发分枝杆菌诱变菌株转化工艺的建立在获得高产9-OH-AD诱变菌株的基础上,使用最佳的促溶介质RM--CD,建立高浓度底物的生物转化工艺,以提高9-OH-AD的产量。将培养约22 h的种子培养液,按8%的接种量接种于含有不同量RM--CD的50 mL的发酵培养基中(RM--CD与PS的摩尔比为0.25:1,0.5:1,1:1,1.5:1,2:1,3:1),考察RM--CD添加量对转化的影响。以同样的方法,将种子液接种于含有不同PS投加量的50 mL发酵培养基中(8 g/L,10 g/L,12 g/L,15 g/L,20 g/L),考察PS添加量对转化的影响。
1.4 数据处理
所有数据均用Excel和Origin 2021软件处理,采用ANOVA分析组间差异显著性,差异显著性的水平设置为<0.05。
2 结果与分析
2.1 24微孔板培养体系的确定
24微孔板培养是本研究筛选方法建立的基础,菌种在24微孔板中的生长状态会直接影响实验筛选的准确性。如表1所示,24微孔板的装液量越少,液体挥发越严重,当微孔板装液量在1.4 mL以下时,液体挥发率明显高于24微孔板中的其它装液量,且菌体几乎不生长。当装液量为1.6 mL以上时,其液体挥发率明显低于摇瓶,装液量为2.0 mL的挥发率较小且菌体生长状态良好,为高效且有利于筛选工作的进行,所以选择24微孔板的最佳装液量为2.0 mL。
2.2 高产9α-OH-AD偶发分枝杆菌诱变选育
2.2.1 ARTP诱变时间的确定为确定ARTP对偶发分枝杆菌出发菌株的诱变作用条件,测定了ARTP作用不同时间对出发菌株的致死率,其致死率曲线如图1 (a)所示。随着诱变时间的延长,菌落数逐渐减少,出发菌株的诱变致死率呈现不断上升的趋势。在诱变时间为25 s、35 s和60 s时致死率分别为77.8%、89.3%和97.4%。近年来采用ARTP诱变多选择致死率在85%~95%范围内的对应时间,此时正突变率更高,所以本实验选择的ARTP诱变时间为35 s~50 s。
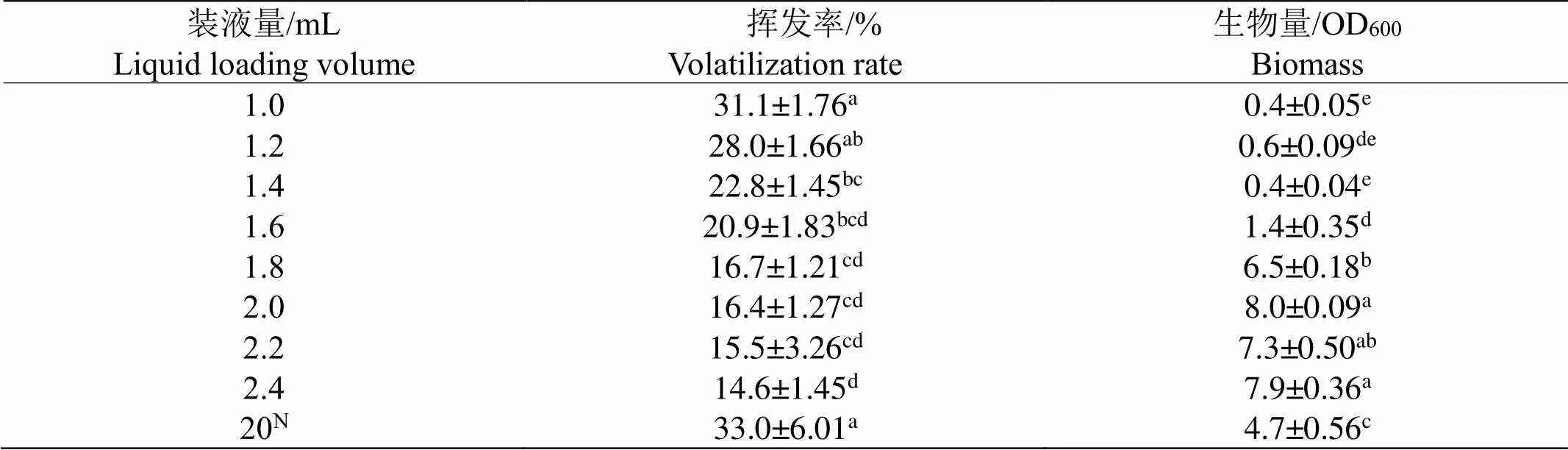
表 1 24深孔板不同装液量下的液体挥发率及菌种生长情况
注:N表示摇瓶装液量的体积。不同小写字母表示在0.05的显著水平。
Note: N denotes the volume of the shake bottle filled with liquid.The different small letters showed the significant levels at 0.05.
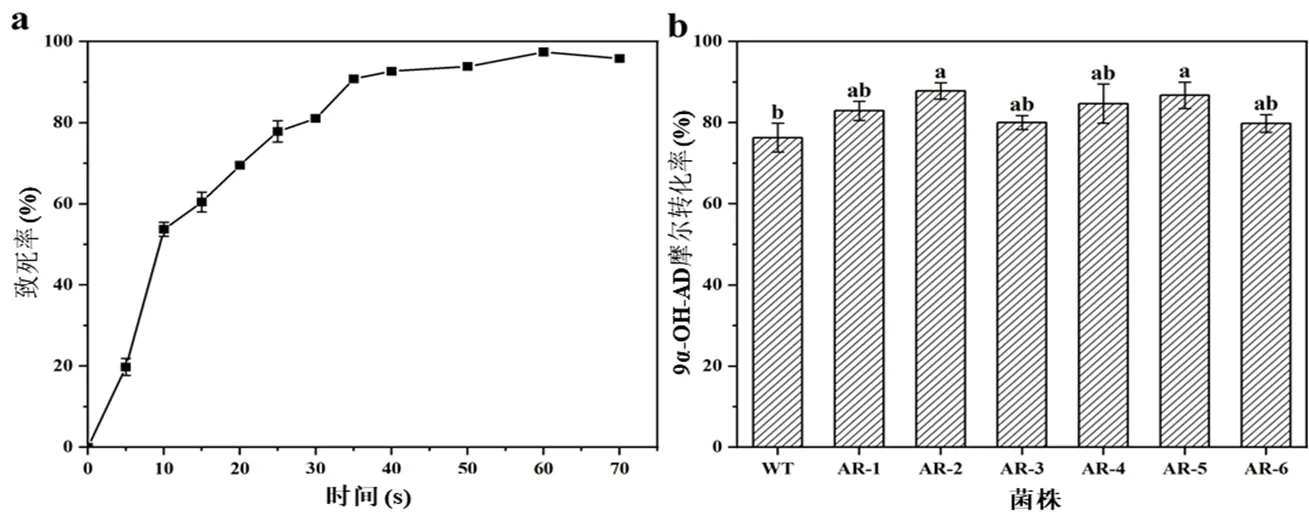
图 1 ARTP诱变菌株的获得
(a) ARTP诱变致死率曲线ARTP mutagenesis lethality curve;(b) ARTP诱变菌株转化率Transformation rate of ARTP mutagenized strains
注:不同小写字母表示在0.05的显著水平。
Note: The different small letters showed the significant levels at 0.05.
2.2.2 ARTP诱变菌株的获得TCCC 111744作为出发菌株,经ARTP分别诱变处理35 s、40 s、50 s,得到278株、200株、176株菌株。将诱变处理获得的菌株进行DNPH显色反应筛选。共有64株菌株的产物与显色液生成明显的砖红色沉淀,从初筛菌株中选择颜色最深的6株进行摇瓶发酵性能验证,如图1 (b)所示,分别编号为AR-1、AR-2、AR-3、AR-4、AR-5、AR-6,其9-OH-AD的摩尔转化率分别为82.8%、87.6%、80.1%、84.6%、86.5%、79.6%。其中,AR-2产物摩尔转化率较出发菌株(76.1%)提高了15.1%。
2.2.3 LiCl添加浓度的确定以ARTP诱变获得产量积累量较高的AR-2作为LiCl诱变的出发菌株,测定了不同LiCl浓度对菌株致死率的影响,如图2 (a)所示。结果表明,随着LiCl浓度的逐渐增加,致死率增高。当LiCl浓度低于3%时,诱变致死率较小,LiCl浓度为3.5%时,致死率达90.8%。一般LiCl诱变选取致死率90%效果较佳,所以确定LiCl的最佳使用浓度为3.5%进行复合诱变。
2.2.4 ARTP-LiCl诱变菌株的获得以ARTP诱变时间35 s,LiCl诱变浓度3.5%对AR-2进行复合诱变处理,经初筛和复筛得到13株转化效率较高的诱变菌株,对13株诱变菌株进行转化摇瓶复筛实验。摇瓶复筛投加PS浓度10 g/L,促溶介质为RM--CD,转化时间96 h。如图2 (b)所示,13株诱变菌株较出发菌株AR-2相比,其中有4株诱变菌株9α-OH-AD的积累量有不同程度的增加,分别为#91、#107、#111、#140,9α-OH-AD摩尔转化率分别达到95.7%、89.8%、89.5%、94.5%。结果表明ARTP-LiCl诱变选育是提高PS生物转化生成重要药物中间体转化效率的有效方法。
为详细的了解诱变菌株的发酵性能,对摇瓶复筛获得的9-OH-AD积累量较多的#91诱变菌株进行转化过程的测定,结果如图2 (c)所示,诱变菌株与出发菌株在48 h前,产物的积累量和积累速率相当,但在转化48-72 h,诱变菌株迅速生成产物9-OH-AD,产物生成速率达0.09 g/(L·h),较出发菌株AR-2生成速率0.06 g/(L·h)提高61.7%,较出最初的初发菌株提高212%,表明诱变菌株比出发菌株具有更强的转化性能。
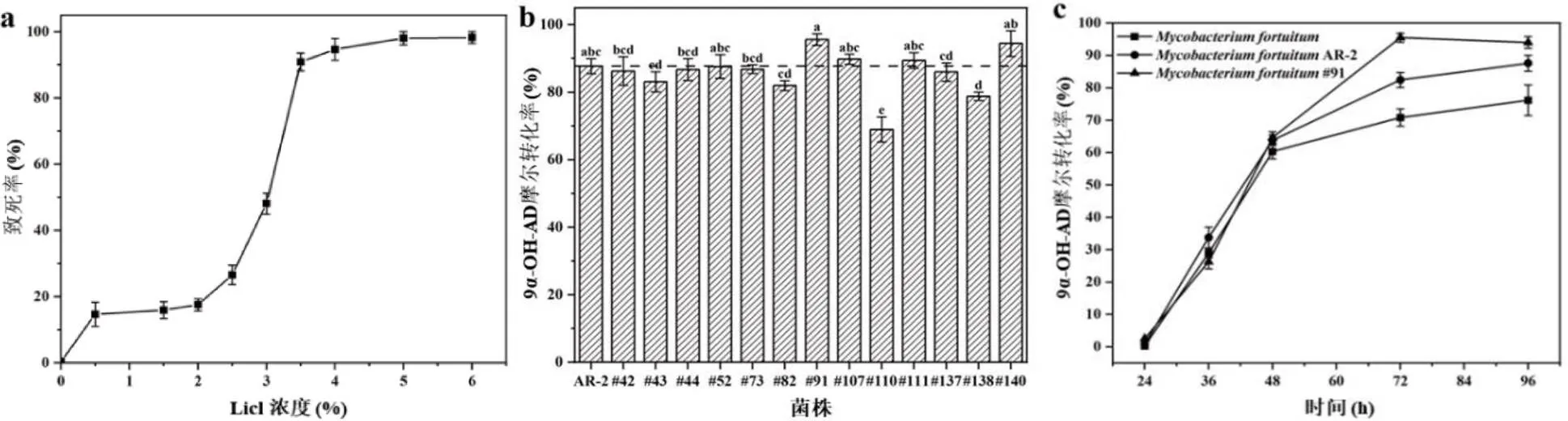
图 2 ARTP-LiCl复合诱变菌株的获得
(a) LiCl诱变致死率曲线LiCl mutagenicity lethality curve;(b) ARTP-LiCl诱变菌株转化率Transformation rate of ARTP-LiCl mutagenic strain;(c) 优势诱变菌株转化过程曲线Transformation process curve of dominant mutagenic strain.
注:不同小写字母表示在0.05的显著水平。
Note: The different small letters showed the significant levels at 0.05.
为了验证诱变获得的菌株遗传稳定性和高产性,对ARTP-LiCl复合诱变获得的#91在琼脂培养基上连续传代培养5次,每一代按实验方法进行发酵实验,并利用HPLC测定其9-OH-AD的浓度并计算转化率。结果如表2所示,该菌株在5次传代培养中积累9-OH-AD 能力基本保持稳定,说明ARTP-LiCl复合诱变筛选获得的菌株具有良好的遗传稳定性。

表 2 不同传代次数ARTP-LiCl复合诱变菌株9α-OH-AD积累稳定性实验
注:不同小写字母表示在0.05的显著水平。
Note: The different small letters showed the significant levels at 0.05.
2.3 诱变菌株转化工艺优化
2.3.1 甲基-β-环糊精添加量对诱变菌株底物转化的影响属于疏水性化合物,由于其在水中的溶解度较低的原因,严重影响了菌种的转化效率。RM--CD可以有效地提高疏水性甾体化合物在水相中的溶解度,促进底物进入微生物细胞以利于转化的进行,进而提高底物的转化率。探究了RM--CD的添加量对转化的影响,其中,RM--CD的添加量与投加量的摩尔比分别为0.25:1、0.5:1、1:1、1.5:1、2:1,的浓度为10 g/L。
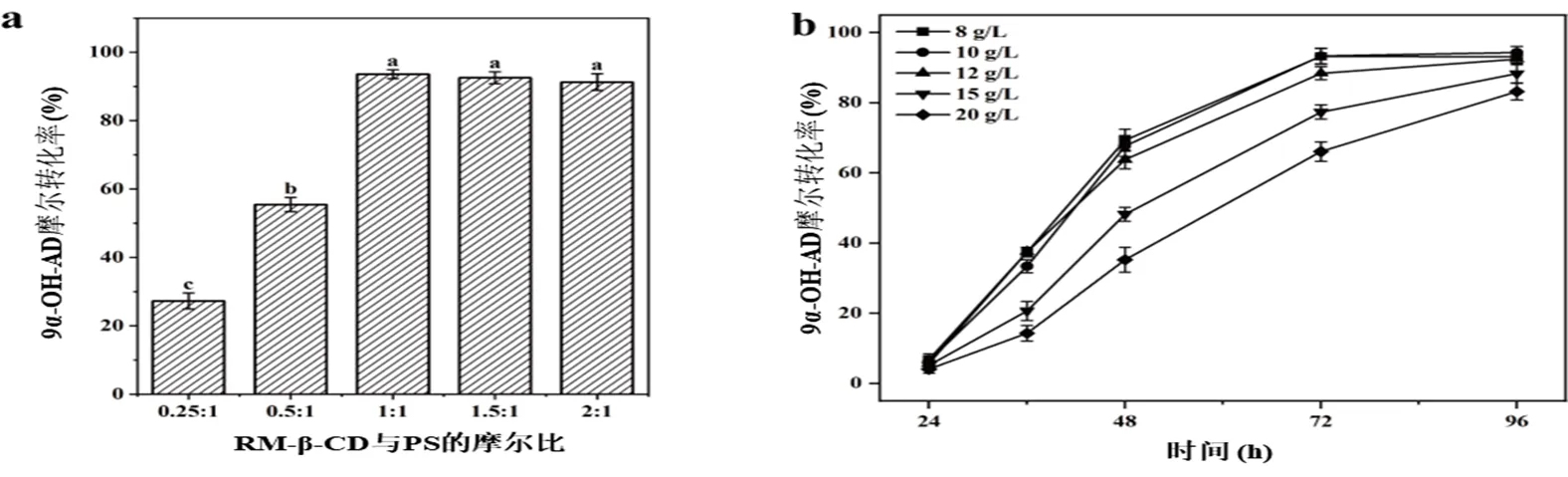
图 3 诱变菌株转化工艺优化
(a) RM--CD添加量对9-OH-AD转化率的影响 Effect of RM--CD addition on the conversion rate of 9-OH-AD;(b) 底物浓度对9-OH-AD转化率的影响 Effect of substrate concentration on the conversion rate of 9-OH-AD.
注:不同小写字母表示在0.05的显著水平。
Note: The different small letters showed the significant levels at 0.05.
由图3(a)可知,随着RM--CD的添加量与PS摩尔比的增加,9α-OH-AD摩尔转化率也随之增加。当(RM--CD)()达到1:1时,9-OH-AD摩尔转化率达95.7%,继续增加RM--CD的添加量,9-OH-AD摩尔转化率并未提高,表明(RM--CD):()为1:1时为RM--CD的最适添加量。
2.3.2 底物投料量对诱变菌株底物转化的影响 为了确定诱变菌株的转化能力,研究了底物投加量对诱变菌株#91转化的影响,结果如图3 (b)所示。
由图3 (b)可知,高底物浓度显著抑制了菌株的转化能力,8 g/L,10 g/L和12 g/L的添加量,在72 h转化基本完成,9-OH-AD的摩尔转化率达到最大。当底物浓度进一步增加到15 g/L和20 g/L,在转化48 h时9-OH-AD的摩尔转化率明显下降,仅为48.2%和35.3%,转化速率也明显下降,分别为0.10 g/(L·h)和0.06 g/(L·h)。在转化96 h时,9-OH-AD的摩尔转化率分别达88.3%和83.2%,说明诱变菌株对高浓度的PS具有良好的转化能力。
3 结果与讨论
9α-OH-AD是一种重要的甾体药物中间体,目前已有多种方法如诱变选育,基因工程改造,转化工艺优化等用于9α-OH-AD生产菌株,以提高其生产效率[2-5]。诱变育种是一种高效筛选优良菌株的方法,但是由于底物PS和产物9α-OH-AD结构的特殊性,其检测方法主要依赖于色谱法,为了提高诱变育种的效率,高效的检测方法是必不可少的,因此本研究结合产物结构特性,选用了基于微孔板的DNPH筛选方法[10],进一步提高了菌株的筛选效率。
利用24微孔板结合DNPH快速筛选方法,经过ARTP和ARTP-LiCl复合诱变得到一株转化率较高的诱变菌株#91,10 g/L的投料浓度下转化72 h,9-OH-AD的摩尔转化率达95.7%,较出发菌株相比提高34.9%,转化时间缩短24 h,经连续传代5次,诱变菌株遗传稳定性良好。优化RM--CD的添加量与摩尔比为1:1,投加15 g/L的,转化96 h时,9-OH-AD的摩尔转化率达88.2%,投加20 g/L的,9-OH-AD的摩尔转化率达83.2%,结果表明经诱变获得的菌株明显提高了底物的投料量。与之前的研究相比该菌株在更高的底物浓度下,仍能达到83.3%的摩尔转化率,远高于马洋等[5]仅通过ARTP诱变筛选得到的诱变菌株的转化效率。本研究获得的#91,其9-OH-AD摩尔转化率优于已报道水平,该菌株具有良好的工业应用前景。后续可以通过比较基因组学探究原始菌株与突变菌株的基因组差异,明确转化能力提高的理论机制,为该菌株后续的改造工作提供理论依据。同时,对转化体系进行放大,进一步优化转化工艺,以推进诱变菌株在甾体转化工业中的应用。
[1] Donova MV, Egorova OV. Microbial steroid transformations: current state and prospects [J]. Appl Microbiol Biotechnol, 2012,94(6):1423-1447
[2] 张晓.9-OH-AD高效生产菌株构建及其发酵工艺优化[D].天津:天津科技大学,2021
[3] Zhao A, Zhang X, Li Y,.cell factory for the production of steroid-based drug intermediates [J]. Biotechnology Advances, 2021,53:107860
[4] 王贵娥,陈艺强,范永仙,等.3-甾酮-9-羟基化酶基因在分枝杆菌中强化表达[J].药物生物技术,2016,23(5):381-384
[5] 马洋.利用植物甾醇生成9-OH-AD的菌种筛选及其特性研究[D].无锡:江南大学,2017
[6] Sedlaczek L. Biotransformations of Steroids [J]. Critical Reviews in Biotechnology, 1988,3(7):187-236
[7] 刘扬,申雁冰,王九彬,等.紫红红球菌9α–羟化酶loop对酶活性的影响[J].2018,1(33):14-19
[8] Donova MV. Transformation of steroids by actinobacteria: A review [J]. Applied Biochemistry and Microbiology, 2007,43(1):1-14
[9] Zhang X, Zhang X, Li H,. Atmospheric and room temperature plasma (ARTP) as a new powerful mutagenesis tool [J]. Applied Microbiology and Biotechnology, 2014,98(12):5387-5396
[10] Liu Y, Cao F, Xiong H,. Application of 2,4-dinitrophenylhydrazine (DNPH) in high-throughput screening for microorganism mutants accumulating 9-hydroxyandrost-4-ene-3,17-dione (9-OH-AD) [J]. PlosOne, 2016,11(10):e163836
[11] Zeng Y, Bi Y, Guo P,. Metabolic analysis of Schizochytrium mutants with high DHA content achieved with ARTP mutagenesis combined with iodoacetic acid and dehydroepiandrosterone screening [J]. Front Bioeng Biotech, 2021,9:1-12
Mutagenesis Breeding of High-yield9-OH-AD-coupled andOptimisation of Transformation Process
GAO Hua-yi, YANG Jia-hao, HE Man, SU Zhen-hua, ZHOU Hai-jie, SHEN Yan-bing*, WANG Min*
300457,
is an important strain for the production of 9α-hydroxyandrost-4-ene-3,17-dione (9α-OH-AD) in the manufacture of steroid drugs. To improve the 9α-OH-AD production of, the original strain was subjected to atmospheric pressure room temperature plasma (ARTP) mutagenesis treatment. A mutant strain,AR-2, with high 9α-OH-AD production was screened at the optimal mutagenic treatment time (35 s). When transformed for 96 h with 10 g/L phytosterol, the strain achieved a molar production rate of 9α-OH-AD of 87.6%, which was 14.9% higher than that of the original strain. Furthermore, AR-2 was subjected to ARTP-LiCl compound mutagenesis, the optimal LiCl mutagenesis concentration was determined to be 3.5%, and a mutagenic strain#91 with high 9α-OH-AD production was obtained.When the molar ratio of RM-β-CD addition to phytosterol was 1:1 and 10 g/L phytosterol was administered, the molar production rate of 9α-OH-AD of this strain reached 95.7%, which was 34.9% higher than that of the original strain, and it has a good application prospect.
; mutation breeding; mutagenesis
Q815
A
1000-2324(2023)05-0657-06
10.3969/j.issn.1000-2324.2023.05.003
2022-11-11
2022-12-23
国家自然科学基金(21978221)
高华义(1989-),男,博士研究生,专业方向:发酵工程. E-mail:gaohuayi2013@163.com
Author for correspondence. E-mail:shenyb@tust.edu.cn; minw@tust.edu.cn

