核壳型磁性分子印迹聚合物制备
樊世萌 刘恋 欧阳敬禹 刘浩 尤祥宇 李玲玲 苏江涛


[摘 要]用表面分子印迹技术,以氨基化磁性纳米颗粒为核,以马尿酸(HA)为模板分子、甲基丙烯酸(MAA)为功能单体、偶氮二异丁腈(AIBN)为引发剂、乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,制备核壳型马尿酸磁性分子印迹聚合物(HA-MMIPs)。通过电镜对其结构进行表征,并通过动力学吸附、等温吸附、比较HA-MMIPs与人血清白蛋白(HSA)对HA的吸附等实验,对其性能进行评价。结果表明,HA-MMIPs对HA具有较好的吸附量和印迹效率,在吸附HA上表现出对HSA的明显优势。HA五轮吸附-洗脱的循环实验表明,HA-MMIPs具有很好的重复再利用能力。这项研究证明HA-MMIPs对马尿酸分子具有良好的分离与吸附能力,对于尿毒症患者体内马尿酸分子的分离与吸附可能存在潜在的优势。
[关键词]马尿酸;尿毒症毒素;分子印迹;人血清白蛋白
[中图分类号]TB383.1[文献标识码]A
尿毒症毒素是一类肾衰竭期间在血液或组织中蓄积,对机体的正常生理具有负面影响的物质[1]。马尿酸(Hippuric Acid, HA)是这类物质中的一种,在健康个体中,HA浓度低于5 mg/L,但在终末期肾病患者中可增加至247±112 mg/L[2]。HA在血液中的积累,可抑制肌肉对葡萄糖的利用,引起尿毒症患者的肌肉无力,并可抑制肾脏的有机阴离子分泌和血脑屏障的转运。HA是蛋白结合性毒素,大多数血液净化方式对此类物质的清除效果较差。有研究表明,通过血液透析清除HA的比例仅为64%[3]。另外,HA是苯甲酸的甘氨酸结合物,而苯甲酸主要由肠道菌群代谢芳香族氨基酸产生,也可直接作为食品和饮料的防腐剂。机体内苯甲酸的大部分(约90%)主要与甘氨酸结合形成马尿酸,其余的则与葡萄糖醛酸结合形成1-苯甲酰葡萄醛酸[4]。因此,针对HA的分离技术或样品前处理技术,不论在血液净化领域或在食品饮料分析检测领域中都具有一定的现实意义。
分子印迹聚合物(molecularly imprinted polymers,MIPs)是用于提取目标分子的选择性吸附剂,基本上模拟了生物分子识别过程中发生的“锁和钥匙”结合机制。模板分子(目标分子)与功能单体相互作用形成络合物,在聚合反应中被三维聚合物网络包裹;聚合反应结束后洗脱模板,留下特定的定制识别位点,由此方法制备的MIPs能够根据独特的大小、化学功能和立体结构识别目标分子[4]。MIPs的物理、化学条件稳定,对样品环境的适应性很广。与无模板制备的分子非印迹聚合物(NIPs)相比,MIPs表现出高选择性和高吸附效率。MIPs目前被广泛用于色谱、微萃取和传感等分析应用中[5]。磁性MIPs(Magnetic molecularly imprinted polymers,MMIPs)是MIPs和磁性纳米颗粒(Nanoparticles,MNPs)技术相结合的产物,兼顾MIPs的特点和MNPs固有的高比表面积、优良的磁学性质等优点[6],在对样品中目标分子的识别和分离方面更具效率和优势。本文利用表面分子印迹技术,以氨基化磁性纳米颗粒为核,以HA为模板,制備一种马尿酸磁性分子印迹聚合物(HA-MMIPs)。该方法简易可行、条件温和。除常规表征与吸附性能分析外,还将HA-MMIPs与人血清白蛋白(HSA)对HA的吸附性能进行了比较,考察HA-MMIPs应用于血液净化领域去除尿毒症毒素分子的潜力。
1 实验
1.1 主要试剂
马尿酸(HA)、人血清白蛋白(HSA)购于Sigma-Aldrich贸易有限公司;六水氯化铁(FeCl3·6H2O)、无水乙酸钠(NaAc)、1,6-己二胺、一缩二乙二醇、乙腈、甲醇、无水乙醇、乙酸等购于国药集团化学试剂有限公司(分析纯);甲基丙烯酸(MAA)、偶氮二异丁腈(AIBN)、乙二醇二甲基丙烯酸酯(EGDMA)购于上海阿拉丁生化科技股份有限公司(分析纯)。甲醇、乙酸铵购于Sigma-Aldrich贸易有限公司(色谱级)。实验用水均为去离子水。
1.2 主要仪器
Ultimate3000高效液相色谱仪,FEI TF20透射电镜(美国,赛默飞世尔科技公司);NANO-ITC等温滴定微量热仪(美国,TA仪器)。
1.3 HA-MMIPs和MNIPs的合成
制备马尿酸磁性分子印迹聚合物(HA-MMIPs)的流程如图1所示。
1.3.1 Fe3O4@NH2的制备 参照文献[7],将3.0 g FeCl3·6H2O、12 g NaAc加入90 mL一缩二乙二醇,搅拌至完全溶解后加入19.5 g 1,6-己二胺,继续搅拌至溶液澄清,转移溶液至聚四氟乙烯内衬置入高压反应釜中200 ℃反应6 h,产物用无水乙醇、去离子水各洗涤3次,真空干燥得到氨基化磁性纳米颗粒(Fe3O4@NH2)。
1.3.2 HA-MMIPs的制备 将0.14 g HA、400 μL MAA冰浴超声溶于50 mL乙腈,4 ℃孵育过夜。后加入0.1 g超声分散的Fe3O4@NH2、80 mg AIBN、1mL EGDMA,通N2除氧,N2保护下 60 ℃反应2 h。反应结束后,产物用去离子水、甲醇乙酸(9:1)洗脱液、甲醇各洗涤3次,直至上清液无HA检出,冷冻干燥得到马尿酸磁性分子印迹聚合物(HA-MMIPs)。作为对照,按相同方法无模板制备磁性分子非印迹聚合物(MNIPs)。
1.4 TEM表征
使用FEI TF20透射电镜观察Fe3O4@NH2或HA-MMIPs的形貌。将适量的纳米材料分散于乙醇中,涂在碳涂层铜网格上晾干待测。
1.5 吸附实验
1.5.1 动力学吸附实验 称取2 mg HA-MMIPs或MNIPs若干份于离心管内,各加入2 mL 100 μg/mL HA水溶液,超声混匀后,室温下将其置于恒温振荡器中振荡吸附。在不同时间磁力分离HA-MMIPs(或MNIPs),对上清液HPLC分析,分析峰面积,计算上清液中HA浓度,按式(1)计算HA-MMIPs(或MNIPs)对HA的吸附量Q。
Q =(C0-C)·V/m (1)
其中,Q为HA-MMIPs(MNIPs或HSA)对HA的吸附量,μg/mg;C0为吸附前HA浓度,μg/mL;C为吸附后HA浓度,μg/mL;V为HA溶液体积,mL;m为HA-MMIPs(MNIPs或HSA)质量,mg。
1.5.2 等温吸附实验 称取2 mg HA-MMIPs或MNIPs若干份于离心管内,各加入2 mL不同浓度的HA水溶液,超声混匀后,室温下将其置于恒温振荡器中振荡吸附2 h。吸附完成后,磁力分离HA-MMIPs(或MNIPs),对上清液HPLC分析,分析峰面积,计算上清液中HA浓度,按式(1)计算HA-MMIPs(或MNIPs)对HA的吸附量Q。
1.5.3 HSA对HA的吸附实验 称取2 mg HA-MMIPs若干份于离心管内,各加入2 mL 100 μg/mL(或200 μg/mL)HA水溶液超声混匀后,加入8 mg HSA,完全溶解后在室温下将其置于恒温振荡器中振荡吸附2 h。吸附完成后磁力分离HA-MMIPs,上清液经超滤浓缩管(Thermo ScientificTMPierce浓缩管,10 000 MWCO)离心过滤,对滤过液HPLC分析,分析峰面积,计算滤过液中HA浓度,按式(1)计算HSA对HA的吸附量Q。
1.5.4 液相色谱条件 色谱柱为PALPAK Type R (φ4.6 mm×250 mm);流动相为V(甲醇)∶V(0.02 M乙酸铵)=15∶85;流速1.0 mL/min;紫外检测器波长228 nm;柱温35 ℃;进样量20 μL。
1.6ITC实验
采用纳瓦级等温滴定微量热仪,样品池体积为1 mL,注射器体积250 μL。将1 mL 4 mg/mL HSA溶液注入样品池,250 μL 1 mg/mL HA溶液装入注射器,恒温至37℃,待基线稳定后滴定,每次滴定体积为10 μL,间隔时间为600 s。
在相同条件下以HA溶液滴定纯水作为空白。滴定完成后获得微量热曲线,数据处理后得到焓变(ΔH)、熵变(ΔS)和解离常数(Kd)等热力学参数。
1.7 HA-MMIPs的重复使用
称取2 mg HA-MMIPs或MNIPs若干份于离心管内,各加入2 mL 200 μg/mL HA溶液,超声混匀后,室温下将其置于恒温振荡器中振荡吸附2 h。磁力分离HA-MMIPs(或MNIPs),获取上清液待测。采用上述1.3中的洗涤方法對磁力分离的HA-MMIPs(或MNIPs)进行洗涤,直至上清液无HA检出,冷冻干燥、回收。将回收的HA-MMIPs或MNIPs,循环重复以上吸附、洗涤实验4次,将每次完成吸附实验后的上清液(共5份),进行HPLC分析,分析峰面积,计算上清液中HA浓度,按式(1)计算HA-MMIPs(或MNIPs)对HA的吸附量Q。
2 结果与讨论
2.1 印迹条件对HA-MMIPs吸附效果的影响
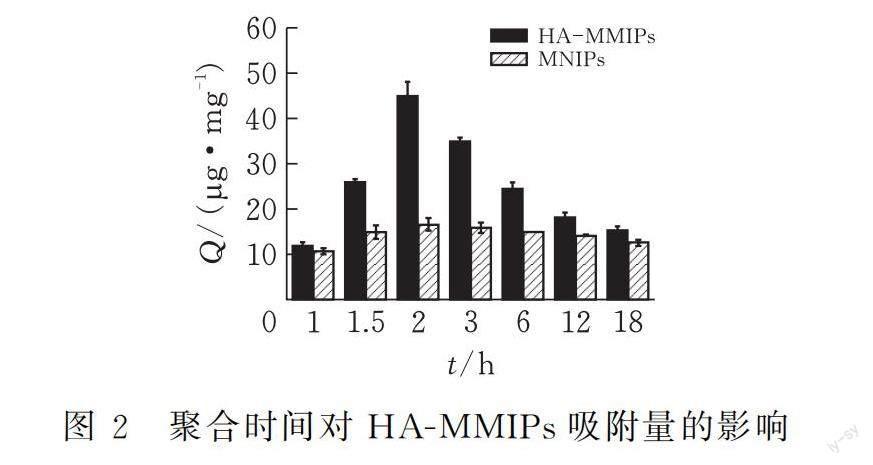
在MIPs的制备中,功能单体与模板之间相互作用力越强,越有利于MIPs选择性识别位点的形成;MAA是最常用的非共价型MIPs的功能单体之一[8],既可以作为氢键的供体,也可以作为氢键的受体。丙烯酸基MIPs主要通过自由基聚合制备。通过大量实验,我们对聚合反应中使用的溶剂及HA、MAA、Fe3O4@NH2等的配比进行优化,发现溶剂为乙腈,HA:MAA:Fe3O4@NH2的比例为0.14 g:400 μL:0.1 g,且HA与MAA经过4 ℃孵育过夜,印迹聚合物对HA的吸附效果最好。推测HA与MAA经过4 ℃孵育过夜,有利于二者间产生氢键。在此基础上进一步对分子印迹的聚合时间进行优化,分别制备聚合时间为1、1.5、2、3、6、12、18 h的印迹聚合物,并评价其对HA的吸附能力(吸附条件同动力学吸附实验,吸附时间为2 h)。由图2可知,HA-MMIPs对HA的吸附量Q随聚合时间延长呈现先增后减的趋势(聚合时间为30 min时,聚合物产量极少,故无数据列出),且在聚合时间为2 h时Q值最大。作为对照,磁性分子非印迹聚合物(MNIPs)对HA的吸附随聚合时间的变化不大,且明显低于HA-MMIPs对HA的吸附。计算聚合时间为2 h时HA-MMIPs印迹因子IF(QMMIPs/QMNIPs)约为3。由此,得出最优的聚合时间为2 h。分析可能原因:聚合时间过短时印迹腔未完全形成,聚合时间过长时则表面印迹层较厚,HA进入印迹腔受阻,导致吸附量减少。
2.2 TEM表征分析
如图3所示,Fe3O4@NH2和HA-MMIPs分散度均较好且尺寸均一。利用Nanomeasure软件对聚合物的粒径进行分析,Fe3O4@NH2的平均粒径约为20 nm,HA-MMIPs的平均粒径约为23 nm。HA-MMIPs的粒径比Fe3O4@NH2的粒径仅略有增加,提示分子印迹聚合物已包覆且包覆层比较薄。
2.3 HA-MMIPs吸附动力学
动力学吸附实验结果如图4所示:HA-MMIPs和MNIPs在0~2 h间对HA的吸附量均随着时间的延长而增加,但是二者的增变模式有很大区别;HA-MMIPs对HA的吸附量在15 min~1.5 h间有个快速增加的过程,在1.5~2 h间增加略放缓;MNIPs对HA的吸附量在15 min~2 h间始终保持较慢的增加。当吸附时间大于2 h后,HA-MMIPs和MNIPs对HA的吸附曲线都趋于平缓。HA-MMIPs对HA早期吸附量的增加速率明显高于MNIPs,且HA-MMIPs对HA的吸附量始终远大于MNIPs,说明含印迹腔的HA-MMIPs相比MNIPs对HA具有更强的亲和力,这是由于HA-MMIPs印迹腔内的空间、尺寸、化学键等共同作用、对HA进行特异性识别的结果。“定制”的印迹腔能够更多更快地吸附HA分子,这与不含印迹腔的MNIPs对HA的非特异性吸附完全不同。当HA-MMIPs印迹腔逐渐被HA占据饱和后,HA-MMIPs对HA的吸附量不再随着时间延长而发生明显变化。
为进一步研究吸附过程的速率控制和传质机理,将一级(准一级)、二级(准二级)等动力学吸附模型用于评价HA-MMIPs对HA的吸附特性[9]。根据拟合数据对比,图4数据更符合Lagergren(拉格尔格伦)准一级动力学吸附模型(图5)。Lagergren准一级动力学吸附模型的方程式为
Q = Qt(1 - exp(-kf·t)) (2)
其中:Q为HA-MMIPs对HA的吸附量,Qt表示HA-MMIPs对HA的平衡吸附量,kf表示一级吸附速率常数,t为吸附时间,h。由图5可知,准一级动力学模型计算的Qt值(≈ 47.7μg/mg)与实验测出的Qt值(≈ 44.8 μg/mg)吻合较好。Lagergren准一级动力学吸附模型表明,影响HA-MMIPs对HA吸附量Q值的最主要变量是时间。
2.4 HA-MMIPs的等温吸附曲线
如图6所示,HA-MMIPs和MNIPs的等溫吸附曲线略有不同。HA-MMIPs对HA的等温吸附曲线大概有3种特征;HA浓度为0 ~ 140 μg/mL时,HA-MMIPs对HA的吸附量随HA浓度增加而快速增加;HA浓度为140 ~ 200 μg/mL时,HA-MMIPs对HA的吸附量随HA浓度增加而增速放缓;HA浓度大于200 μg/mL时,HA-MMIPs对HA的吸附量随HA浓度增加而无明显变化,说明吸附趋于饱和,对HA最大吸附量超过95 μg/mg。对于MNIPs,HA浓度为0 ~ 140 μg/mL时,MNIPs对HA的吸附量随HA浓度增加而快速增加;HA浓度大于140 μg/mL时,MNIPs对HA的吸附量无随HA浓度增加而明显变化,吸附趋于饱和。相同HA浓度下,MNIPs的吸附量远小于HA-MMIPs,这是由于HA-MMIPs对HA的特异性吸附,拥有印迹空穴的HA-MMIPs能吸附更多的HA。
2.5 HA-MMIPs和HSA对HA的吸附比较
由图7可知,相同吸附条件下,HA浓度为100 μg/mL时,HA-MMIPs对于HA的吸附量略大于HSA对于HA的吸附量;HA浓度为200 μg/mL时,HA-MMIPs对于HA的吸附量远大于HSA对于HA的吸附量。从图6HA-MMIPs的等温吸附曲线可以看出:当HA浓度大于200 μg/mL,HA-MMIPs对HA的吸附趋于饱和;在HA 200 μg/mL浓度下,HA-MMIPs对HA的吸附量相比HSA很有优势。
等温滴定微量热(ITC)技术能够原位、在线、灵敏地监测生物分子结合过程中产生的微热变化,以此获得其平衡解离常数Kd、摩尔结合焓ΔH、摩尔结合熵ΔS等热力学参数。在37 ℃下HA滴定HSA,图8a每一峰值表示每次滴定产生的热变化补偿,图8b为每次滴定产生的热效应与滴定和被滴定分子的摩尔比作图得到一条结合曲线。由图中数据可知,HA与HSA结合的焓变化为负值,表明结合过程都是放热的。根据作图后的结合曲线测算,HA与HSA的平衡解离常数为5.283×10-4M,该数值和已有文献报道的相应值很接近[2]。另据文献报道,蛋白结合性毒素[1]如硫酸吲哚酚(Indoxyl sulfate, IS)、硫酸对甲酚(p-cresyl sulphate, PCS)、对甲酚(p-cresol, PC)、吲哚乙酸(indole-3-acetic acid,IAA)等与HSA非共价结合,亲和力多处于中低等亲和力范围[10-13];HA与HSA的亲和力值在众多蛋白结合性毒素与HSA的亲和力值中处于中等水平。
大多数血液净化方式对蛋白结合性毒素的清除效果较差[1,14]。由于分子印迹聚合物的材料特性及ITC仪器使用限制,虽然无法直接应用ITC技术对HA与HA-MMIPs之间的亲和力进行测算,但结合图6、图7与图8能够得出,HA-MMIPs对HA有着比HSA对HA更强的吸附能力。这说明,HA-MMIPs有进一步应用于血液净化领域的潜力。临床研究表明[14],在血液净化透析液中加入一定浓度的HSA(如浓度为20 %),透析过程中血液一侧部分毒素可与所结合的HSA解离、穿过透析膜,依靠膜两侧浓度梯度差配位结合于透析液一侧的HSA。Mitzner等[15]认为,毒素解离并跨膜趋向移动,是由于透析液一侧的HSA始终具有大量的未结合位点。基于此,可以大胆假设:如果把透析液一侧中的HSA替换成与毒素亲和力高很多的高分子聚合物材料,那么在透析过程中毒素跨膜趋向移动的作用将会更加显著。
2.6 HA-MMIPs的可重復使用性
洗脱掉所结合的分子后的HA-MMIPs可以被回收并重复使用。对HA连续进行5个吸附-洗脱循环实验,考察印迹聚合物的稳定性及吸附能力(图9),数据表明,HA-MMIPs性质很稳定,经5次吸附—洗脱循环后,HA-MMIPs在第5次循环实验中对HA的吸附量仍可达首次吸附量的92.8%。
3 结论
1)以氨基修饰的磁性纳米颗粒为核,结合表面分子印迹技术,建立了一种制备核壳型马尿酸磁性分子印迹聚合物的方法。所制备的磁性分子印迹聚合物HA-MMIPs对HA最大吸附量大于95 mg/g,相应的印迹因子约为3,说明具有较大的吸附量和较好的印迹效果。
2)研究其吸附动力学曲线发现,HA-MMIPs对HA的吸附在2 h基本达到平衡。
3)比较HSA对HA的吸附等实验,HA-MMIPs在吸附HA上表现出对HSA的明显优势,说明HA-MMIPs有进一步应用于血液净化领域的潜力。
4)HA-MMIPs具有良好的可重复利用性,印迹聚合物经过了5次吸附-洗脱循环,依旧表现出对HA良好的吸附能力。
5)HA-MMIPs在各个实验中以磁分离技术实现分离目的,具有快速、简便的特点,提示其具有应用于复杂样品的潜力。根据上述实验结果可知,HA-MMIPs有希望作为潜在的选择性吸附材料运用于血液净化领域,分离和吸附尿毒症患者血液内高浓度的HA。
[ 参 考 文 献 ]
[1] SIRICH T L,MEYER T W,GONDOUIN B,et al.Protein-bound molecules:a large family with a bad character[J].Semin Nephrol,2014,34(02):106-117.
[2] ZAIDI N,AJMAL M R,RABBANI G,et al.A comprehensive insight into binding of hippuric acid to human serum albumin:a study to uncover its impaired elimination through hemodialysis[J].Plos One.2013,8(08):e71422.
[3] VANHOLDER R C,DE SMET R V,RINGOIR S M.Assessment of urea and other uremic markers for quantification of dialysis efficacy[J].Clin Chem,1992,38(08):1429-1436.
[4] HU T,CHEN R,WANG Q,HE C,et al.Recent advances and applications of molecularly imprinted polymers in solid-phase extraction for real sample analysis[J].J Sep Sci,2021,44(01):274-309.
[5] FRESCO-CALA B,BATISTA A D,CáRDENAS S.Molecularly imprinted polymer micro- and nano-particles:a review[J].Molecules,2020,25:4740.
[6] HUANG S,XU J,ZHENG J,et al.Synthesis and application of magnetic molecularly imprinted polymers in sample preparation[J].Anal Bioanal Chem,2018,410(07):1-24.
[7] 胡欣,蔡朝霞,马美湖.溶剂热法制备氨基修饰的Fe3O4纳米粒子及其性能[J].磁性材料及器件,2011,42(05):32-35.
[8] FAROOQ S,NIE J,CHENG Y,et al.Molecularly imprinted polymers' application in pesticide residue detection[J].Analyst,2018,143(17):3971-3989.
[9] EL-SAYED H E M,EL-SAYED M M H.Assessment of food processing and pharmaceutical industrial wastes as potential biosorbents:a review[J].Biomed Res Int,2014,2014 (10):146769.
[10]BERGE-LEFRANC D,CHASPOUL F,CALAF,et al.Binding of p-cresyl sulfate and p-cresol to human serum albumin studied by microcalorimetry[J].J Phys Chem B,2010,114(04):1661-1665.
[11]SAKAI T,TAKADATE A,OTAGIRI M.Characterization of binding site of uremic toxins on human serum albumin[J].Biol Pharm Bull,1995,18(12):1755-1761.
[12]WATANABE H,NOGUCHI T,MIYAMOTO Y,et al.Interaction between two sulfate-conjugated uremic toxins,p-cresyl sulfate and indoxyl sulfate,during binding with human serum albumin[J].Drug Metab Dispos,2012,40(07):1423-1428.
[13]CONRAD M L,MOSER A C,HAGE D S.Evaluation of indole-based probes for high-throughput screening of drug binding to human serum albumin :analysis by high-performance[J].J Sep Sci,2015,32(08):1145-1155.
[14]史媛媛,丁峰.蛋白结合类尿毒症毒素的血液净化清除研究进展[J].上海医药,2018(09):12-16.
[15]DREXLER K,BAUSTIAN C,RICHTER G,et al.Albumin dialysis molecular adsorbents recirculating system:impact of dialysate albumin concentration on detoxification efficacy[J].Ther Apher Dial,2009,13(05):393-398.
Preparation for Core-shell Magnetic Molecularly Imprinted
Polymers Using Hippuric Acid Template
FAN Shimeng, LIU Lian, OUYANG Jingyu, LIU Hao, YOU Xiangyu, LI Lingling, SU Jiangtao
(1 School of Biological Engineering and Food, Hubei Univ. of Tech., Wuhan 430068, China;
2 Medical School , Wuhan Univ. of Arts and Science, Wuhan 430345, China)
Abstract:Using surface molecular imprinting technology, aminated magnetic nanoparticles as the core, hippuric acid (HA) as the template molecule, methacrylic acid (MAA) as the functional monomer, azobisisobutyronitrile (AIBN) as the initiator, and ethyl acetate Glycol dimethacrylate (EGDMA) was used as a crosslinking agent to prepare core-shell hippuric acid magnetic molecularly imprinted polymers (HA-MMIPs). Its structure was characterized by electron microscopy, and its performance was evaluated by experiments such as kinetic adsorption, isothermal adsorption, and comparison of HA-MMIPs and HSA's adsorption of HA. The results show that HA-MMIPs have better adsorption capacity for HA, better imprinting efficiency, and show obvious advantages over HSA in adsorbing HA; through at least five rounds of adsorption-elution cycle experiments on HA, it is shown that HA- MMIPs have a good ability to reuse. This study proves that HA-MMIPs have good separation and adsorption ability to hippuric acid, and may have potential advantages for the separation and adsorption of hippuric acid in uremia patients.
Keywords:Hippuric acid; uremic toxin; molecular imprinting; human serum albumin
[責任编校:张 众]

