玫瑰树碱诱导胰腺癌细胞焦亡的机制
曹丹,陈星,汤晓燕,张宇华,邓尚贵
(1.浙江海洋大学食品与药学学院食品系,浙江 舟山 316022;2.浙江省肿瘤医院肝胆胰外科,杭州 310022;3.杭州医学院临床医学院临床医学系,杭州 310059)
胰腺导管腺癌 (简称胰腺癌) 是一种高度恶性的肿瘤,患者预后极差,5年生存率非常低,并且近几十年来胰腺癌发病率一直呈上升趋势[1]。尽管在药物治疗、免疫治疗、手术治疗和介入治疗等方面,各种恶性肿瘤的治疗方法都取得了突破性进展,但胰腺癌的治疗进展仍非常缓慢[2]。由于胰腺癌对化疗的敏感性较低,并且肿瘤间质和微环境处于免疫抑制状态,从而限制了化疗和免疫治疗的疗效。玫瑰树碱是一种已知有抗肿瘤疗效的天然产物,其存在于夹竹桃科植物[3]。作为一种吲哚类生物碱,玫瑰树碱对多种肿瘤细胞具有细胞毒作用[4]。其主要作用机制包括抑制拓扑异构酶Ⅱ活性或与DNA结合形成共价键,从而阻碍细胞周期的进程,引发细胞凋亡等反应[5]。近年来研究显示,玫瑰树碱能减轻重症急性胰腺炎相关性急性肺损伤[6],并可以发挥抗肿瘤效应[7]。关于玫瑰树碱在胰腺癌中作用的相关研究较少,且玫瑰树碱能否影响胰腺癌细胞焦亡的发生,目前尚未见研究报道。本研究采用玫瑰树碱处理胰腺癌PANC-1细胞,检测相关指标的变化,并结合癌症基因组图谱 (The Cancer Genome Atlas,TCGA) 数据库进行分析,以阐明玫瑰树碱诱导胰腺癌细胞焦亡的机制。
1 材料与方法
1.1 材料
人胰腺癌细胞系PANC-1,购自中科院上海细胞生物学研究所;玫瑰树碱盐酸盐,购自美国Med-ChemExpress公司;青霉素链霉素双抗,购自上海Biosharp公司。胎牛血清、RPMI 1640培养基,购自美国Gibco公司;CCK-8试剂盒,购自美国Cell Biolabs公司;Western blotting所用抗体,购自英国Abcam公司;活性氧 (reactive oxygen species,ROS) 检测试剂盒,购自上海碧云天生物技术有限公司。以上试剂均按照说明书操作使用。
1.2 方法
1.2.1 CCK-8增殖实验:将每孔含有5 000个PANC-1细胞的100 μL培养液接种到96孔板中,在5% CO2、37℃培养箱中稳定培养过夜。第2天分别用0、0.625、1.25、2.5、5、10、20、40 μmol/L的玫瑰树碱处理细胞,24 h后加入 CCK-8试剂,450 nm波长下测量吸光度值。
1.2.2 显微镜下观察细胞形态:使用含0 μmol/L (对照组) 和3 μmol/L玫瑰树碱的培养液处理PANC-1细胞,每天进行传代,经过5 d换药和培养后,100倍和40倍镜下观察拍照。
1.2.3 ROS含量检测:用0 μmol/L (对照组) 和3 μmol/L的玫瑰树碱处理PANC-1细胞24 h后,倒掉培养液,残余培养基用PBS洗涤1次。按照说明书配置ROS染色工作液,荧光染色处理细胞,荧光显微镜下拍摄照片。
1.2.4 Transwell实验:用0 μmol/L (对照组) 和3 μmol/L的玫瑰树碱处理PANC-1细胞24 h后,弃上清,PBS洗3次。消化并收集细胞,离心。先在下室中添加600 μL含10%胎牛血清的完全培养基,再用200 μL 10%胎牛血清培养基重新悬浮10 000个细胞并将其加入上室中。孵育24 h后,轻轻刮去上室中的细胞,并在4%多聚甲醛中固定15 min。PBS洗1次,0.1%结晶紫染色20 min,再用PBS洗3次,干燥后拍照。
1.2.5 Western blotting:用0、4、8 μmol/L的玫瑰树碱处理PANC-1细胞,24 h后收集细胞并提取蛋白。测定蛋白浓度后,配置蛋白上样液,加样,电泳,转膜,4 ℃过夜孵育一抗,室温孵育二抗2 h。最后,用TBST洗涤膜3次,用增强化学发光液在凝胶图像处理系统曝光。
1.2.6 生物信息学分析:使用京都基因和基因组数据库 (Kyoto Encyclopedia of Genes and Genomes,KEGG)、TCGA数据库、分子标签数据库 (一个包含多个癌症相关基因的数据库) 和单样本基因集富集分析等,分析焦亡相关基因的表达、预后和功能等。校正P<0.05为差异有统计学意义。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。所有实验均重复3次。计量资料用±s表示,采用t检验进行比较。P< 0.05为差异有统计学意义。
2 结果
2.1 玫瑰树碱抑制PANC-1细胞增殖
不同浓度的玫瑰树碱处理PANC-1细胞后,细胞存活率随药物浓度的增加而下降。药物浓度越高,对PANC-1细胞的杀伤力越大。通过细胞数量下降程度,计算半数抑制浓度 (half maximal inhibitory concentration,IC50)。处理24 h时,玫瑰树碱的IC50值为2.836 μmol/L。0.625、1.25、2.5、5、10、20、40 μmol/L玫瑰树碱处理的PANC-1细胞与0 μmol/L玫瑰树碱处理的PANC-1细胞相比,细胞存活率均明显降低 (均P< 0.05)。见图1。
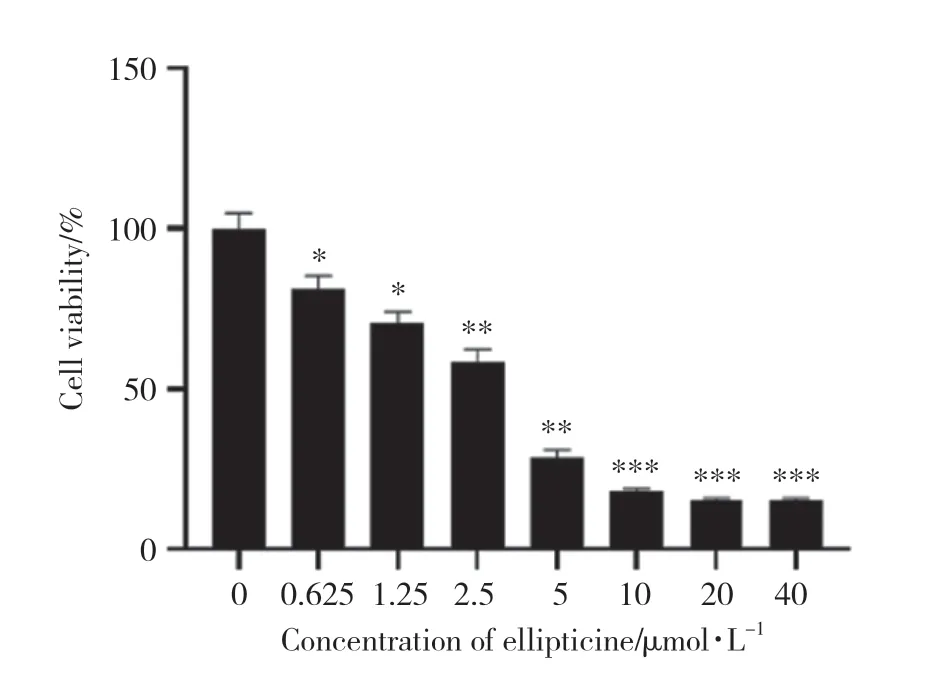
图1 玫瑰树碱对PANC-1细胞存活率的影响Fig.1 Effect of ellipticine on the survival rate of PANC-1 cells
2.2 PANC-1细胞内ROS含量增加
荧光染色结果显示,3 μmol/L玫瑰树碱处理24 h后PANC-1细胞荧光强度较强,ROS含量明显上升;对照组部分细胞仍有荧光染色,表明未处理的PANC-1细胞中也存在ROS,但含量相对较低。见图2。
2.3 玫瑰树碱使PANC-1细胞出现焦亡特征性改变
3 μmol/L玫瑰树碱处理PANC-1细胞48 h后,大部分细胞死亡 (高亮细胞为死细胞),存活的细胞呈现明显的涨大破裂等焦亡特征性光镜表现。见图3。
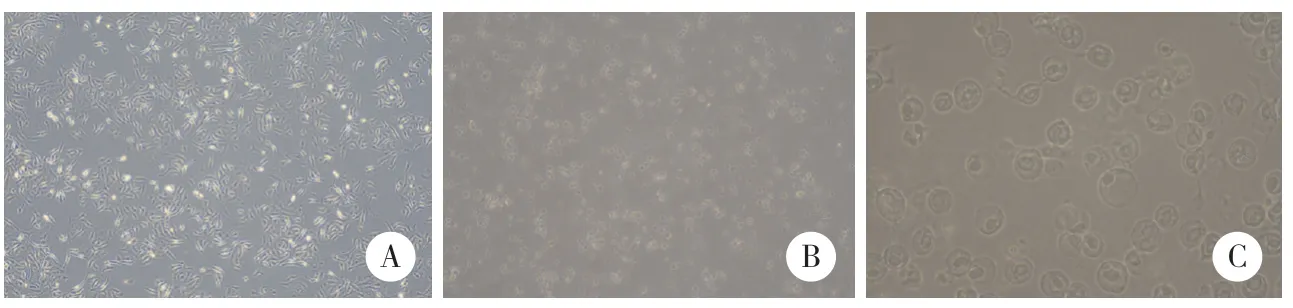
图3 玫瑰树碱处理PANC-1细胞后细胞形态学的变化Fig.3 Morphological changes of PANC-1 cells treated with ellipticine
2.4 玫瑰树碱抑制PANC-1细胞转移
与3 μmol/L玫瑰树碱组比较,对照组细胞结晶紫染色面积明显较多 (P< 0.05)。见图4。提示玫瑰树碱抑制PANC-1细胞的转移。

图4 玫瑰树碱对PANC-1细胞转移能力的影响Fig.4 Effect of ellipticine on the migration of PANC-1 cells
2.5 玫瑰树碱使PANC-1细胞焦亡
使用0、4、8 μmol/L玫瑰树碱处理PANC-1细胞。与0 μmol/L玫瑰树碱处理的PANC-1细胞比较,4、8 μmol/L玫瑰树碱处理的PANC-1细胞中Bax蛋白表达未发生明显变化,而线粒体复合物Ⅰ组装过程中重要蛋白TMEM70的表达上调 (P< 0.05),焦亡相关蛋白caspase 3、caspase 4、gasdermin D的表达均有不同程度上调 (均P< 0.05)。见图5。4 μmol/L玫瑰树碱处理的PANC-1细胞中TMEM70的表达明显高于8 μmol/L玫瑰树碱处理的PANC-1细胞 (P= 0.023)。4和8 μmol/L玫瑰树碱处理的PANC-1细胞比较,其他蛋白的表达无统计学差异 (P> 0.05)。
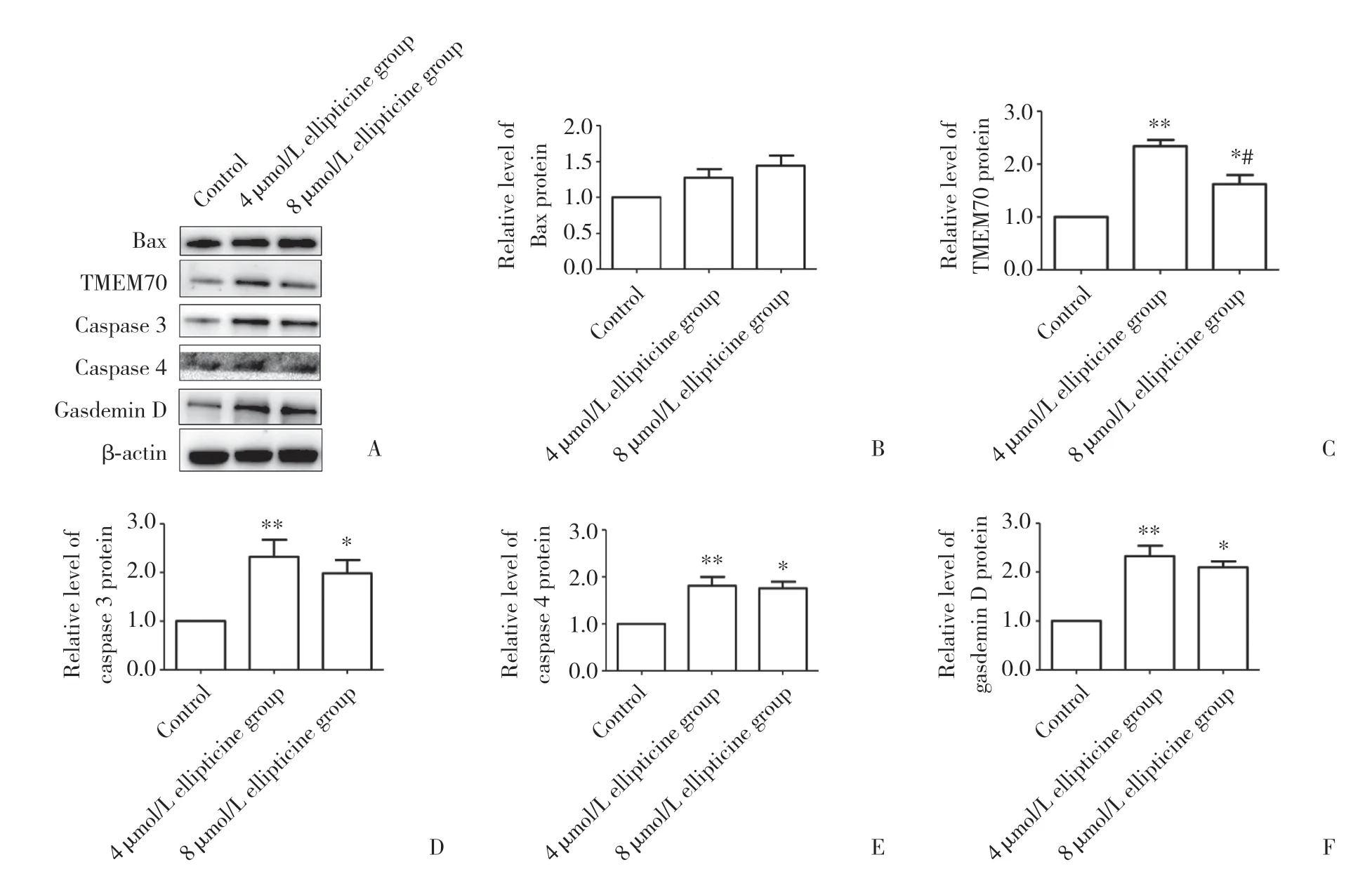
图5 Western blotting检测蛋白表达的变化Fig.5 Changes of protein expression detected by Western blotting
2.6 预后模型的建立
为了预测胰腺癌的预后情况,分析6个与胰腺癌预后有关的焦亡相关基因的表达,包括白细胞介素-6 (interleukin,IL-6)、AIM2、NLRP1、caspase4、白细胞介素-18 (interleukin,IL-18)、caspase3。使用以上基因构建Nomogram预测模型,该模型基于一些可能与胰腺癌预后相关的蛋白,并将胰腺癌原发灶的病理分期 (T分期) 和淋巴结转移 (N分期) 作为参数。见图6。
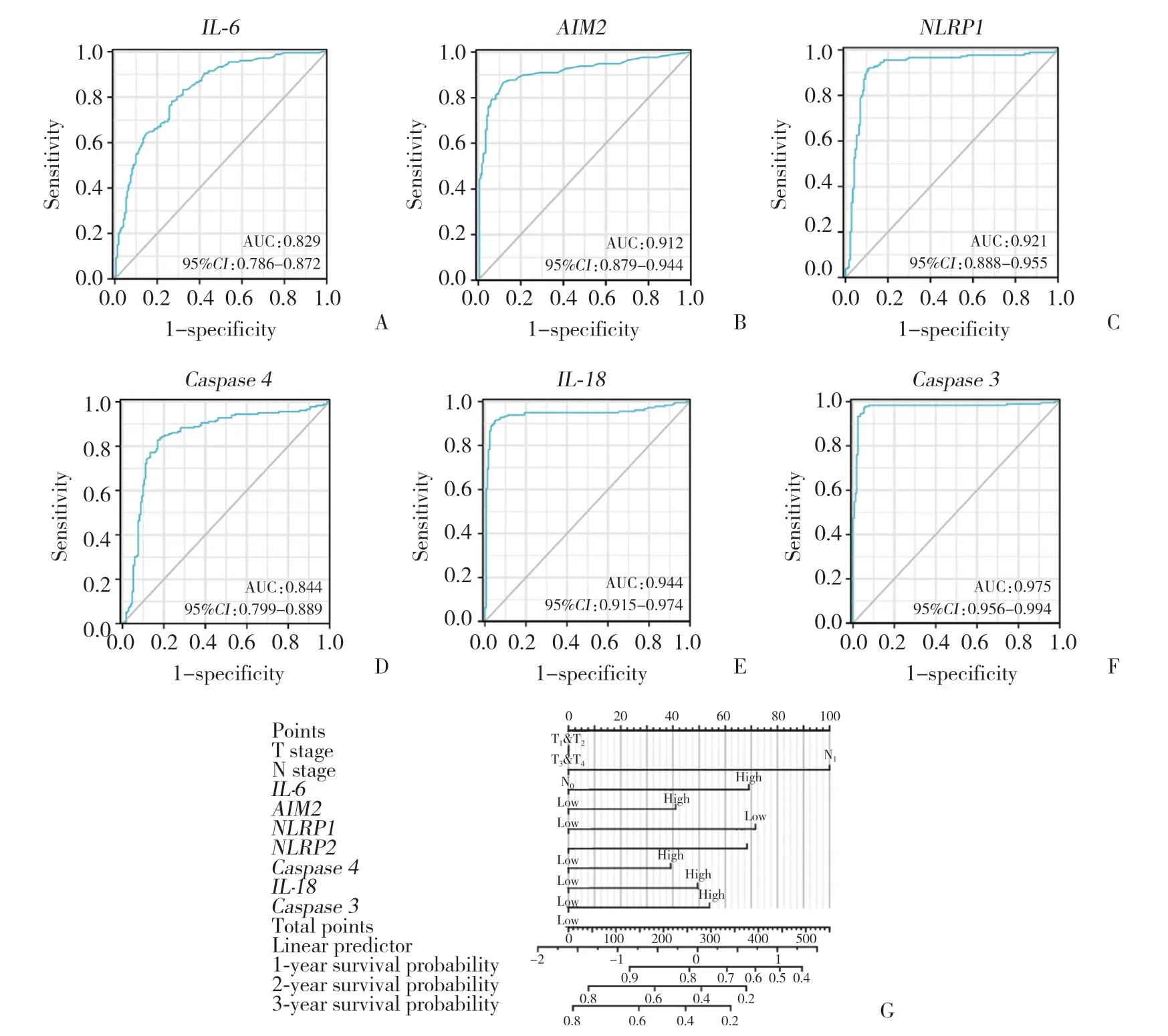
图6 ROC曲线及生存预测模型Fig.6 ROC curve and survival prediction model
2.7 焦亡相关蛋白可能影响T细胞免疫浸润
免疫分析发现,IL-6、AIM2、NRLP1作为焦亡相关蛋白,与T细胞的免疫浸润有关。按照r> 0.25和P<0.05标准进行相关性分析,结果显示,这3个焦亡相关蛋白与胰腺癌T细胞的免疫浸润呈正相关关系。见图7。
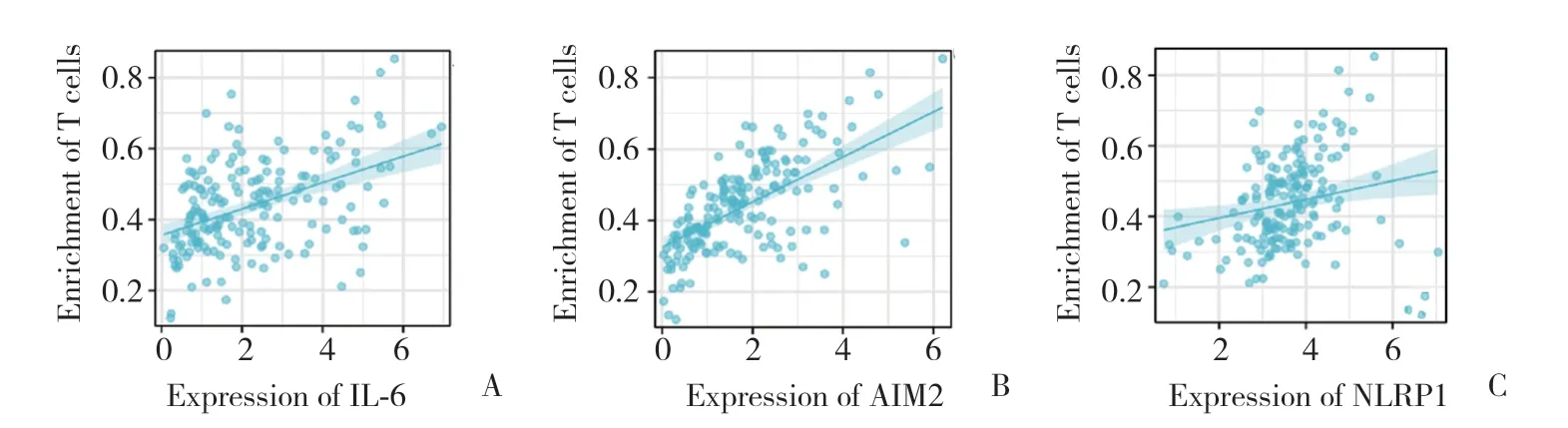
图7 焦亡相关蛋白与胰腺癌T细胞免疫浸润的关系Fig.7 Relationship between pyroptosis-associated proteins and immune infiltration of T cells in pancreatic ductal adenocarcinoma
3 讨论
胰腺癌由于侵袭性高、预后差,发病率在全球范围内不断上升,其发病机制可能与吸烟、糖尿病、慢性胰腺炎等因素相关[7-9]。作为全球第4大癌症相关死亡原因,胰腺癌患者的5年生存率仅为9%[10]。尽管近年来手术治疗、免疫治疗等方法取得进展,但胰腺癌患者的预后总体不佳。传统的预后指标,如年龄、大小、分子分型和TNM分期,被广泛用于评估胰腺癌的预后,然而由于个体间的异质性和微环境差异,临床病理参数相同的患者可能表现出不同的预后结果。因此,深入探索胰腺癌的发病机制并寻找可靠的预后生物标志物具有重要意义。
研究[11]表明,焦亡可以激活gasdermin D等打孔蛋白,形成6~8个打孔蛋白复合物附着于细胞膜上,导致细胞内物质外流;由于电解质和细胞内外环境失衡,导致细胞涨大、破裂和解体。通过焦亡的激活,可以使细胞内物质外流,引发强烈的组织炎症反应,吸引 T细胞和巨噬细胞聚集,形成瀑布效应,来攻击肿瘤。胰腺癌组织内部往往处于强烈的免疫抑制状态,限制了免疫治疗对胰腺癌的作用效果[12]。而焦亡可以引起强烈的微环境炎症,招募免疫细胞聚集,可能是治疗胰腺癌的潜在机制之一[13]。
玫瑰树碱是一种存在于植物中的生物碱,有研究表明,其具有抗肿瘤效果。玫瑰树碱主要通过影响肿瘤细胞的DNA复制来发挥抗肿瘤作用[4]。本研究采用玫瑰树碱处理PANC-1细胞后,细胞的增殖和转移能力下降,ROS含量增加。同时,PANC-1细胞表现出涨大、破裂并最终死亡的焦亡形态学特征。此外,玫瑰树碱处理PANC-1细胞后,细胞内自噬和调亡途径中重要蛋白的表达并未受到明显影响,而焦亡相关蛋白和线粒体代谢相关蛋白TMEM70表达上调。TMEM70是一个已知影响线粒体复合物Ⅰ组装的重要蛋白,能维持肿瘤细胞线粒体的能量代谢[14]。据此推测,玫瑰树碱可能通过影响线粒体代谢,诱导PANC-1细胞发生焦亡。
生物信息学在生物医学研究和疾病机制探索中发挥重要作用,是在基于高通量平台的微阵列分析中,从基因表达谱中筛选出与肿瘤发生和进展相关的差异表达基因的较好手段。由于胰腺癌预后极差,单个蛋白或单个因素对肿瘤的预后影响往往有限。因此,本研究选择具有功能性的6个焦亡相关蛋白进行免疫浸润分析,并构建了预后分析图。结果表明,其中3个蛋白的表达可能参与招募T细胞的免疫浸润,可能因此影响胰腺癌免疫治疗的效果和预后。
本研究也存在一定的局限性:(1) 未对玫瑰树碱对其他正常组织、特别是肝肾功能的影响进行评估,可能需要进一步的器官或动物实验来确定其在活体中的给药剂量和给药方式,以及不良反应情况;(2) 未对足够数量的细胞或组织样本进行研究;(3) 未详细论证玫瑰树碱对细胞ROS含量影响的具体机制以及激活焦亡通路的具体节点蛋白。
综上所述,玫瑰树碱可能通过影响线粒体和ROS含量,激活胰腺癌细胞的焦亡,从而抑制胰腺癌细胞的增殖和转移等生物学行为。这为今后的研究提供了思路,即通过使用玫瑰树碱提高胰腺癌细胞对化疗和免疫治疗的敏感性,激活胰腺癌的焦亡,改变肿瘤微环境,影响肿瘤的免疫浸润,提高肿瘤的治疗效果,最终改善胰腺癌患者的预后。

