血清TRAF6、sTLT-1和血管生成素样蛋白8对急性脑梗死出血性转化的预测效能分析
张三妮,韩淑辉
(南阳市第一人民医院神经内科,河南 南阳 473001)
脑梗死出血性转化 (hemorrhagic transformation,HT) 为急性脑梗死 (acute cerebral infarction,ACI) 患者病灶及其周围区域发生的继发性出血现象[1]。研究[2]表明,HT发生率约为15%~40%,为缺血性脑卒中患者常见并发症之一,发生后可进一步加重患者的神经功能受损程度,对预后恢复造成严重影响。因此,尽早对ACI患者HT发生风险进行预测评估,针对性展开治疗具有重大意义。相关研究[3-4]表明,缺血性脑卒中患者存在诸多炎症反应,炎性细胞因子可对血脑屏障造成损伤。血清肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor-associated factor 6,TRAF6) 在细胞分化、功能方面具有调控作用,可参与机体免疫和炎症反应;血管生成素样蛋白8(angiopoietin-like protein 8,ANGPTL8) 水平变化为颅内动脉粥样硬化性狭窄影响因素,与心脑血管疾病的发生密切相关;可溶性骨髓细胞样转录因子-1(soluble bone marrow cell-like transcription factor-1,sTLT-1) 与动脉粥样硬化相关,参与ACI相关病理改变[5-7]。目前临床已有研究证实上述血清因子均与ACI患者病情进展及预后相关,但鲜有研究关于上述血清因子与HT的相关性,基于此,本研究拟分析血清TRAF6、sTLT-1和ANGPTL8对ACI患者发生HT的预测价值。
1 材料与方法
1.1 一般资料
选取我院2019年1月至2021年12月ACI患者118例作为研究对象,其中男63例,女55例,年龄47~68岁,平均年龄 (56.18±5.65) 岁;体质量指数 (body mass index,BMI) 21.5~26.8 kg/m2,平均BMI (24.05±1.14) kg/m2;发病至入院时间4~15 h,平均时间(9.25±1.86) h;入院时NIHSS评分7~19分,平均 (12.86±1.93)分;有吸烟史35例,饮酒史51例 ;合并高血压44例,糖尿病40例;脑梗死部位位于皮层62例,皮层下56例;脑梗死面积小面积73例,大面积45例。本研究获得我院伦理委员会审核批准 (批准文号:201901236)。
1.2 纳入及排除标准
纳入标准:均符合《中国急性缺血性脑卒中诊治指南》[8]中ACI相关诊断标准,并结合影像学、血清学检查确诊;均为首次发病;发病至入院时间<24 h;患者及家属知晓本研究,并签署知情同意书。
排除标准:合并其他脑血管疾病或单纯脑部出血;合并造血系统疾病、凝血因子缺乏及功能异常;存在自身免疫性疾病或全身性感染疾病;合并精神异常无法配合本研究检查;心脏、肺、肝脏、肾脏等严重脏器功能障碍;合并恶性肿瘤。
1.3 方法
1.3.1 治疗方法:所有患者入院后给予静脉溶栓治疗。阿替普酶 (德国Boehringer Ingelheim Pharma GmbH公司,批准文号:SJ20160055) 剂量为0.9 mg/kg,最大剂量不超过90 mg,若溶栓过程中患者收缩压>180 mmHg或舒张压>100 mmHg则停止治疗,静脉注射盐酸乌拉地尔 (西安利君制药有限责任公司,批准文号:H20000254) (2 mg/min),当血压<180/100 mmHg后,继续输注溶栓药物。若输注过程中或溶栓治疗3 d内患者发生颅内压升高、神经功能恶化及意识障碍等症状,立即行颅脑CT排查。
1.3.2 血清指标检测:采集所有患者溶栓前、溶栓1 h后外周静脉血5 mL,37 ℃条件下经离心半径8 cm、3 500 r/min离心10 min后,分离血清、血浆,于-20 ℃冰箱保存待测。采用酶联免疫吸附法测定血清sTLT-1、TRAF6、ANGPTL8水平,仪器选用英诺华医疗公司ER-504型酶标仪及配套试剂盒。所有操作严格按照仪器及试剂盒相关说明进行。
1.4 观察指标
患者溶栓后3 d复查CT,根据是否发生HT分为发生组与未发生组。比较2组溶栓前、溶栓1 h后血清TRAF6、sTLT-1、ANGPTL8水平及差值,分析血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值与HT发生的关系,并分析血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值对HT的预测价值。
1.5 统计学分析
采用统计学软件SPSS 22.0处理数据,计量资料均确认具备方差齐性且符合正态分布,以±s表示,组间比较采用独立样本t检验,计数资料用n(%)表示,组间比较行χ2检验,采用logistic回归方程分相关影响因素,预测价值分析采用受试者操作特征(receiver operating characteristic,ROC) 曲线,获取曲线下面积 (area under the curve,AUC)、置信区间、灵敏度和特异度,P< 0.05为差异有统计学意义。
2 结果
2.1 2组一般资料比较
2组性别、年龄、BMI、吸烟、饮酒、高血压、糖尿病、脑梗死部位等比较差异无统计学意义 (P>0.05);发生组脑梗死面积、入院时NIHSS评分、发病至溶栓时间与未发生组比较,差异有统计学意义 (P<0.05),见表1。
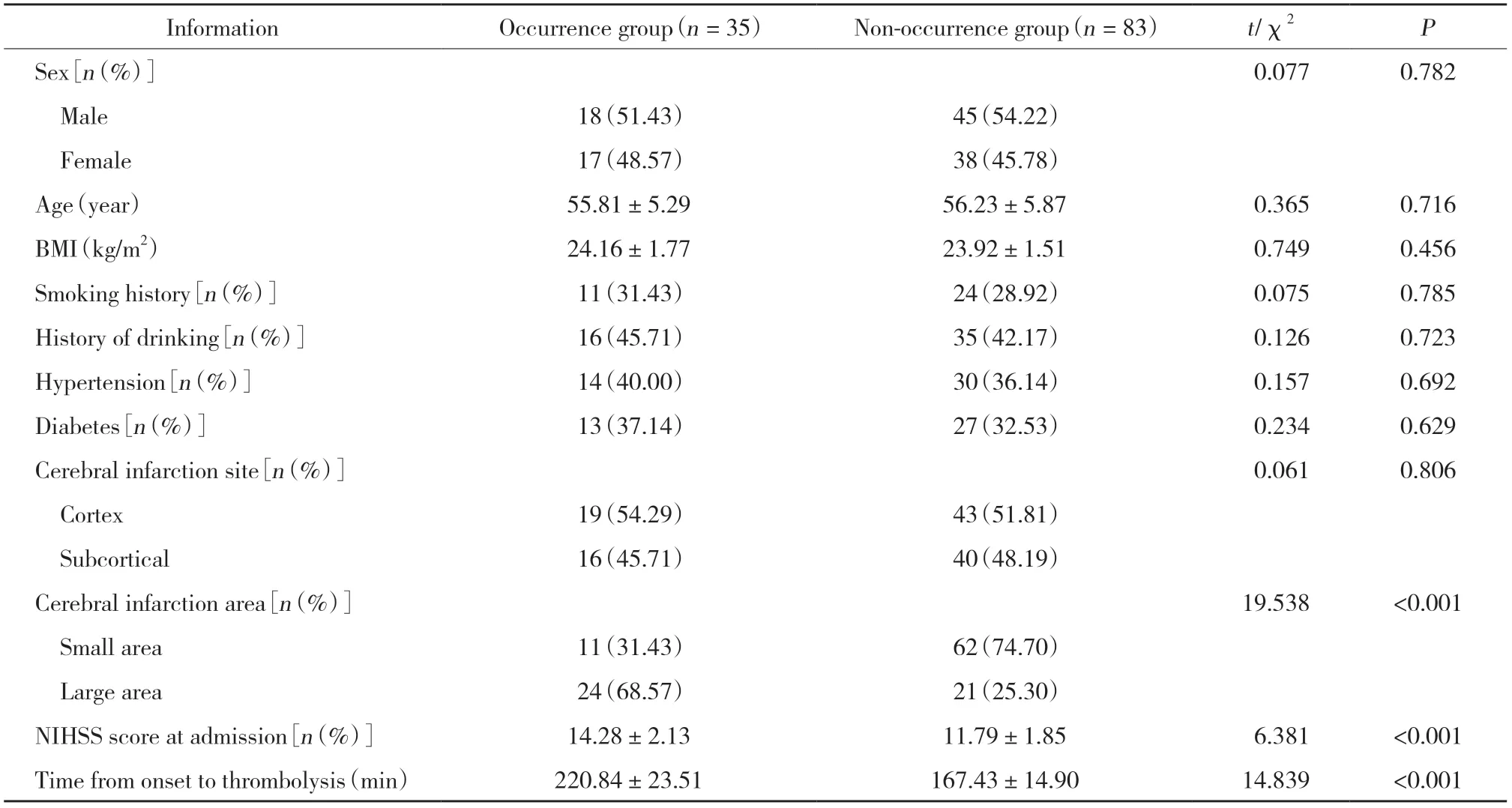
表1 2组临床资料比较Tab.1 Inter-group comparison of clinical data
2.2 2组溶栓前后血清TRAF6、sTLT-1、ANGPTL8水平比较(表2)
表2 2组溶栓前后血清TRAF6、sTLT-1、ANGPTL8水平比较 (±s)Tab.2 Inter-group comparison of serum levels of TRAF6,sTLT-1,and ANGPTL8 before and after thrombolysis (±s)
1) Compared with the same group before thrombolysis,P < 0.05.
Group TRAF6 (μg/mL) sTLT-1 (pg/mL) ANGPTL8 (ng/L)Before thrombolysis 1 h after thrombolysis Occurrence group (n = 35)6.18±1.035.49±0.911) 76.18±10.2163.79±8.221) 2 268.93±481.301 672.48±319.621)Non-occurrence group (n = 83)5.22±0.954.30±0.831) 68.46±7.6552.67±6.141) 1 794.55±327.191 026.74±253.841)t 4.8896.9124.5178.0956.21211.661 P<0.001<0.001<0.001<0.001<0.001<0.001 1 h after thrombolysis Before thrombolysis 1 h after thrombolysis Before thrombolysis
发生组溶栓前、溶栓后1 h血清TRAF6、sTLT-1、ANGPTL8水平均高于未发生组 (P< 0.05);2组溶栓后1 h血清TRAF6、sTLT-1、ANGPTL8水平均较溶栓前下降 (P< 0.05)。
2.3 2组血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值
与未发生组相比,发生组血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值减少 (P< 0.05),见表3。
表3 2组血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值比较 (±s)Tab.3 Comparison of differences in serum TRAF6,sTLT-1,and ANGPTL8 before and after thrombolysis (±s)

表3 2组血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值比较 (±s)Tab.3 Comparison of differences in serum TRAF6,sTLT-1,and ANGPTL8 before and after thrombolysis (±s)
D-value,difference value.
GroupTRAF6 D-valuesTLT-1 D-value (pg/mL) ANGPTL8 D-value Occurrence group (n = 35)0.69±0.2412.39±2.81596.45±127.40 Non-occurrence group (n = 83)0.92±0.2815.79±3.34767.81±185.72 t 4.2445.2824.981 P<0.001<0.001<0.001
2.4 血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值与HT发生的关系
logistic回归分析结果显示,血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值均与HT发生独立相关 (P<0.05),见表4。
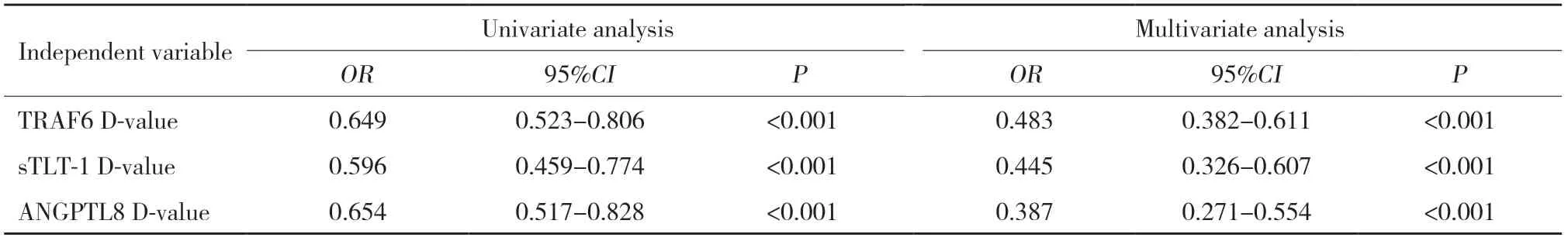
表4 血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值与HT发生的关系Tab.4 Relationship between the difference in serum TRAF6,sTLT-1,and ANGPTL8 before and after thrombolysis and the occurrence of HT
2.5 血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值对HT的预测价值
ROC曲线分析结果显示,血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值预测HT发生的AUC分别为0.703 (95%CI:0.611~0.783)、0.740 (95%CI:0.652~0.817)、0.689 (95%CI:0.597~0.771),灵敏度分别为51.43%、80.00%、97.14%,特异度分别为86.75%、62.65%、40.96%,见图1。
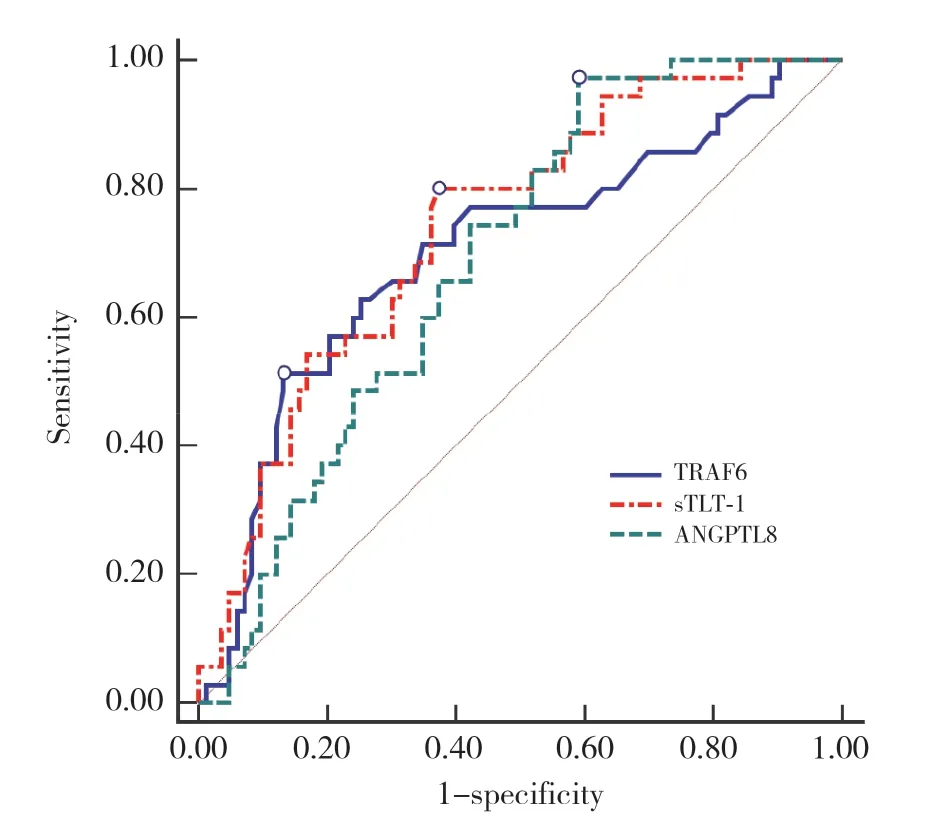
图1 血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值对HT的预测价值Fig.1 The predictive value of the difference in serum TRAF6,sTLT-1,and ANGPTL8 before and after thrombolysis for HT
2.6 联合预测价值
将血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值进行logistic二元回归拟合,返回预测概率Logit (P)作为独立检验变量,获取联合预测HT发生的AUC为0.920 (95%CI:0.855~0.962),灵敏度为94.29%,特异度为75.90%,优于各指标单独预测,见图2。
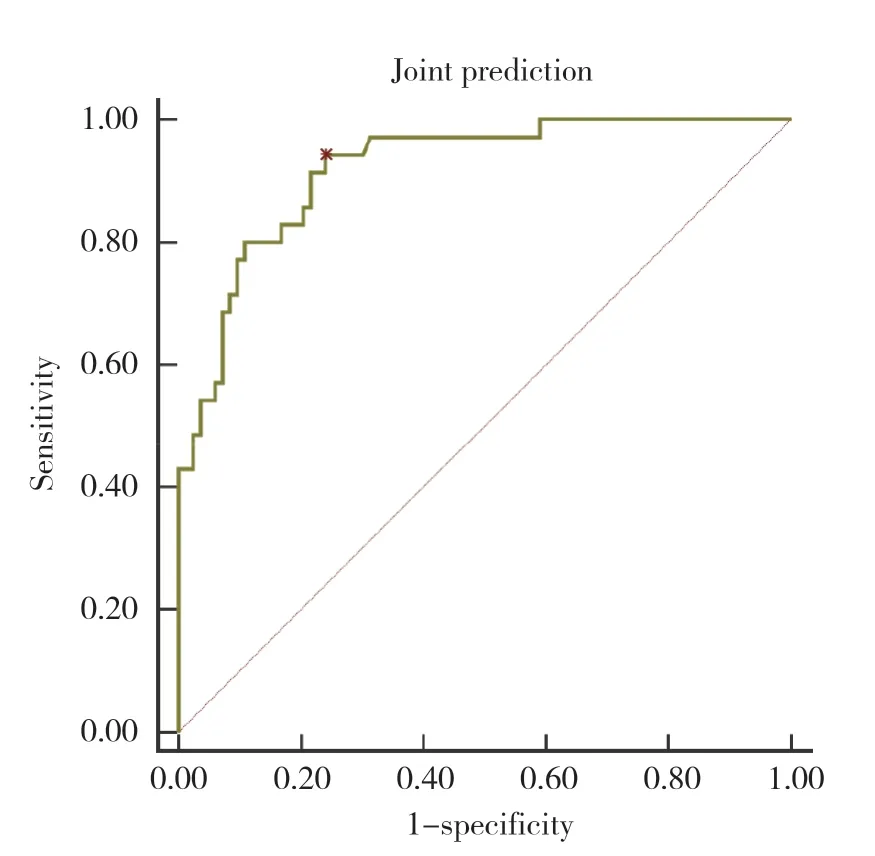
图2 联合预测价值ROC曲线Fig.2 Joint forecast value ROC curve
3 讨论
HT为缺血性脑卒中常见并发症之一,出血区域可于梗死区及远隔梗死区发生,对ACI患者预后恢复和生命安全造成严重威胁[9]。研究[10-11]显示,炎症反应在ACI病理、生理过程中发挥重要作用,HT发生后脑血管梗阻致使脑组织缺氧、缺血,诱发级联炎症反应,从而进一步加重脑组织损伤,且由于大量炎性细胞因子分泌释放,血管功能活化程度加重,血管通透性提高,最终引起破裂出血。因此,积极探讨HT病理相关血清学指标,对预测ACI患者HT发生风险具有重大意义。
已有研究[12]证实炎性细胞因子与HT的发生密切相关,而脑梗死发生后缺血期及再灌注期均可导致炎性细胞因子聚集,致使谷胱甘肽水平下降,加重氧化应激反应,引起局部炎症瀑布。研究[13]发现,sTLT-1可通过提高G-肌动蛋白与血小板黏性并黏附于血管内皮,从而引起动脉粥样硬化及血管栓塞。本研究结果显示,溶栓前后发生组、未发生组血清sTLT-1水平均存在统计学差异,进一步分析发现其差值与HT发生独立相关 (OR= 0.483)。ACI患者机体炎症反应加重后,血清sTLT-1水平随之提高,而缺血、病毒感染引起机体出现的炎症反应为ACI患者发生继发性损伤的主要机制。国外研究[14]显示,当机体处于缺血状态时,黏附因子、细胞因子、炎性细胞因子水平升高,诱使血脑屏障损伤及炎症细胞浸润,致使机体炎症反应加剧,增加脑部出血风险,血清sTLT-1表达也有所提高。张文青等[15]研究发现,血清sTLT-1水平随ACI疾病分级增加而提高,且与患者神经功能缺损程度呈正相关 (r= 0.756),进一步证实血清sTLT-1与ACI病情的关系。
TRAF6为信号通路转导蛋白之一,可参与多条凋亡信号及炎症反应通路[16]。本研究logistic回归分析结果显示,血清TRAF6水平为ACI患者发生HT的重要影响因素。目前TRAF6已广泛应用于肿瘤疾病的评估诊断中,近来有研究[17]发现,动脉粥样硬化患者血清TRAF6、TLR4水平显著高于健康对照组,经药物干预后可降低其表达,缓解脑部损伤程度,提示TRAF6与脑动脉粥样硬化损伤存在紧密联系。另一项研究[18]发现,血清TRAF6表达随脑梗死病情加重而升高,对于预测并发不良脑血管疾病AUC为0.823,灵敏度和特异度分别为71.28%和93.57%。结合本研究结果可说明血清TRAF6对ACI患者并发不良脑血管事件具有一定预测价值。
ANGPTL8为一种参与葡萄糖稳态调节的新型激素,既往研究[19]发现其在机体调节脂代谢、血糖调节中发挥重要作用。本研究结果显示,ACI患者溶栓前后血清ANGPTL8水平表达与HT的发生密切相关。通过研究血清ANGPTL8水平与动脉粥样硬化之间的关系发现,在排除组间混杂因素后,颅内动脉粥样硬化性狭窄患者轻度、中度、重度组血清ANGPTL8水平依次升高,进一步经Spearman相关性分析结果显示,ANGPTL8水平与动脉粥样硬化性狭窄程度呈正相关 (r= 0.815)[20]。研究[21]表明,ANGPTL8可促进动脉内脂质沉积、血管炎症及动脉斑块稳定性下降,且ANGPTL8为一种应激反应介导的蛋白,可于脂肪组织中通过促使早期反应生长因子参与甘油三酯脂肪酶下调,引起脂质代谢紊乱,促进动脉粥样硬化,从而增加脑部出血风险。基于上述研究结果,本研究分析了上述指标对HT发生的预测价值,发现血清TRAF6、sTLT-1、ANGPTL8溶栓前后差值预测HT发生的AUC分别为0.703、0.740和0.689,各指标差值联合预测AUC为0.920,优于单一指标预测。
综上所述,血清TRAF6、sTLT-1、ANGPTL8水平与ACI患者HT的发生、发展密切相关,临床可通过各指标联合应用预测HT发生风险,以制定相应的干预措施,从而改善预后。

