异槲皮苷抗腹泻作用的研究
张晓萌, 郭丽阳, 杨 帆, 胡婉君, 盛尊来
(东北农业大学动物医学学院, 黑龙江 哈尔滨 150030)
随着畜牧业的集约化和规模化发展,腹泻作为多种疾病的伴随症状,越来越多发,通常会阻碍畜禽生长发育,严重时引起死亡,对养猪行业造成的危害尤为显著[1],因此腹泻的防治已经成为畜牧养殖业亟需解决的难题。腹泻的常见特征是粪便排出量增加,状态发生变化,通常变成液体状或糊状,有腹痛情况等[2,3]。在养殖过程中,对于腹泻的治疗,普遍采用集中使用抗生素,不仅导致大量耐药菌株的出现,而且会忽视抑制腹泻症状的重要性。然而,过度腹泻正是引起肠道组织损伤的重要原因。因此,在腹泻治疗的研究中,寻找新的有效的天然抗腹泻药物至关重要。
异槲皮苷作为芦丁的次生苷,首次从红叶加拿大紫荆(Cerciscanadensis)的种子荚中分离得到[4],随着研究的深入,发现异槲皮苷的稳定性和生物利用度优于芦丁,且其在代谢过程中的药理活性丰富,具有成骨作用、消炎作用、利尿作用和抗癌作用等[5-8]。芦丁已经被证实具有较好的抗腹泻作用[9],但对异槲皮苷的抗腹泻作用却缺乏研究和报道,本试验旨在探究异槲皮苷的抗腹泻作用,为其临床应用提供科学依据。
1 材料与方法
1.1 药品和主要试剂 芦丁和异槲皮苷,均购自安徽酷尔生物工程有限公司;盐酸洛哌丁胺(2 mg/粒),购自广济大药房,批号:H10910085;蓖麻油(分析纯),购自源叶生物有限公司;α-L-鼠李糖苷酶,购自南通英瑞达生物试剂有限公司;醋酸-醋酸钠(Acetic acid-sodium acetate,HAc-NaAc)缓冲液(pH 5.0),购自汕头西陇科学股份有限公司;钠/氢交换因子1(Sodium/hydrogen exchange factor 1,NHE1)、钠/氢交换因子2(Sodium/hydrogen exchange factor 2,NHE2)、钠/氢交换因子3(Sodium/hydrogen exchange factor 3,NHE3)、水通道蛋白 4(Aquaporin 4,AQP4)、钠/葡萄糖协同转运蛋白1(Sodium/glucose cotransporter 1,SGLT1)和囊性纤维化跨膜传导调节蛋白(Cystic fibrosis transmembrane conductance regulator protein,CFTR)mRNA检测用引物,均由生工生物工程(上海)股份有限公司设计合成。
1.2 主要仪器 IY 2002 电子天平,深圳明科科技有限公司产品;Fw135 中药粉碎机,大连美罗仪器股份有限公司产品;有机微孔滤膜0.22 μm和微孔滤膜(水膜) 0.22 μm,安捷伦科技有限公司产品;BILON-S650CT 超声提取器,深圳三利有限公司产品;Waters e2695高效液相色谱仪,上海沃特世科技有限公司产品;Gemini C18色谱柱(250.0 mm×4.6 mm,5 μm),美国Phenomenex分析仪器有限公司产品。
1.3 实验动物 昆明小鼠[7周龄,雌雄各半,体重(20±2) g]和Wistar大鼠[6~7周龄,雌雄各半,体重(200±20) g],均由哈尔滨医科大学动物实验中心提供,实验动物生产许可证号:SYXK(黑)2022—004。
1.4 试验方法
1.4.1 异槲皮苷的制备 在最佳的酶水解条件下,使用芦丁制备异槲皮苷[10,11]。称取芦丁24 g,置于500 mL圆底烧瓶中,依次加入150 mL HAc-NaAc缓冲液(pH 5.0)、150 mL α-L-鼠李糖苷酶溶液,持续反应6 h,加入150 mL水饱和的正丁醇终止反应。离心后分取上清液,减压浓缩后得黄色针状结晶,经高效液相色谱(High performance liquid chromatography,HPLC)与异槲皮苷对照品进行比对。
1.4.2 腹泻抑制率的测定 采用蓖麻油诱导的小鼠腹泻模型[12],将25只昆明小鼠随机分为5个组,每组5只。禁食18 h后,腹泻模型组按10 mg/(kg·bw)剂量灌胃给予蒸馏水,异槲皮苷低、中、高剂量组分别按12.5、25.0和50.0 mg/(kg·bw)剂量灌胃给予异槲皮苷,药物对照组按2 mg/(kg·bw)剂量灌胃给予洛哌丁胺。1 h后,各组小鼠均按10 mg/(kg·bw)剂量灌胃给予蓖麻油,连续观察4 h,记录初次腹泻时间和稀便次数。按公式(1)计算腹泻抑制率。
腹泻抑制率(%)=(腹泻模型组稀便次数-给药组稀便次数)÷腹泻模型组稀便次数×100%
(1)
1.4.3 炭粉推进抑制率的测定 将25只昆明小鼠随机分为5个组,每组5只。禁食18 h后,空白对照组按10 mg/(kg·bw)剂量灌胃给予蒸馏水,异槲皮苷低、中、高剂量组分别按12.5、25.0和50.0 mg/(kg·bw)剂量灌胃给予异槲皮苷,药物对照组按2 mg/(kg·bw)剂量灌胃给予洛哌丁胺。1 h后,每只小鼠灌胃给予0.2 mL浓度为5%的活性炭溶液,30 min后,颈背脱位处死小鼠并分取小肠,置于4%多聚甲醛中固定5 min,将小肠轻轻拉直,置于白色滤纸上,测量小肠全长和炭粉在肠内推进距离(幽门至活性炭前),并按公式(2)和(3)计算炭粉推进抑制率。
炭粉推进率(%)=炭粉在肠内推进距离(cm)÷小肠全长(cm)×100%
(2)
炭粉推进抑制率(%)=(空白对照组炭粉推进率-给药组炭粉推进率)÷空白对照组炭粉推进率×100%
(3)
1.4.4 小肠积液抑制率的测定 将25只Wistar大鼠随机分为5个组,每组5只。禁食18 h后,腹泻模型组按10 mg/(kg·bw)剂量灌胃给予蒸馏水,异槲皮苷低、中、高剂量组分别按12.5、25.0和50.0 mg/(kg·bw)剂量灌胃给予异槲皮苷,药物对照组按2 mg/(kg·bw)剂量灌胃给予洛哌丁胺。1 h后,各组大鼠均按10 mg/(kg·bw)剂量灌胃给予蓖麻油,30 min后,处死大鼠并分取小肠,挤出小肠内容物并测定其体积,按公式(4)计算小肠积液抑制率。
小肠积液抑制率(%)=(腹泻模型组小肠积液体积-给药组小肠积液体积)÷腹泻模型组小肠积液体积×100%
(4)
1.4.5 实时荧光定量PCR(Quantitative real-time polymerase chain reaction,qRT-PCR)检测离子通道蛋白mRNA表达量 将25只昆明小鼠随机分为5个组,每组5只。禁食18 h后,空白对照组和腹泻模型组分别按10 mg/(kg·bw)剂量灌胃给予蒸馏水,异槲皮苷低、中、高剂量组分别按12.5、25.0和50.0 mg/(kg·bw)剂量灌胃给予异槲皮苷。1 h后,空白对照组按10 mg/(kg·bw)剂量灌胃给予蒸馏水,其余各组按10 mg/(kg·bw)剂量灌胃给予蓖麻油。连续处理7 d后处死小鼠,并分别取结肠组织,用qRT-PCR检测NHE1、NHE2、NHE3、CFTR、SGLT1和AQP4的mRNA相对表达量,引物序列见表1。以GADPH为内参基因,空白对照组、异槲皮苷低、中、高剂量组的目的基因对于腹泻模型组的相对表达量计算采用2-ΔΔCt法。

表1 离子通道蛋白qPCR检测引物序列
1.5 统计分析 所有数据均用“平均值±标准差”表示。采用SPSS 17.0软件对数据进行单因素方差分析(One-way analysis of variance,ANOVA),方差齐性检验后进行沃勒-邓肯多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 异槲皮苷的制备 HPLC检测结果如图1所示,与异槲皮苷对照品比对,由芦丁经酶水解制备的化合物为异槲皮苷,其含量为95%。

图1 异槲皮苷样品(A)和对照品(B)HPLC检测
2.2 异槲皮苷对腹泻抑制率的影响 如表2所示,与腹泻模型组相比,异槲皮苷各剂量组和药物对照组小鼠初次腹泻时间均极显著延迟(P<0.01),异槲皮苷高剂量组和药物对照组小鼠稀便次数均显著减少(P<0.05),并且异槲皮苷的腹泻抑制率呈剂量依赖性。
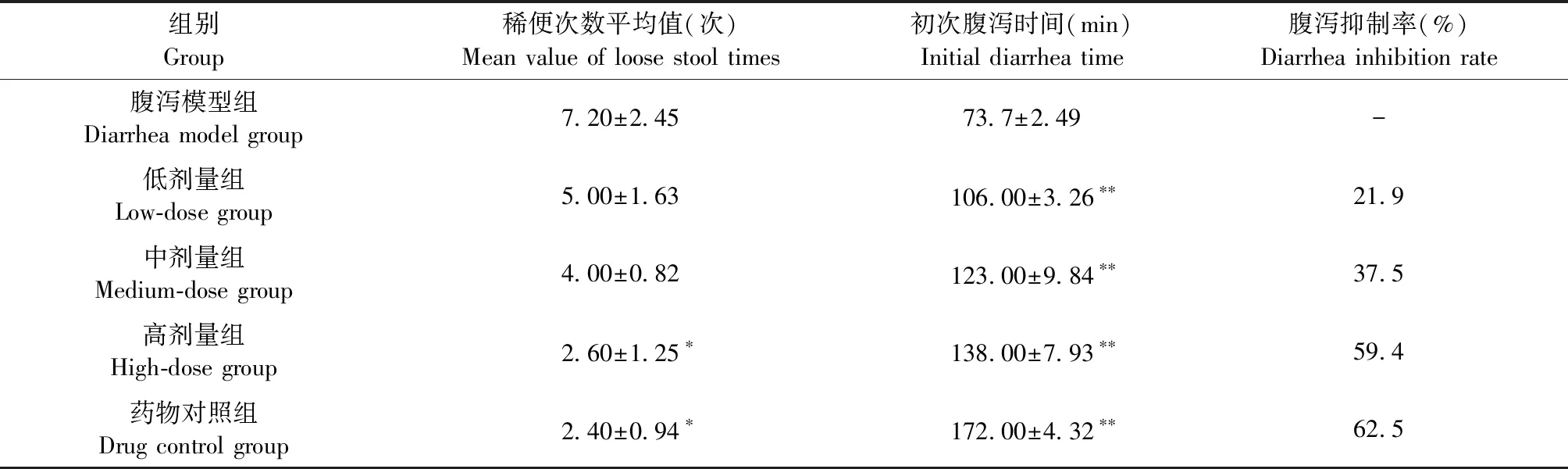
表2 异槲皮苷对小鼠初次腹泻时间和腹泻抑制率的影响
2.3 异槲皮苷对炭粉推进抑制率的影响 如表3所示,空白对照组小鼠炭粉推进率可达小肠总长度的22.20%,而异槲皮苷低、中、高剂量组炭粉在小鼠小肠内的推进距离均显著缩短(P<0.05或P<0.01),其炭粉推进抑制率呈现良好的剂量依赖性(37.4%~67.5%),但弱于药物对照组。
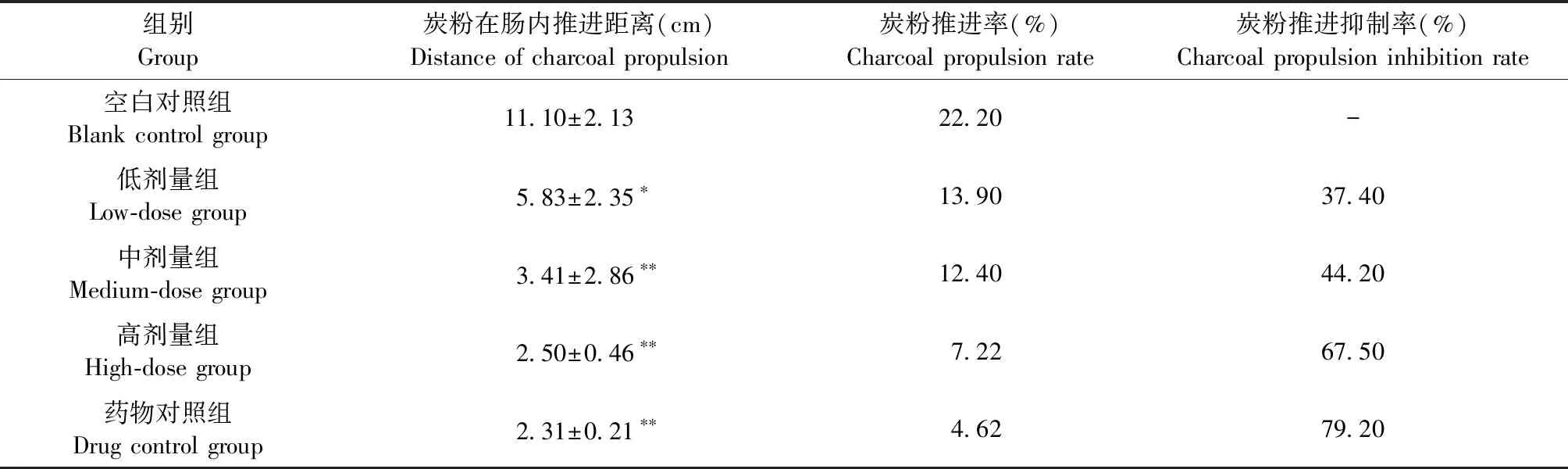
表3 异槲皮苷对小鼠小肠炭粉推进运动的影响
2.4 异槲皮苷对小肠积液抑制率的影响 如表4所示,与腹泻模型组相比,异槲皮苷低、中、高剂量组和药物对照组小肠积液体积均显著减少(P<0.05或P<0.01),并且异槲皮苷对小肠积液的抑制作用呈一定的剂量依赖性。

表4 异槲皮苷对大鼠小肠积液的影响
2.5 异槲皮苷对离子通道蛋白mRNA表达量的影响 如图2所示,与空白对照组比较,腹泻模型组NHE1、NHE2、NHE3、AQP4和SGLT1 mRNA相对表达量均显著降低(P<0.05),CFTRmRNA相对表达量显著升高(P<0.05);与腹泻模型组比较,异槲皮苷低、中剂量组的NHE1、NHE2、NHE3和SGLT1 mRNA相对表达量略上调,但差异不显著(P>0.05);高剂量组NHE1、NHE2、NHE3、AQP4和SGLT1 mRNA相对表达量均显著上调(P<0.05),CFTRmRNA相对表达量显著下调(P<0.05)。
3 讨论
腹泻是当今全球性重要的公共卫生问题之一,世界卫生组织(World Health Organization,WHO)已把对腹泻疾病的控制列为全球战略,其发病机制多样,包括肠黏膜结构损伤,导致肠道黏膜充血、水肿、发生炎性渗出和其他病理变化,从而引发腹泻[13,14]。
蓖麻油在体内可被胰脂蛋白酶水解而释放蓖麻油酸,蓖麻油酸可刺激小肠黏膜使其通透性发生改变,从而导致水样内容物快速通过小肠和大肠,发生腹泻。本试验结果显示,异槲皮苷可明显延迟初次腹泻时间,减少稀便次数,因此异槲皮苷对蓖麻油诱导的腹泻具有一定的抑制作用。同时,与空白对照组相比,异槲皮苷组小鼠的炭粉推进抑制率明显增加,表明异槲皮苷具有一定的肠蠕动抑制作用。肠蠕动减少能够让肠液和电解质有更多的时间被重新吸收,减少液体损失和粪便排出量,从而缓解腹泻。在小肠积液抑制试验中,异槲皮苷对小肠积液表现出显著的剂量依赖性抑制作用,而对肠道离子通道的调控与肠腔积液具有重要关系,可以推测,异槲皮苷对离子通道应具有调控作用。
根据文献报道,NHE家族[15]、AQP4[16]、SGLT1[17]和CFTR[18]等离子通道蛋白能够影响肠液的吸收和分泌,因此,药物能够通过对离子通道的调控发挥抗腹泻作用。本试验结果显示,与空白对照组比较,腹泻模型组各离子通道蛋白的mRNA表达量具有显著变化,而经异槲皮苷干预后,均有不同程度的回调,尤其CFTR的mRNA表达量回调最为显著。这也意味着降低CFTR离子通道基因表达、上调NHE1、NHE2、NHE3、AQP4和SGLT1基因表达,是异槲皮苷抗腹泻的重要机制。
综上所述,异槲皮苷对腹泻症状具有较好的治疗和缓解效果,为异槲皮苷作为抗腹泻添加剂的使用提供了理论依据。

