指纹图谱结合一测多评法评价山楂叶质量Δ
李艳荣 ,段丽颖 ,魏 红 ,杜义龙 ,赵胜男 ,高 晗 ,潘海峰 #(.承德医学院中药研究所/河北省中药研究与开发重点实验室,河北 承德 067000;.北京工业大学医院药剂科,北京 004;.神威药业集团有限公司,石家庄 0540)
山楂叶是蔷薇科植物山里红CrataeguspinnatifidaBge.var.majorN.E.Br.或山楂CrataeguspinnatifidaBge.的干燥叶,具有活血化瘀、理气通脉、化浊降脂之功效[1]。现代研究表明,山楂叶主要含有黄酮类、萜类和有机酸类等化合物[2―3],具有抗动脉粥样硬化、降压降脂、增加冠状动脉血流量等药理活性[4―5],在心脑血管疾病治疗领域效果突出[6]。2020年版《中国药典》(一部)以金丝桃苷含量作为山楂叶药材的定量指标[1]。由于中药大多具有化学成分多、作用机制复杂、治疗效果多样等特点,因此单一成分难以全面反映药材质量,需要对药材质量进行整体控制[7]。指纹图谱是符合中药特点的质量控制模式之一,能够较全面地反映中药所含化学成分的种类和数量,从而体现中药的整体性和复杂性[8]。但指纹图谱无法表征已知成分的含量[9],故在其基础上进行多组分含量测定可以弥补上述不足。多组分含量测定多用外标法,但由于对照品价格昂贵、难以获得,使得检测成本较高。一测多评(quantitative analysis of multicomponents by single-marker,QAMS)法只需定量分析1个成分(内参物)即可实现多成分含量的同时测定[10],可有效解决对照品紧缺和检测成本高的问题。基于此,本研究对河北省承德市、辽宁省葫芦岛市、山西省运城市、山东省临沂市4 个主产地的78 批山楂叶药材进行指纹图谱研究和灰色关联分析(grey correlation analysis,GCA)、聚类分析(cluster analysis,CA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),采用QAMS 法检测药材中5 种主要有效成分(绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷和异槲皮素[4―5])的含量,评价不同产地山楂叶的质量并筛选影响其质量的差异标志物,以期为全面评价山楂叶药材质量提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有Agilent 1200型高效液相色谱(HPLC)仪(美国Agilent公司)、KQ-700型超声波清洗器(昆山市超声仪器有限公司)、AG-254 型十万分之一电子分析天平(瑞士Mettler Toledo公司)、HC-2062型高速离心机(科大创新股份有限公司中佳分公司)等。
1.2 主要药品与试剂
绿原酸对照品(批号18071907)、牡荆素葡萄糖苷对照品(批号20042305)、牡荆素鼠李糖苷对照品(批号20042304)、金丝桃苷对照品(批号19103001)、异槲皮素对照品(批号18062702)均购自成都普菲德生物技术有限公司,纯度均不低于98.0%;乙腈、四氢呋喃、甲酸均为色谱纯,其余试剂均为分析纯,水为纯净水。
78 批山楂叶药材(编号S1~S78)分别来自河北省承德市、山东省临沂市、辽宁省葫芦岛市、山西省运城市4 个主产地,经全国老中医药专家(传统鉴定)学术经验继承人孙宝惠主任药师鉴定,均为山里红C.pinnatifidaBge.var.majorN.E.Br.的干燥叶。78 批药材采自2020年10-11月和2021年10-11月,分别产自河北省承德市隆化县(编号S1、S4、S8、S10、S19、S22、S26、S28、S37、S39、S42、S44、S63~S67、S76~S78)、河北省承德市承德县(编号S2、S3、S6、S7、S20、S21、S24、S25、S38、S41、S60~S62)、河北省承德市滦平县(编号S9、S27、S43)、河北省承德市兴隆县(S5、S23、S40)、河北省承德市鹰手营子镇(编号S45)、辽宁省葫芦岛市建昌县(编号S12~S14、S29~S31、S50~S54、S68~S70)、山东省临沂市费县(编号S11、S46~S49)、山西省运城市夏县(编号S15~S18、S32~S36、S55~S59、S71~S75)。
2 方法与结果
2.1 色谱条件
以Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈-四氢呋喃混合溶液(体积比12∶1)为流动相A、0.3%甲酸溶液为流动相B进行梯度洗脱(0~15 min,8%A→12%A;15~25 min,12%A→16%A;25~38 min,16%A→15%A;38~45 min,15%A→20%A;45~50 min,20%A→34%A;50~55 min,34%A→100%A);流速为1.0 mL/min;柱温为30 ℃;检测波长为363 nm;进样量为10 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液
取绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素对照品各适量,精密称定,用甲醇溶解并定容,制成质量浓度分别为1.02、1.02、1.07、1.04、0.41 mg/mL 的单一对照品储备液。分别取上述单一对照品储备液适量,置于10 mL容量瓶中,以50%甲醇稀释,制成每1 mL 含绿原酸75.33 μg、牡荆素葡萄糖苷80.18 μg、牡荆素鼠李糖苷115.77 μg、金丝桃苷35.26 μg、异槲皮素12.40 μg的混合对照品溶液,摇匀,即得。
2.2.2 供试品溶液
取山楂叶药材,粉碎,取粉末(过80 目筛)约1.0 g,精密称定,置于具塞三角瓶中,精密加入60%甲醇50 mL,称重,超声(频率40 kHz,功率700 W,下同)提取30 min,放至室温后再次称重,用60%甲醇补足失重,静置,以12 000 r/min 离心10 min,取上清液,经0.45 μm 微孔滤膜滤过,取续滤液,即得。
2.3 指纹图谱分析
2.3.1 方法学考察
(1)精密度试验:取山楂叶供试品溶液(编号S43),按“2.1”项下色谱条件连续进样6次,记录色谱图。以峰4(保留时间适中且峰面积较大,下同)为参照峰,计算得各共有峰相对峰面积的RSD 均小于1.9%,各共有峰相对保留时间的RSD 均小于0.2%(n=6),表明方法精密度良好。
(2)重复性试验:取山楂叶药材(编号S43),粉碎,取粉末6 份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录色谱图。以峰4为参照峰,计算得各共有峰相对峰面积的RSD均小于1.6%,各共有峰相对保留时间的RSD 均小于0.2%(n=6),表明方法重复性良好。
(3)稳定性试验:取山楂叶供试品溶液(编号S43),分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样分析,记录色谱图。以峰4为参照峰,计算得各共有峰相对峰面积的RSD 均小于1.9%,各共有峰相对保留时间的RSD 均小于0.2%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.3.2 指纹图谱建立、共有峰指认和相似度评价
取78批山楂叶药材样品,粉碎,取粉末,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录色谱图。将图谱结果以“AIA”格式导出,利用《中药色谱指纹图谱相似度评价系统(2012 版)》,以S1样品图谱为参照,设定时间窗宽度为0.2 min,以中位数法结合多点校正,生成叠加指纹图谱和对照指纹图谱(R),具体见图1。共标定共有峰8 个,经对比混合对照品溶液色谱图(同法进样所得,具体见图2),指认了其中5个,分别为绿原酸(峰1)、牡荆素葡萄糖苷(峰3)、牡荆素鼠李糖苷(峰4)、金丝桃苷(峰7)、异槲皮素(峰8)。利用《中药色谱指纹图谱相似度评价系统(2012 版)》进行相似度评价,结果(表1)显示,78批样品指纹图谱与对照指纹图谱的相似度为0.871~0.998。

表1 78批山楂叶样品相似度评价及GCA分析结果
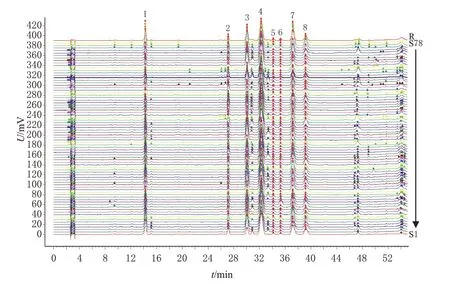
图1 78批山楂叶药材的HPLC叠加指纹图谱和对照指纹图谱(R)
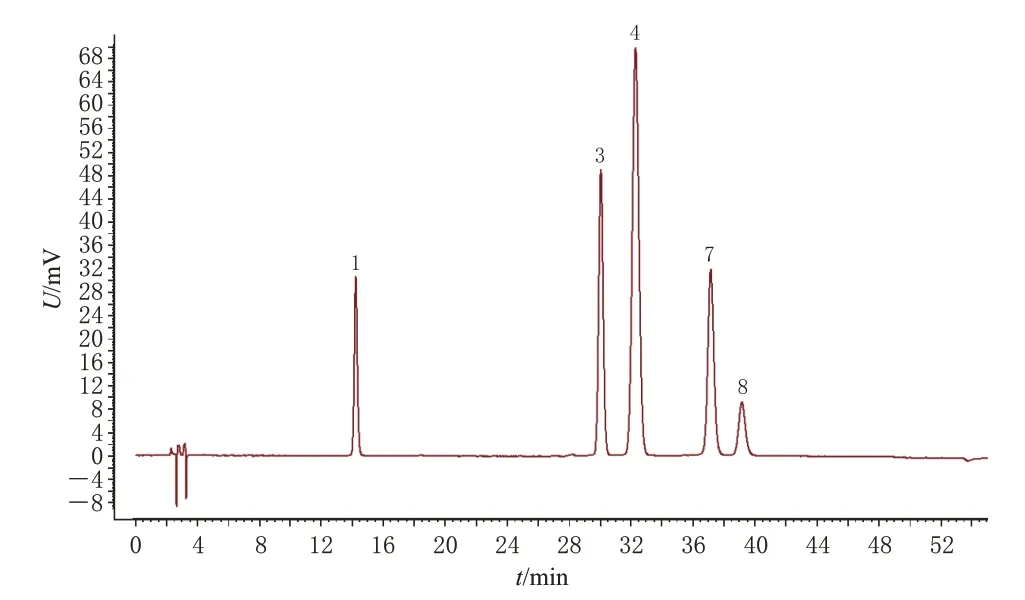
图2 混合对照品溶液的HPLC图
2.3.3 指纹图谱的化学模式识别分析
(1)GCA:以78 批山楂叶药材的8 个共有峰峰面积(采用均值法进行归一化处理)为评价指标并构建单元序列,选择最优参考序列和最差参考序列(其中最优、最差参考序列分别是所有样品的最大、最小值),计算各评价单元相对于最优、最差参考序列的相对最优、最差关联度及相对关联度,并对相对关联度进行排序,其中相对关联度大的样品质量较优[11]。结果(表1)显示,不同产地山楂叶药材的相对关联度为0.382~0.645,排前3位的S3、S7、S77 样品均产自河北省承德市。78 批样品中,河北省承德市、辽宁省葫芦岛市、山西省运城市、山东省临沂市样品的平均相对关联度分别为0.538、0.528、0.462、0.435。由此可知,河北省承德市样品的质量整体较优,其次为辽宁省葫芦岛市、山西省运城市、山东省临沂市样品。
(2)CA:CA 热图可对数据进行筛选、提取和降维,通过横向聚类来反映各样品之间的关系,纵向聚类来反映各化学成分之间的关系,该图通过渐变的蓝红色条来直观呈现数据结果,成分含量越高则条带颜色越红,反之越蓝[12]。本研究将4个主产地(河北省承德市、辽宁省葫芦岛市、山东省临沂市、山西省运城市)的78批山楂叶药材的8 个共有峰峰面积导入MetaboAnalyst 5.0 工具,相关数据经筛选、归一化处理后,得到CA热图(图3A)。由图3A可见,78批样品可分为2类,河北省承德市和辽宁省葫芦岛市样品大致分为一类,山东省临沂市和山西省运城市样品大致分为一类;结合热图的条带颜色可知,河北省承德市和辽宁省葫芦岛市样品中峰1、3、5、6、7、8 代表成分含量较高,山东省临沂市和山西省运城市样品中这6个成分含量则较低。
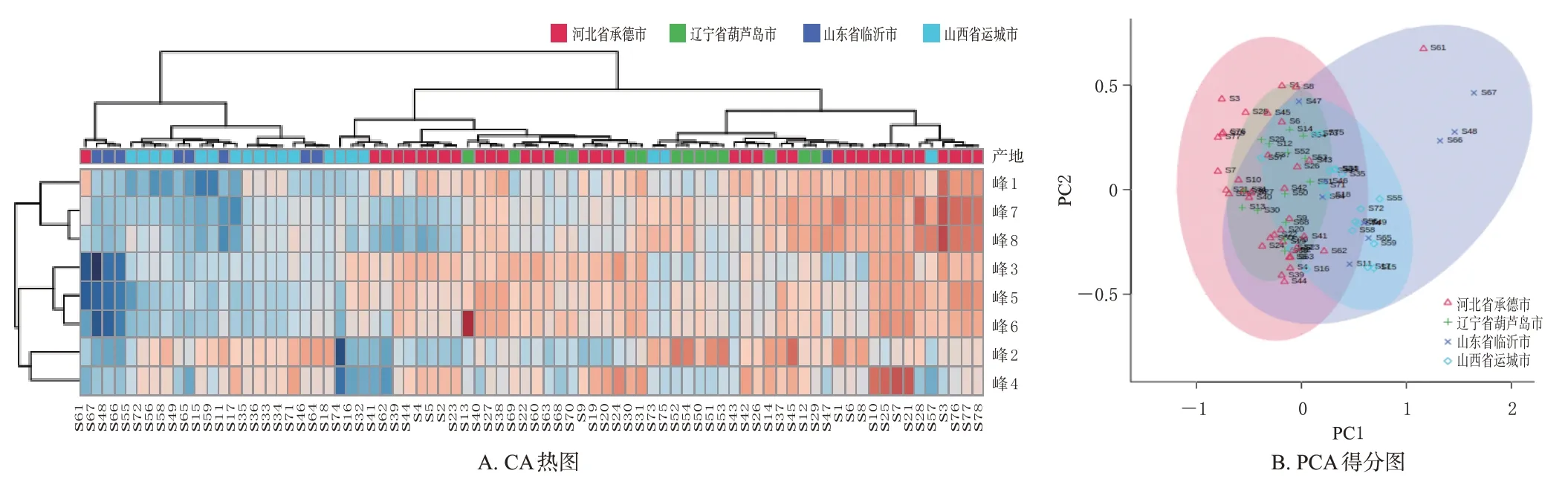
图3 78批山楂叶药材的CA热图和PCA得分图
(3)PCA:采用SPSS 19.0 软件,以78 批山楂叶药材的8 个共有峰峰面积为变量进行PCA,并进行KMO 检验及Bartlett 球形检验。结果显示,KMO 度量值为0.616,Bartlett 球形检验的P<0.001,可进行PCA[13]。将8 个共有峰峰面积导入MetaboAnalyst 5.0 工具,相关数据经筛选、归一化处理后,得到PCA得分图(图3B)。由图3B 可见,河北省承德市和辽宁省葫芦岛市样品大致可分为一类,山东省临沂市和山西省运城市样品大致可分为一类,与CA热图结果基本一致。
(4)OPLS-DA:为进一步明确差异标志物,本研究将78 批山楂叶药材的8 个共有峰峰面积导入SIMCA 14.1软件,建立OPLS-DA模型。由模型验证参数可知,模型的稳定性较好(R2X=0.843,R2Y=0.725)且交叉验证预测能力较强(Q2=0.532)[14]。置换检验的R2拟合直线在Y坐标轴上的截距为0.049 6(<0.3),说明所建模型可靠;Q2拟合直线在Y坐标轴上的截距为-0.188 0(<0.05),说明所建模型不存在过度拟合,可用于分析样品的组间差异[15]。提取OPLS-DA 模型中8 个共有峰的变量重要性投影(variable importance in the projection,VIP)值,以VIP 值>1 且误差线不超过原点为标准[16]进行差异标志物筛选,结果(图4)显示,峰1(绿原酸)、峰2、峰3(牡荆素葡萄糖苷)、峰5的VIP值均大于1,其对应成分为差异标志物,可能是影响山楂叶药材质量的主要化学成分。

图4 78批山楂叶药材8个共有峰的VIP值
2.4 5种有效成分含量的测定
2.4.1 方法学考察
(1)专属性试验:取山楂叶供试品溶液(编号S43)、混合对照品溶液和空白溶液(60%甲醇),按“2.1”项下色谱条件进样分析,记录色谱图(图略)。结果显示,空白溶液对各待测成分的测定无干扰,表明方法专属性良好。
(2)线性关系考察:精密吸取“2.2.1”项下5种单一对照品储备液各适量,置于同一10 mL 容量瓶中,以50%甲醇溶解并稀释,制成每1 mL含绿原酸192.00 μg、牡荆素葡萄糖苷204.00 μg、牡荆素鼠李糖苷300.00 μg、金丝桃苷131.82 μg、异槲皮素64.36 μg 的混合对照品溶液,记为1号混合对照品溶液;取1号混合对照品溶液适量,用50%甲醇分别稀释2、4、8、16、32、64、128 倍,分别记为2~8号混合对照品溶液。分别取上述1~8号混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积。以待测成分质量浓度为横坐标(X)、峰面积为纵坐标(Y)进行线性回归,结果见表2。

表2 5种待测成分的回归方程与线性范围
(3)精密度试验:取山楂叶供试品溶液(编号S43),按“2.1”项下色谱条件连续进样6次,记录峰面积。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素峰面积的RSD 分别为0.41%、0.29%、0.36%、0.39%、0.53%(n=6),表明方法精密度良好。
(4)重复性试验:精密称取山楂叶药材样品(编号S43),共6份,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积并按外标法计算各成分含量。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素含量的RSD分别为1.57%、2.48%、2.34%、2.44%、1.93%(n=6),表明方法重复性良好。
(5)稳定性试验:取山楂叶供试品溶液(编号S43),分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样分析,记录峰面积。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素峰面积的RSD 分别为0.63%、0.56%、0.84%、0.66%、1.29%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
(6)加样回收率试验:取已知含量的山楂叶药材样品(编号S43)约0.5 g,共6 份,精密称定,分别加入单一对照品储备液适量(加入量与已知量相等),按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷和异槲皮素的平均加样回收率分别为97.37%、101.44%、102.18%、96.79%、102.00%,RSD 分别为0.51%、0.67%、0.46%、0.72%、2.67%(n=6),表明方法准确度良好。
2.4.2 相对校正因子的计算
以牡荆素鼠李糖苷为内参物(含量较高),取“2.4.1(2)”项下1~8 号混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积并按下式计算相对校正因子(fK/S):fK/S=(CK×AS)/(CS×AK)(CS为内参物的质量浓度,AS为内参物的峰面积,Ck为待测成分的质量浓度,Ak为待测成分的峰面积)。结果显示,绿原酸、牡荆素葡萄糖苷、金丝桃苷、异槲皮素的平均相对校正因子分别为0.401、0.993、1.670、1.615,RSD 分别为1.58%、0.64%、0.38%、0.39%(n=8)。
2.4.3 不同试验条件对相对校正因子的影响
取“2.4.1(2)”项下1~8号混合对照品溶液,按“2.1”项下色谱条件进样分析,考察不同仪器(Agilent 1200、1100、1220 型HPLC 仪)、不同色谱柱[Agilent ZORBAX SB-C18、Agilent 5 HC-C18(2)、Shiseido CAPCELL PAKC18,规格一致]、不同流速(0.8、1.0、1.2 mL/min)、不同柱温(25、30、35 ℃)对相对校正因子的影响。结果显示,在上述条件下,绿原酸、牡荆素葡萄糖苷、金丝桃苷、异槲皮素的相对校正因子分别为0.374~0.404、0.979~1.003、1.626~1.725、1.579~1.647,RSD 分别为2.32%、0.67%、1.56%、1.24%(n=12),表明方法耐用性良好。
2.4.4 色谱峰定位
采用相对保留时间法进行色谱峰定位。取“2.4.1(2)”项下1~8 号混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积。以牡荆素鼠李糖苷为内参物,计算其余4个成分的相对保留时间。结果显示,绿原酸、牡荆素葡萄糖苷、金丝桃苷、异槲皮素的相对保留时间分别为0.422、0.930、1.540、1.218,RSD 分别为0.04%、0.02%、0.04%、0.15%(n=8)。
2.4.5 样品含量测定及比较
取78 批山楂叶药材的供试品溶液,按“2.1”项下色谱条件进样分析,记录峰面积,分别采用外标法和QAMS 法计算5 种成分的含量(内参物含量仅以外标法计算),并计算2 种方法结果的相对偏差(relative deviation,RD)。各样品平行测定2 次,结果以平均值展示。结果(图5)显示,78 批样品中,4 种成分的2 种方法含量测定结果较接近,除2批样品(S39和S41)中异槲皮素含量的RD值超过5%外,其余成分含量的RD值均不高于5%,提示2种检测方法结果无明显差异。

图5 78批山楂叶药材中5种有效成分含量的QAMS法与外标法测定结果比较(n=2)
3 讨论
3.1 指纹图谱结果分析
我国山楂栽培产地大致可分为京津冀、吉辽、中原等五大产区,主要产地有河北、辽宁、吉林、山东、山西等地[17]。本研究收集了2020年10-11月、2021年10-11月河北省承德市、山东省临沂市、辽宁省葫芦岛市、山西省运城市4个山楂叶主产地的78批样品,样品跨越2个年份且样品量充足,具有一定的代表性。中药指纹图谱具有整体性、全面性和系统性特点,能够全面反映中药材和中成药的质量[18]。本研究通过考察提取溶剂、提取方法、提取时间和色谱柱、流速、柱温、流动相比例等条件,对供试品溶液制备和色谱条件进行了优化,并建立了78 批山楂叶药材的指纹图谱,确定了8 个共有峰,指认了其中5个成分;各批样品的相似度为0.871~0.998,提示4个产地的山楂叶药材存在一定差异。本研究所建指纹图谱简单、易行,且HPLC法普适性强,可用于山楂叶药材的质量评价。
3.2 化学模式识别结果分析
指纹图谱结合化学模式识别能真实、形象地反映中药的质量差异,揭示其复杂成分之间的潜在规律,已被广泛用于中药质量控制及差异标志物的筛选[12]。GCA结果显示,78 批样品中,相对关联度为0.382~0.645,排前3位的S3、S7、S77样品均产自河北省承德市。各产地的平均相对关联度分别为河北省承德市0.538、辽宁省葫芦岛市0.528、山西省运城市0.462、山东省临沂市0.435,即药材质量优劣排序为河北省承德市、辽宁省葫芦岛市、山西省运城市、山东省临沂市样品。CA热图显示,78 批样品可分为2 类,河北省承德市和辽宁省葫芦岛市样品大致分为一类,山西省运城市和山东省临沂市样品大致分为一类;PCA 分类结果与聚类分析结果一致。笔者分析认为,分类结果可能与海拔、经纬度、光照、气候等药材生长环境因素有关。OPLS-DA 结果显示,峰1(绿原酸)、峰2、峰3(牡荆素葡萄糖苷)、峰5 的VIP 值均大于1,表明其对应成分可能是影响山楂叶药材质量的差异标志物,后续可对上述2个未知成分进行鉴定,有助于对药材进行全面质量控制和溯源。同时,本研究结果提示,在控制山楂叶药材质量时,可考虑增加含量较高的共有性成分(如牡荆素鼠李糖苷)和差异性成分(如牡荆素葡萄糖苷)作为检测指标,从而更科学、全面地评价不同产地山楂叶药材的品质。
3.3 含量测定结果分析
中药成分复杂,具有多成分、多靶点作用的特点,仅用单一成分无法全面表征其质量的优劣,而多成分检测因对照品不易获得、价格昂贵、溶液配制耗时等不足导致检测成本较高。山楂叶的主要有效成分为黄酮类化合物,牡荆素鼠李糖苷为山楂叶中含量较高的共有性成分[4―5],故本研究以该成分为内参物,同时测定了绿原酸、牡荆素葡萄糖苷、金丝桃苷和异槲皮素的含量。本研究结果显示,不同仪器、色谱柱、流速、柱温条件下,各成分相对校正因子的RSD 均小于2.5%;外标法与QAMS 法比较,除2 批样品(S39、S41)中异槲皮素含量的RD 值超过5%外,其余成分的测定结果均无明显差异,说明QAMS法可用于山楂叶药材中多种有效成分的含量测定。
综上,所建HPLC 指纹图谱结合QAMS 法操作简单,可用于山楂叶药材的质量评价;河北省承德市样品质量较优;绿原酸(峰1)、牡荆素葡萄糖苷(峰3)和峰2、5对应成分可能是影响山楂叶药材质量的差异标志物。

