芒柄花素对脂多糖诱导的肺泡上皮细胞凋亡及炎症反应的抑制作用Δ
林 海 ,易金容 ,饶运帷 (.赣南医学院第一附属医院呼吸与危重医学科,江西 赣州 34000;2.赣州市妇幼保健院麻醉科,江西 赣州 34000)
急性肺损伤是由于各种原因所致肺组织结构发生病理改变而引发的临床综合征,其病理改变包括肺泡上皮细胞和肺泡毛细血管内皮细胞损伤、广泛性肺水肿、肺不张、肺内分流增加、肺顺应性下降,临床可表现为急性、进行性、发作性呼吸困难,是一种临床较为常见的危重症。该病发病机制复杂,临床治疗以机械通气为主,但效果有限,使得患者的病死率居高不下[1―3]。可见,探寻新的急性肺损伤治疗方法及药物十分必要。
中医将急性肺损伤归为“结胸”“暴喘”“喘脱”等范畴,宜运用清热解毒、宣肺平喘、豁痰开窍、攻里通下等治法[4]。芒柄花素为黄酮类化合物,在黄芪、鸡血藤等多种中药中存在。研究指出,黄芪和鸡血藤具有清热解毒的功效,对急性肺损伤有一定的改善作用,其主要成分芒柄花素还具有一定的抗炎活性[5]。研究证实,芒柄花素可通过抗炎、抗氧化作用来减轻高氧介导的急性肺损伤,同时对脂多糖(lipopolysaccharide,LPS)诱导的急性肺损伤也有保护作用[6—7],但该成分上述作用的具体机制尚不明确。
磷脂酰肌醇3 激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)信号通路在细胞中广泛存在,是参与细胞生长、增殖、凋亡等生物学过程的重要信号通路。现有研究证实,PI3K/Akt与炎症的发生密切相关:Sun等[8]发现,大环内酯类抗菌药物可通过调节PI3K/Akt 信号通路来减轻肺癌和慢性阻塞性肺疾病的全身性炎症;Liu 等[9]发现,载脂蛋白酶和磷酸鞘氨醇复合物可通过PI3K/Akt 信号通路来减轻肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)诱导的内皮细胞损伤和炎症反应;另有研究指出,抑制PI3K/Akt 信号通路与减轻LPS 诱导的急性肺损伤相关[10]。基于此,本研究拟通过LPS诱导构建体外肺泡上皮细胞损伤模型,探究芒柄花素对其凋亡和炎症反应的影响及潜在机制,以期为深入研究该化合物用于急性肺损伤的防治提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括ZF-288 型凝胶成像系统(上海金鹏科技有限公司),BPN-40RHP 型CO2培养箱(上海一恒科学仪器有限公司),Multiskan Ascent型全自动酶标仪、NanoDrop One 型超微量分光光度计(美国Thermo Fisher Scientific 公司),DXS_3 型倒置荧光显微镜(上海缔伦光学仪器有限公司),DYCZ-24KF 型四板垂直蛋白电泳仪(北京六一生物科技有限公司),7500型实时荧光定量聚合酶链式反应(PCR)仪(美国ABI 公司)等。
1.2 主要药品与试剂
芒柄花素对照品(批号94334,纯度≥98%)购自美国Sigma 公司;LPS(批号J07HS174755,纯度≥98%)、LY294002 对照品(PI3K/Akt 非特异性通路抑制剂,批号J05GS150604,纯度≥98%)、SC79 对照品(PI3K/Akt 特异性通路激活剂,批号F08J11F115126,纯度≥98%)、1%青-链霉素双抗均购自上海源叶生物科技有限公司;胎牛血清(FBS)购自美国Gibco 公司;F-12K 培养基(批号20220617)、RIPA 裂解液均购自北京索莱宝科技有限公司;CCK-8 试剂盒、逆转录试剂盒、SYBR qPCR Master Mix 试剂(批号分别为C6205060、H2017011、H4001330)均购自翌圣生物科技(上海)股份有限公司;白细胞介素8(interleukin-8,IL-8)、TNF-α酶联免疫吸附测定(ELISA)试剂盒(批号分别为Mar2022、Feb2022)均购自北京睿信科技有限公司;Hoechst 33258 染色试剂盒(批号20220304)购自江苏凯基生物技术股份有限公司;鼠抗人PI3K、Akt、磷酸化Akt(phosphorylated Akt,p-Akt)、β-肌动蛋白(β-actin)单克隆抗体和辣根过氧化物酶标记的山羊抗鼠IgG 二抗(批号分别为10017175、10022173、10022023、10021787、20000425)均购自武汉三鹰生物技术有限公司;鼠抗人磷酸化PI3K(phosphorylated PI3K,p-PI3K)单克隆抗体(批号BJ07207167)购自上海沪震实业有限公司。
1.3 细胞株
肺癌人肺泡基底上皮细胞A549购自武汉普诺赛生命科技有限公司,于-80 ℃下冻存,备用。
2 方法
2.1 细胞培养
取冻存的A549 细胞,复苏后,接种于F-12K 培养基(含10%FBS、1%青-链霉素双抗)中,于37 ℃、5% CO2条件下培养、传代(密度>80%),取第4代且处于对数生长期的细胞用于实验。
2.2 细胞培养液中炎症因子水平的检测
取对数生长期细胞,分为对照组、模型组和芒柄花素不同浓度组(分别为LPS+6.25 组、LPS+12.5 组、LPS+25组、LPS+50组),每组设置3个复孔。对照组细胞不进行任何干预,模型组细胞加入1 μg/mL 的LPS 刺激24 h以构建体外肺泡上皮细胞损伤模型[11],芒柄花素不同浓度组细胞同时加入1 μg/mL 的LPS 和6.25、12.5、25、50 μmol/L 的芒柄花素(芒柄花素浓度参考相关文献[5]设置)。培养24 h后,收集各组细胞培养液,按相应试剂盒说明书方法操作,采用ELISA法以酶标仪测定其中炎症因子IL-8、TNF-α水平。
2.3 细胞活力的检测
2.4 基于PI3K/Akt信号通路的机制分析
2.4.1 IL-8、TNF-α分泌水平和mRNA表达水平的检测
取对数生长期细胞,分为对照组、模型组、芒柄花素组(LPS+25 组)、抑制剂组、芒柄花素+抑制剂组和芒柄花素+激活剂组,每组设置3 个复孔。对照组细胞不进行任何干预,模型组细胞加入1 μg/mL 的LPS 刺激24 h以构建体外肺泡上皮细胞损伤模型[11],LPS+25组细胞同时加入1 μg/mL 的LPS 和25 μmol/L 的芒柄花素(芒柄花素浓度参考“2.2”“2.3”项下结果设置,下同),抑制剂组细胞同时加入1 μg/mL 的LPS 和20 μmol/L 的PI3K/Akt 通路抑制剂LY294002(抑制剂浓度参考相关文献[12]设置,下同),芒柄花素+抑制剂组细胞同时加入1 μg/mL的LPS、25 μmol/L 的芒柄花素和20 μmol/L 的PI3K/Akt通路抑制剂LY294002,芒柄花素+激活剂组细胞同时加入1 μg/mL 的LPS、25 μmol/L 的芒柄花素和10 μmol/L的PI3K/Akt 通路激活剂SC79(激活剂浓度参考相关文献[13]设置)。培养24 h后,收集各组细胞培养液,按“2.2”项下ELISA 法检测其中炎症因子IL-8、TNF-α 水平,以表示其分泌水平。收集各组细胞,采用实时荧光定量PCR 法测定其中IL-8、TNF-α mRNA 表达水平,具体步骤为:提取各组细胞总RNA,以超微量分光光度计检测RNA的浓度及纯度,随后将其反转录成cDNA。以上述cDNA为模板进行PCR扩增。扩增体系包括cDNA模板1 μL(质量浓度为20 ng/μL),SYBR qPCR Master Mix 10 μL,上、下游引物(质量浓度均为10 μmol/L)各0.5 μL,ddH2O 8 μL。扩增条件包括:95 ℃预变性5 min;94 ℃变性30 s,58 ℃退火35 s,72 ℃延伸35 s,共40 个循环。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,采用2-ΔΔCt法检测目的基因的表达水平,结果以对照组为参照进行归一化处理。PCR引物序列及产物长度见表1。
2.4.2 细胞凋亡率的检测
取对数生长期细胞,按“2.4.1”项下方法分组、处理。培养24 h 后,收集各组细胞,以磷酸盐缓冲液洗涤5 min×2 次后,置于4 ℃的4%多聚甲醛中固定10 min。取出细胞,洗涤3 次,以5 mg/L 的Hoechst 33258 染液染色10 min;洗涤3 次,封片,使用荧光显微镜观察、拍照,并按下式计算细胞凋亡率:细胞凋亡率=凋亡细胞数/总细胞数×100%(凋亡细胞呈亮蓝色且染色不均,核固缩变小)。
2.4.3 细胞中PI3K/Akt信号通路关键蛋白表达的检测
取对数生长期细胞,按“2.4.1”项下方法分组、处理。培养24 h后,收集各组细胞,提取其蛋白,定量后经高温水浴变性。取变性蛋白适量,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜后封闭2 h;加入PI3K、Akt、p-Akt、p-PI3K、β-actin 一抗(稀释比例分别为1∶3 000、1∶10 000、1∶5 000、1∶1 000、1∶5 000),于4 ℃下孵育过夜;用TBST 缓冲液洗膜,加入相应IgG 二抗(稀释比例为1∶2 000),孵育2 h;用TBST缓冲液洗膜,显影后使用凝胶成像系统成像。使用Image J 1.8.0软件分析蛋白条带的灰度值,以目的蛋白与内参蛋白(β-actin)条带的灰度值比值作为目的蛋白的相对表达量。
2.5 统计学方法
采用SPSS 26.0 软件对数据进行统计分析,采用GraphPad Prism 8 软件作图。计量资料以xˉ±s表示,多组间比较采用单因素方差分析,进一步两两比较采用Dunnetts’t检验,检验水准α=0.05。
导入之后得到的数据示例如表2所示,需要注意的是,为了方便显示我们省略了一些属性。另外,KC是关于知识点的详细描述,所占篇幅较长,我们仅以SkillRule代替。
3 结果
3.1 芒柄花素对LPS 诱导的A549 细胞培养液中炎症因子的影响
与对照组比较,模型组细胞培养液中IL-8、TNF-α水平均显著升高(P<0.05);与模型组比较,LPS+12.5组、LPS+25 组、LPS+50 组细胞培养液中IL-8、TNF-α 水平均显著降低(P<0.05)。结果见图1。
3.2 芒柄花素对LPS诱导的A549细胞活力的影响
与对照组比较,模型组细胞活力显著降低(P<0.05);与模型组比较,LPS+25组细胞活力显著升高(P<0.05)。结果见图2。结合“3.1”项下结果,本研究最终选择对细胞活力有显著影响且有较好抑炎效果的25 μmol/L作为后续实验芒柄花素的干预浓度。
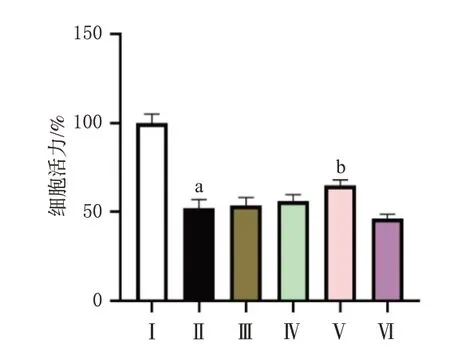
图2 芒柄花素对LPS 诱导的A549 细胞活力的影响(±s,n=3)
3.3 芒柄花素基于PI3K/Akt 信号通路对LPS 诱导的A549细胞相关指标的影响
3.3.1 芒柄花素对细胞炎症因子IL-8、TNF-α 分泌水平和mRNA表达水平的调控作用
与对照组比较,模型组细胞IL-8、TNF-α 的分泌水平和mRNA 表达水平均显著升高(P<0.05);与模型组比较,LPS+25 组和抑制剂组细胞IL-8、TNF-α 的分泌水平和mRNA 表达水平均显著降低(P<0.05);与LPS+25组比较,芒柄花素+抑制剂组细胞IL-8、TNF-α的分泌水平和mRNA 表达水平均显著降低(P<0.05),而芒柄花素+激活剂组细胞IL-8、TNF-α 的分泌水平和mRNA 表达水平均显著升高(P<0.05)。结果见图3。

图3 芒柄花素基于PI3K/Akt 信号通路对LPS 诱导的A549 细胞IL-8、TNF-α 分泌水平和mRNA 表达水平的影响(±s,n=3)
3.3.2 芒柄花素对细胞凋亡的影响
与对照组比较,模型组细胞凋亡率显著升高(P<0.05);与模型组比较,LPS+25组和抑制剂组细胞凋亡率均显著降低(P<0.05);与LPS+25组比较,芒柄花素+抑制剂组细胞凋亡率显著降低(P<0.05),而芒柄花素+激活剂组细胞凋亡率显著升高(P<0.05)。结果见图4。
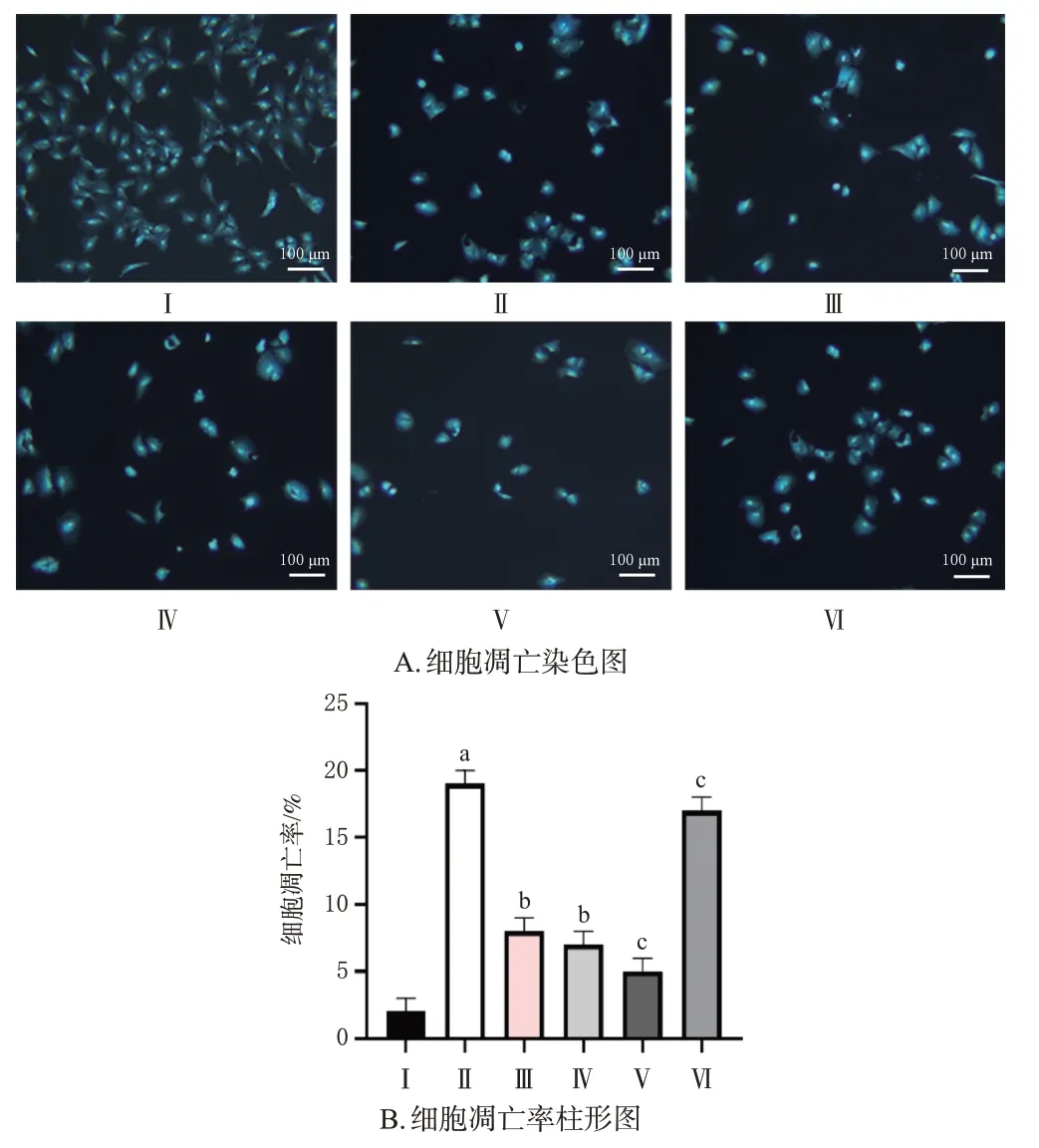
图4 芒柄花素基于PI3K/Akt 信号通路对LPS 诱导的A549细胞凋亡的影响(±s,n=3)
3.3.3 芒柄花素对PI3K/Akt 信号通路关键蛋白表达的影响
与对照组比较,模型组细胞中p-Akt、p-PI3K蛋白的相对表达量均显著升高(P<0.05);与模型组比较,LPS+25 组和抑制剂组细胞中p-Akt、p-PI3K 蛋白的相对表达量均显著降低(P<0.05);与LPS+25组比较,芒柄花素+抑制剂组细胞中p-Akt、p-PI3K 的相对表达量均显著降低,而芒柄花素+激活剂组细胞中p-Akt、p-PI3K 的相对表达量均显著升高(P<0.05)。结果见图5。

图5 芒柄花素对LPS诱导的A549细胞PI3K/Akt信号通路关键蛋白表达的影响(±s,n=3)
4 讨论
急性肺损伤是多种炎症介质、免疫细胞共同参与的病理过程,由创伤、感染、烧伤及休克等多种因素引发,具有较高的发病率及病死率[14]。由于现有治疗手段效果有限,故挖掘新的有效治疗药物备受研究者关注。
本研究首先以LPS诱导A549细胞构建体外肺泡上皮细胞损伤模型,结果发现,与对照组比较,模型组细胞的炎症因子(IL-8、TNF-α)分泌显著增多,细胞活力显著下降,说明LPS 能促进A549 细胞炎症因子释放并抑制细胞活力,体外急性损伤细胞模型构建成功。
中医药对改善急性肺损伤具有积极作用,这种作用可能是通过干预细胞信号转导、炎症介质释放、免疫细胞活化等多途径而实现的。芒柄花素是一种异黄酮类化合物,作为黄芪、鸡血藤等多种中药的活性黄酮类成分,其具有抗肿瘤、清除自由基、抗炎和改善雌激素水平等药理活性[5―7],但其对LPS致急性肺损伤的作用机制尚不明确。基于此,本研究进一步以不同浓度的芒柄花素干预LPS 诱导的A549 细胞,结果发现,25 μmol/L 的芒柄花素可使模型细胞活力显著升高,炎症因子IL-8、TNF-α 的分泌水平显著降低,提示25 μmol/L 的芒柄花素缓解LPS致细胞损伤的效果较好,因此将该浓度作为后续实验芒柄花素的干预浓度。后续实验发现,LPS+25组细胞IL-8、TNF-α 的分泌水平和mRNA 表达水平、细胞凋亡率均较模型组显著降低,提示芒柄花素能明显抑制LPS诱导的A549细胞凋亡并缓解炎症反应。以上结果表明,芒柄花素能改善LPS引起的A549细胞损伤,具有一定的抗炎、抗凋亡作用。
PI3K/Akt信号通路是一条重要的信号转导通路,可在细胞分化、凋亡、增殖、迁移等多种生物过程中发挥作用[15]。Liang等[16]研究发现,右美托咪定可改善大鼠肺缺血再灌注引起的肺损伤,这种作用可能是通过激活PI3K/Akt 信号通路来实现的;Wang 等[17]研究发现,骨髓细胞2 上表达的受体可通过PI3K/Akt 信号通路来改善阿尔茨海默病模型小鼠神经炎症反应和认知障碍。PI3K和Akt蛋白是PI3K/Akt信号通路的关键蛋白,可参与LPS诱导的急性肺损伤,并可抑制氧化应激介导的细胞凋亡和自噬,故该信号通路成为急性肺损伤研究的关键靶点[15]。本研究结果显示,模型组细胞中p-Akt、p-PI3K蛋白的相对表达量均较对照组显著上调,提示LPS诱导能够激活细胞的PI3K/Akt 信号通路;LPS+25 组和抑制剂组细胞中p-Akt、p-PI3K 蛋白的相对表达量均较模型组显著下调,提示芒柄花素和非特异性通路抑制剂LY294002均能抑制细胞的PI3K/Akt信号通路。
为阐释芒柄花素对LPS致A549细胞炎症和凋亡的抑制作用机制,本研究同时以芒柄花素和非特异性通路抑制剂LY294002对LPS诱导的A549细胞进行干预(为排除LY294002 对其他蛋白的抑制作用,本研究同时设置了单独的抑制剂组),结果显示,芒柄花素+抑制剂组细胞中IL-8、TNF-α 的分泌水平和mRNA 表达水平,细胞凋亡率,p-Akt、p-PI3K蛋白的相对表达量均显著低于LPS+25 组。为进一步反向验证该作用机制,本研究还以芒柄花素和特异性通路激活剂SC79 对LPS 诱导的A549 细胞进行干预,结果显示,芒柄花素+激活剂组细胞中上述指标的改变受到逆转。这提示芒柄花素可通过抑制PI3K/Akt信号通路来发挥对LPS诱导的A549细胞炎症和凋亡的改善作用。
综上所述,芒柄花素能够抑制LPS诱导的肺泡上皮细胞凋亡并改善其炎症反应,上述作用与抑制PI3K/Akt信号通路有关。但该成分能否通过其他信号通路发挥对急性肺损伤的改善作用尚未可知,有待进一步探究。

