影响鸡传染性病毒性腺胃炎人工发病模型建立的关键因素探讨
李 秀,廖申权,孙铭飞,刘菊枚,林俊伟,李旭华,许文城,吕敏娜,吴彩艳,李 娟,蔡海明,林栩慧,胡俊菁,于林增,肖文婉,张小慧,张健騑,戚南山,李国清
(1.广东省农业科学院动物卫生研究所 岭南现代农业科学与技术广东省实验室茂名分中心 农业农村部兽用药物与诊断技术广东科学观测实验站 广东省畜禽疫病防治研究重点实验室,广州 510640;2.华南农业大学兽医学院,广州 510642;3.揭阳市动物卫生监督所,揭阳 522000;4.普宁市动物卫生监督所,揭阳 522000)
鸡传染性病毒性腺胃炎(Transmissible viral proventriculitis,TVP)是一种由病毒感染引起的慢性消耗性消化道疾病,其具有较强传染性,可导致典型腺胃炎症状[1]。多发于雏鸡,以发育不良、生长迟缓、粪便过料为主要特征[2]。鸡群一旦发病,发病初期表现为缩头垂尾、羽毛蓬松、精神沉郁、挑食甩料;中后期,病鸡体型消瘦明显、腹泻、所排粪便中掺杂未消化的饲料;发病严重的鸡则会出现全身苍白,最终衰竭而亡。剖检可见腺胃肿大如球形,呈乳白色,触摸坚硬,腺胃壁水肿、增厚,腺胃乳头肿胀、出血、溃疡等病理变化,病理切片可见大量炎性细胞浸润腺胃组织、导管上皮细胞增生变性、抗氧化细胞坏死等病理变化[3]。近年来,随着集约化和规模化养鸡业的飞速发展,TVP的发生呈逐年上升趋势,成为肉鸡产业的巨大难题,严重危害养鸡业的健康发展。
引起TVP的病因比较复杂,至今国内外学者和专家对此病的致病因素尚无确切定论,其致病原因主要包括非传染性因素和传染性因素,其中非传染性因素包括:生物胺(劣质鱼粉、变质饼粕)、硫酸铜过量、饲料霉变及应激等;传染性因素包括:传染性支气管炎病毒(Infectious bronchitis virus,IBV)、禽白血病病毒(Avian leukosis virus,ALV)、马立克氏病毒(Marek’s disease virus,MDV) 、传染性法氏囊病毒(Infectious bursal disease virus,IBDV)、腺胃坏死病毒(Chicken proventricular necrosis virus,CPNV)、鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)、网状内皮增生症病毒(Reticuloendotheliosis virus,REV)、圆圈病毒3型(Gyrovirus 3,GyV3)和呼肠孤病毒(Reovirus,ReoV)等。建立人工发病模型是研究TVP发病机制及筛选有效防控剂的重要手段。尽管从患病鸡的腺胃中分离到许多病毒,但往往在回归动物时都不能很好的复制出病例。因而截至目前尚无有效、稳定、重复性好的标准TVP动物发病模型,使得TVP的防控面临巨大挑战。
为进一步深入了解TVP,以研究有效的防控方案,本文主要针对诱导TVP发病的主要传染性病原因素,归纳近年来关于TVP致病病原方面的研究,总结主要的传染性病毒性致病病原,根据当前已建立的TVP动物发病模型,分析影响TVP人工发病模型建立的主要因素,探讨TVP动物模型建立的规律及筛选优化最适的建模方法,以期为TVP的实验室研究及综合防控奠定理论基础。
1 鸡传染性病毒性腺胃炎的概况
1.1 流行情况TVP在世界范围内均有发生,Kouwenhoven等[4]于1978年根据荷兰患病鸡生长缓慢、饲料转化率低、腺胃肿胀等主要临床特点,首次提出鸡传染性病毒性腺胃炎。而后,该病在美国、英国、波兰、法国等国家陆续被报道。国内朱国强等[5]首次报道在江苏发现传染性腺胃炎后,该病在国内呈大范围流行,浙江省、北京省、山东省、天津省等地均有发生。
1.2 流行特点TVP无明显季节性,但在季节交替时发病率增高。不同日龄、不同品种的蛋鸡和肉鸡均可感染发病,商品肉鸡为多发群体[6]。该病的发病日龄不定,最早发病日龄可见3日龄,10~50日龄为多发期。该病的病程为10~15 d,发病5~10 d后可到达死亡高峰期,若继发感染其他病毒,死亡率则会明显上升[7]。
2 鸡传染性病毒性腺胃炎的传染性致病因素
2.1 传染性支气管炎病毒IBV属于冠状病毒科、冠状病毒属,该病毒颗粒呈球状,有囊膜及许多呈放射状排列的梨状纤突。根据临床病型可将传染性支气管炎病毒分为呼吸型传染性支气管病毒、肠型传染性支气管炎病毒和肾型传染性支气管炎病毒。然而,国内专家学者认为引起TVP的传染性支气管炎病毒可能存在突变,即新型的腺胃型传染性支气管炎病毒。周继勇等[8-9]通过鸡胚传代、血凝性测定、电镜检测、PCR鉴定及动物回归等方法,从浙江省、黑龙江省等地患腺胃炎的病鸡组织中分离到多株不同基因型的IBV,认为它们是一种新型的IBV或与IBV存在密切关联。这表明IBV变异株与该病有所联系,但国内流行的TVP是否由IBV变异株引起尚未确定,仍需进一步研究证明。
2.2 传染性法氏囊病毒IBDV作为双RNA病毒科、禽双RNA病毒属的典型代表,该病毒颗粒呈二十面体立体对称的球形,无囊膜,仅由核酸和衣壳组成。2003年,Pantin-Jackwood等[10]对7只自然发病和人工感染的鸡进行检测后,发现IBDV主要影响鸡的免疫系统,并不能直接引起腺胃炎和腺胃细胞凋亡。但其于2005年将患TVP的病鸡腺胃,进行匀浆处理后口服接种SPF鸡后,成功复制出TVP病例,并在感染发病鸡体内检测到IBDV[11]。Grau-Roma等[12]直接从表现为腺胃轻微肿大的发病鸡中分离到1株形态类似IBDV的病毒,并经过超微结构检测及免疫组化,认为该病毒是引起传染性腺胃炎的病因。虽然TVP病例中IBDV的检出率越来越高的迹象表明IBDV与TVP存在一定的关联,但IBDV是否是引起TVP的病因尚未定论。
2.3 腺胃坏死病毒Guy等[13]在2007年将首次从病鸡的体内分离到的CPNV,接种商品肉鸡和SPF鸡后,发现感染鸡出现腺胃显著膨大的症状,即成功复制出该病的发病模型;且通过免疫组化检测,发现病鸡体内存在CPNV。而后,Guy等[14-15]通过实验分析均初步认为CPNV属于双链RNA病毒科、Birnacirus病毒属;然而,通过对CPNV进行核酸检测和抗原分析,发现CPNV与Birnacirus病毒属病毒的基因和抗原性不同;因此,CPNV可能是一名尚未分类的双链RNA病毒科新成员。Noiva等[16-17]分别在美国、法国等通过RT-PCR方法检测,结果均呈CPNV阳性,进一步证明该病毒与传染性病毒性腺胃炎密切相关,并猜测CPNV是引起TVP的最主要病原,但在我国流行的TVP是否由CPNV引起,尚未见报道。
2.4 网状内皮增生症病毒REV是反转录科、正反转录病毒亚科、γ反转录病毒属的一员,病毒呈球形,有壳粒和囊膜。杜元钊等[18]将从患病鸡腺胃组织中分离到的1株REV接种细胞培养物,收集细胞培养物接种1日龄雏鸡,成功的复制出TVP。孙洪磊等[19]对山东某鸡场发病鸡进行间接免疫荧光原位病原检测和ELISA方法检测抗体,证明该病与REV联系紧密。李彬等[20]通过长期的流行病学和实验室研究后,认为我国流行的TVP的病因是REV。
国外资料也有报道,使用REV污染的马立克疫苗可导致腺胃炎[21]。也再次说明REV与该病关系紧密,但目前国内流行的TVP病原是否与REV相关,还需进一步研究。
2.5 圆圈病毒3型Li等[22]首次从患传染性腺胃炎的病鸡中分离到1株GyV3病毒,并在回顾性流行病学调查中发现,在正常鸡中未检测到GyV3,而在患TVP的病鸡中检出率高。这说明GyV3与TVP密切相关,但其确切关系及发病机制有待进一步研究。
2.6 其他病原从患腺胃炎的病鸡腺胃中还分离出很多其他病毒,如禽白血病病毒、呼肠孤病毒、鸡传染性贫血病毒等,这些病毒与传染性腺胃炎的致病关系有待进一步研究。孙淑红等[23]报道将患TVP的病鸡腺胃接种鸡胚成纤维细胞后,通过单克隆抗体间接免疫荧光试验检测,得知病鸡均能分离到ALV-J,其中还有4只共感染了REV。该研究虽不能证明ALV-J是导致腺胃炎的病因之一,但从另一个侧面说明腺胃炎病原的多样性及TVP的病因复杂。
目前,临床上关于TVP的研究文献中主要检测或分离到的多是单一病原,而病原混合感染的相关文献极少。但这并不能证明TVP是由一种病毒引起,可能仍是由多种病毒综合作用引起。因而,TVP混合感染情况有待进一步研究。
3 鸡传染性病毒性腺胃炎人工发病模型建立的关键因素
3.1 病原目前,在本文综述的传染性致病因素中,尚无明确证据表明这些病毒能对TVP的发生起决定性作用[24]。其中大部分病毒可引发机体的免疫抑制,只是一类辅助病因,有研究表明鸡出现TVP症状后,鸡体内的免疫器官发生萎缩,导致机体免疫功能下降,严重时甚至会完全丧失[25]。但国外专家认为CPNV与TVP关系密切,并猜测CPNV是引起TVP的最主要病原。
3.2 病毒毒株制备方法病毒的制备是能否成功构建动物模型的重要因素,在有纯病毒株的条件下,则可直接选用病毒株感染构建动物模型。但若没有纯病毒株则需要自行制备病毒悬液,方法一:将含有青霉素(1 μL/mL)和硫酸链霉素(0.1 mg/mL)的无菌PBS与病鸡腺胃按5∶1的比例进行研磨破碎,在反复冻融3次后,进行差速离心(9000 ×g离心10 min、12000 ×g离心10 min)取上清液,分别依次通过0.45 μm、0.2 μm滤器过滤除菌后即可使用[26];方法二:将腺胃与DMEM培养基按1∶10的比例进行研磨破碎制成组织匀浆,经3000 ×g离心10 min后,取上清液分别依次通过0.45 μm和0.2 μm的滤器,将滤液与氯仿制成10%的混合液,室温下在摇床震荡20 min,经2000 ×g离心10 min后收集上清液,-80℃保存备用[27]。
3.3 病毒接种方式接种试验动物时,普遍采用的病毒接种方式分两类。一类接种方式是单独接种,通过点眼、滴鼻或口服等接种途径分别对实验动物进行感染,即将EID50为10-5/0.2 mL~10-6/0.2 mL病毒液用PBS10倍稀释后经点眼、滴鼻、口服等途径分别接种鸡群,或将制备好的组织悬液通过点眼、滴鼻等途径感染鸡群。另一类接种方式是混合接种,通过点眼、滴鼻联合肌肉注射,或口服联合腹腔注射[26]接种的方式,即将制备好的组织悬液通过肌肉注射0.2 mL和点眼、滴鼻、口服各0.1 mL的方式感染鸡群,或将EID50为10-5/0.2 mL~10-6/0.2 mL病毒液1 mL通过口服、腹腔接种鸡群。
3.4 实验动物因素研究表明,可引起TVP的传染性致病因素中大多数可以造成鸡本身的免疫抑制,由此可见发生免疫抑制的鸡更容易发生TVP,因此为排除种蛋传播、母源抗体及疫苗因素的影响,选用无特定病原体鸡(SPF鸡)作为实验动物。不同日龄的鸡对于TVP的发病率也存在较大差异,雏鸡更易感染发病,因此建议选用8日龄以内的雏鸡作为实验动物。
4 鸡传染性病毒性腺胃炎动物发病模型的评分系统
在构建TVP动物发病模型时,对TVP病变进行评分是确定发病模型是否成功构建的关键,TVP的病变大体呈现为腺胃轻度肿胀、外表面有斑块(图1B),腺胃中度增大、峡部扩张明显(图1C),腺胃异常肿大(图1D)。参考文献[28]中的腺胃病变评分系统(表1)对实验动物腺胃进行肉眼检测评估。

图1 腺胃大体剖检病变Fig.1 Classification of gross lesion in chicken proventriculi

表1 鸡传染性病毒性腺胃炎大体病变评分表Table 1 General pathological score table of transmissible viral proventriculitis
组织病理学病变呈现为炎性细胞浸润腺胃组织、导管上皮细胞增生变性或抗氧化细胞坏死的现象。参考文献[29]中的腺胃病变评分系统对实验动物腺胃进行组织病理学检测评估为0~3分制,其评分细则见图2和表2。
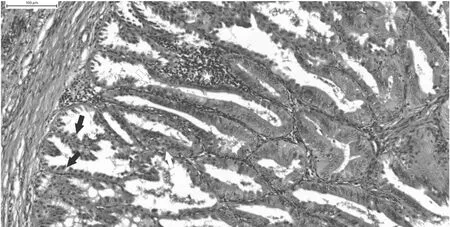
图2 发病鸡组织学病变[29]Fig.2 Histological changes in diseased chickens

表2 鸡传染性病毒性腺胃炎组织病理学病变评分表Table 2 Histopathological score table of transmissible viral proventriculitis
5 优化鸡传染性病毒性腺胃炎动物模型建立方法
TVP是一种由单一或多种病毒混合感染引起的慢性消耗性消化道疫病,在实验中可通过人为控制单一病毒感染或多病毒感染来调控动物发病后产生症状的严重程度。
在构建TVP发病模型时,需选取1日龄SPF鸡作为实验动物。对鸡群进行疫病诱导感染的方式和途径有两种:一是使用仅含有CPNV的病毒液通过口服、点眼、滴鼻或其他联合感染的方式(实验证明口服攻毒的途径最为快捷有效,口服联合腹腔注射的方式相较单一口服效果更明显)进行攻毒感染鸡群;二是使用免疫抑制性病毒如CIAV、MDV、IBDV等病毒联合CPNV共同感染鸡群,加重疫病的严重程度,但可造成免疫抑制的病毒本身也是TVP传染性致病因素之一,可根据实验目的选用。
6 小结及展望
综上所述,由于TVP病因复杂,目前国内外学者对此病的致病因素至今尚无确切定论,由此导致后续一系列进展缓慢,尤其缺乏有效、可重复的实验动物发病模型,使得TVP的防控面临巨大挑战。因此,本文总结了构建TVP发病模型需注意的关键因素及人工造模常见的方法,进一步优化TVP动物模型建立的方法,并归纳TVP的病变评分系统,以期为进一步科学防控TVP提供理论参考。

