甲型流感病毒反向遗传操作系统研究进展
杨 景,郭锦玥,黄淑坚,温 峰
(佛山科学技术学院生命科学与工程学院,佛山 528225)
禽流感是由隶属于甲型流感病毒(Influenza A virus,IAV)属的禽流感病毒引起的一种急性传染病,是目前对我国家禽养殖业危害最大的疫病之一。IAV属于正粘病毒科,其基因组包括8个分节段的单股负链RNA[1],极易发生变异。水禽被认为是IAV的自然宿主,但IAV宿主广泛,共生情况复杂,可感染多种哺乳动物及人类。IAV不仅危害家禽养殖业,还对公共卫生造成严重威胁。自上世纪以来,全球共发生过四次流感大流行[2]。H1N1及H3N2亚型IAV已适应人类并引起季节性流行[3],而H5N1、H5N6、H7N9及H5N8等亚型高致病性禽流感病毒也被报道能够跨种传播感染人类[4]。
IAV长期危害全球养殖业及人类健康,引起人们高度重视。自1989年Luytjes等[5]首次拯救出含荧光报告基因的嵌合流感病毒以来,流感病毒反向遗传操作系统已经历12质粒法、17质粒法、8质粒法、4质粒法、单质粒法及无质粒法等技术上的发展。这项技术不仅能够帮助我们研究IAV的致病机理和分子特征,还极大地推动了疫苗研制的发展。反向遗传操作系统体外拯救IAV技术的开发离不开对IAV的整个生命周期的深入了解。本文对IAV的基本特征、研究进展和IAV反向遗传操作系统的发展过程及原理展开概述。
1 甲型流感病毒概述
1.1 IAV基本特征IAV根据其表面膜糖蛋白血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)抗原性的不同可将其分为不同的亚型。到目前为止已有18种HA亚型和11种NA亚型,其中H17N10和H18N11在蝙蝠体内被发现[6-7]。
流感病毒根据其核蛋白(nucleoprotein,NP)和基质蛋白(Matrix,M1)的抗原性可将其分为甲、乙、丙、丁四型。乙型和丙型流感病毒主要感染人类,其中乙型流感病毒是导致季节性流感的重要元凶[3],而丙型流感病毒在成年人致病性弱,但能够导致儿童较严重的呼吸道疾病[8]。丁型流感病毒目前被发现主要感染牛和猪等哺乳动物[9]。目前危害较大、研究较多的是IAV和乙型流感病毒。
1.2 IAV的生命周期IAV感染宿主细胞过程中,首先通过其表面糖蛋白HA识别并结合宿主体内的唾液酸受体(如α-2,3及α-2,6唾液酸受体)。在宿主细胞蛋白酶作用下,HA蛋白前体水解成HA1和HA2。病毒内吞作用形成胞内体,在胞内体酸性环境下,HA2蛋白变构介导膜融合[10]。此时M2离子通道打开,病毒核糖核蛋白(viral ribonucleoprotein,vRNP)复合物通过M1基质蛋白释放进入宿主细胞,随后进入细胞核进行转录[11]。
IAV在体内复制过程中,先依赖聚合酶蛋白复合体(PB2蛋白帮助结合宿主mRNA,PA蛋白切割宿主mRNA前体成为小片段引物,PB1蛋白催化转录)由负链的RNA转录成正链mRNA[12],随后mRNA转移到细胞质中进行蛋白的翻译。后期主要以正链RNA为模板,进行子代vRNA的合成。
IAV在宿主细胞增殖的后期是组装、出芽和释放。合成的子代vRNA与聚合酶蛋白复合体(PB2、PB1、PA)以及NP蛋白形成vRNP后,与M1及NS2蛋白形成复合体,一起转移至组装位点,M1蛋白负责招募各组装成分。此外M1蛋白还与膜蛋白HA、NA的胞内段结合来装配病毒的蛋白质外壳。各蛋白相互协作,组装成完整的病毒颗粒。随后M1、M2、HA、NA蛋白共同完成病毒的出芽过程。子代病毒的释放依赖NA蛋白,NA酶活性位点能够催化水解细胞膜表面的唾液酸受体,防止子代病毒聚集[13]。
总之,IAV基因组各片段及蛋白组分在其增殖过程中都是不可或缺的,因此IAV的反向遗传操作系统要求转染其基因组的全部八个片段,增加了病毒拯救的难度。
1.3 IAV的危害及应对措施我国作为养殖大国,长期受到IAV的巨大的危害。首先,家禽及家畜本身会感染各种亚型的IAV,2015—2018年,我国发生近50起H5亚型禽流感疫情[14],大批病禽被扑杀,造成了严重的经济损失。养殖人员也面临着感染H5、H7等人畜共患亚型IAV的风险。2013—2018年,仅H7N9 IAV就导致我国1567例人感染,且死亡率高达39%(https://www.who.int/csr/don/05-september-2018-ah7n9-china/en/)。据报道目前已经有14种亚型的IAV可以感染人类[15],但没有确切的证据证明某些亚型(如H9N2等)可以在人与人之间传播,这些亚型IAV的跨种传播机制仍需我们进一步探究。
目前最有效的防控方法是注射疫苗,但IAV极易发生变异。当抗原性发生新的变化时,接种过疫苗的宿主也将不能产生有效的保护性抗体。为了应对新亚型IAV的大流行和季节性流行,研究IAV的致病机制及研制新型疫苗是十分必要的。反向遗传操作系统是研究IAV致病机制的有力工具。人为地在IAV某片段引入突变,通过反向遗传技术拯救出突变株[16],能够对IAV基因序列中的相关功能位点的生物学功能有更透彻的认知,有助于阐明各种亚型IAV的跨种传播机制和致病机理。IAV疫苗的研制也通常需要采用反向遗传操作系统,一般是将鸡胚高产毒株的内部骨架基因和流行株的HA、NA片段重组,再通过反向遗传来拯救重组疫苗株[17]。
2 IAV反向遗传操作系统
2.1 RNA病毒反向遗传操作系统与传统的遗传学研究方法不同的是,反向遗传操作系统是一种从基因型到表型的研究方法。它的目的是通过克隆一个病毒完整的基因组从而拯救出完整的病毒粒子,因此需要我们对病毒的完整生命周期有一个充分的了解。对于正链RNA病毒,只需将其基因组导入到宿主细胞即可进行蛋白质的表达。骨髓灰质炎病毒反向遗传操作系统于1981年创建,是首个被拯救的正链RNA病毒[18]。
对于负链RNA病毒,其基因组需要先转录成正链RNA才能被翻译成蛋白质,且负链RNA病毒的转录必须要有与其相关的蛋白质参与。因此负链RNA病毒的拯救不仅需要提供包含完整基因组的转录质粒,还要提供负责编码转录所需蛋白的表达质粒。1994年,狂犬病病毒的反向遗传操作系统被创建,是首个被拯救的负链RNA病毒[19]。
2.2 IAV反向遗传操作系统发展过程及原理
2.2.1 辅助病毒法 辅助病毒法都需要依赖额外感染的辅助流感病毒。一种是先在体外将纯化后的PB2、PB1、PA、NP蛋白与病毒vRNA组装成vRNP,转染细胞,经包装合成子代病毒。1989年,Luytjes等[5]采用这种方法将甲型流感病毒NS基因编码序列替换为氯霉素-乙酰转移酶报告基因的质粒DNA,拯救出重组流感病毒。另一种是将含RNA聚合酶Ⅰ(polⅠ)启动子、终止子以及待拯救的IAV质粒转染进细胞,然后辅助病毒感染,提供包装子代病毒所需的蛋白[20-21]。
2.2.2 12质粒及17质粒系统 Neumann等[22]创建了一种可以完全依赖质粒产生子代病毒的方法。将流感病毒8个片段的质粒和NP、PB2、PB1、PA蛋白的4个表达质粒转染293T细胞,IAV 8个片段的质粒由人RNA polⅠ启动子和小鼠RNA polⅠ终止子驱动,NP和三种聚合酶蛋白由鸡β肌动蛋白启动子驱动。该方法能在转染后48 h产生大于103PFU/mL的病毒粒子。当流感病毒8个片段的质粒和所有蛋白表达质粒(17质粒)同时转染293T细胞时,能产生高达3×104~5×107PFU/mL病毒粒子。虽然17质粒法能拯救出大量的病毒粒子,但操作复杂,且同时转染质粒数量太多,对所转染的细胞系要求也很高,目前很少使用。
2.2.3 8质粒系统 目前较为常用的方法是8质粒法。该系统最早由Hoffmann等[23]创建,通过构建一种双向表达载体,同时由RNA polⅠ和RNA polⅡ驱动。RNA polⅠ系统负责合成负链的子代vRNA,RNA polⅡ系统负责合成正链的mRNA,从而能直接表达出蛋白。RNA pol Ⅱ系统由人类巨细胞病毒(Cytomegalovirus,CMV)启动子序列和编码牛生长激素基因的多聚腺苷酸信号组成。该方法只需要用到分子克隆和细胞转染等实验步骤,操作更为简便,所需转染的质粒更少,对转染采用的细胞系的要求也有所降低。
2.2.4 4质粒、单质粒及无需质粒系统 随着IAV反向遗传操作系统的发展,越来越多的研究致力于减少转染时所需的质粒数量。2005年,Neumann等[24]又建立了4质粒反向遗传操作系统,将疫苗株的内部骨架和流行株的HA、NA片段分别克隆到两个由RNA polⅠ系统驱动的载体上,另外两个载体分别表达3个聚合酶蛋白(PB2、PB1、PA)和NP,由RNA polⅡ系统驱动。这种方法的优点是,当有新流行株出现时,只需要克隆流行株的HA、NA片段就能快速地拯救病毒,从而加快疫苗生产过程。
Zhang等[25]的研究尝试利用沙门菌的穿梭质粒将IAV的8个片段转入细胞。由于单个菌体难以容纳多个质粒片段,他们先开发了一种单质粒双向表达系统。IAV的8个片段克隆到同一个载体上,由鸡的RNA pol Ⅰ和CMV启动子双向启动。该载体同时插入了表达增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的荧光标记基因,能在病毒成功被拯救之后显示出绿色荧光。对于H9N2等一些细胞病变不明显的IAV也能便捷直观的判断病毒拯救的结果。
通过转染质粒拯救流感病毒始终需要先进行分子克隆等操作,转染较多数量的质粒会加大转染时的操作难度,而将所有片段克隆到同一个载体上难免会使分子克隆过程变得复杂繁琐。Chen等[26]尝试采用PCR扩增产物替代质粒来转染细胞,待转染的流感病毒8个片段通过重叠PCR被组装到含有polⅠ启动子和t1终止信号的反向遗传系统上,在部分替代和完全不采用质粒的情况下,均成功拯救出子代流感病毒。
2.2.5 基本原理 以上各种方法,不论是依赖辅助病毒还是完全依赖质粒,或是只转染PCR产物,它们的本质都是在模仿流感病毒增殖过程。IAV反向遗传操作系统首先需要具备IAV的8个片段,通常由RNA polⅠ系统驱动进行子代vRNA的复制,RNA polⅠ系统的转录位点定位于真核细胞的细胞核,非常适用于在细胞核中转录的IAV。尽管RNA polⅠ系统具有宿主特异性,但目前已有研究表明人类RNA polⅠ系统能允许流感病毒在犬肾(MDCK)细胞非洲绿猴肾(Vero)细胞等细胞系被拯救[27]。Song等[28]利用Vero细胞RNA polⅠ系统在Vero细胞中拯救IAV的效率比人类RNA polⅠ系统在人类胚胎肾(293T)细胞中高。除RNA polⅠ系统外,也可以采用T7 RNA聚合酶-丁型肝炎病毒核酶系统驱动vRNA复制,该系统没有宿主特异性[29],允许IAV在多种动物细胞系被拯救。T7 RNA聚合酶-丁型肝炎病毒核酶系统也被用于轮状病毒的拯救,在拯救轮状病毒时,除了需要转染其基因组11个质粒外,还需表达提高病毒拯救效率的蛋白[30]。
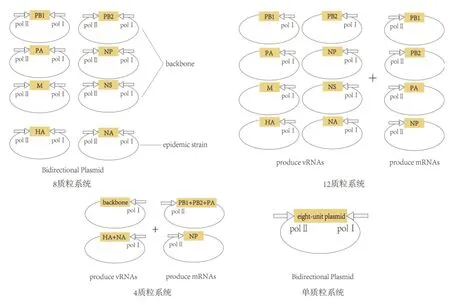
图1 IAV反向遗传操作系统Fig.1 Reverse genetic operating system of IAV
IAV作为负链RNA病毒需要进行转录后才能翻译成蛋白质,IAV的转录需要由NP和三种聚合酶蛋白来驱动,因此转染时需要同时转染这四种蛋白质,或是由RNA polⅡ系统驱动合成正链mRNA来表达蛋白[31]。所转染的IAV片段必须包含5'端、3'端和编码区的包装信号,使得8个片段能被包装进病毒蛋白质外壳合成子代病毒粒子[32]。此外,在包装信号之间插入的外源基因也能表达出蛋白并被包装进子代病毒[5]。
3 展望
从IAV反向遗传操作系统的初步建立至今已有三十年,它是我们研究IAV的一个非常便利的平台。除了应用于研究病毒的致病机理以及研制新型IAV疫苗,我们还可以利用它来拯救并研究未能从动物体内分离的IAV亚型-H17N10和H18N11[29],甚至能够通过基因重组来探究其生物学特性[33]。然而IAV的跨种传播机制仍不清楚,目前IAV的溶瘤作用已被发掘,但未能成熟应用于抗肿瘤治疗[34],反向遗传操作系统将是便捷有力的工具。
鉴于在IAV基因包装信号间插入外源基因能成功表达外源蛋白,重组流感病毒已经作为一种重组疫苗载体被开发[35]。那么对于一些基因组较大而不能通过反向遗传操作系统来拯救的病毒(如非洲猪瘟病毒等)的疫苗研制,可以将其抗原性较强的蛋白基因序列克隆到流感病毒载体上进行反向遗传表达蛋白。总的来说,IAV反向遗传操作系统不仅改变了IAV的研究方式,还为其他疫病的疫苗研制开拓了新思路。
IAV反向遗传操作系统有着越来越广泛的应用需求,更高效的操作技术是必要的。一种新型的环状聚合酶延伸克隆(circular polymerase extension cloning,CPEC)技术能快速将IAV基因组克隆到双向表达载体,整个克隆过程只需采用反转录和CPECPCR[36],缩短了拯救病毒的时间。遗憾的是IAV作为负链RNA病毒,其反向遗传操作始终无法像正链RNA病毒那样简便[37],期待未来能开发新的表达系统,建立更高效的IAV反向遗传操作平台。

