基于UPLC-Q-TOF-MS的凉粉草不同栽培品系代谢物分析
曾丽珊,尤健开,王艳鸽,夏艺萌,林颖,詹若挺,张桂芳(1.广州中医药大学中药学院中药资源科学与工程研究中心,广东 广州 510006;2.广州中医药大学岭南中药资源教育部重点实验室,广东 广州 510006;.广州中医药大学中药学院,广东 广州 510006)
凉粉草(MesonachinensisBenth.),别名仙草、薪草等,为唇形科凉粉草属植物,是岭南地区重要的药食两用植物资源,也是中国及东南亚的重要经济作物之一,广泛用于凉茶及功能饮料的生产,市场需求量大[1-2]。凉粉草在福建、广东、广西和台湾等地有悠久的栽培和使用历史,种植面积大,长期无性繁殖使得病害逐代传递,品系退化,产量与品质下降。凉粉草野生资源匮乏,经系统选育的品系少,现有的栽培品系通常以产地和植株形态特征来区分,主要有台湾草、平远草、增城草、灵山草、越南草等,由于植株形态特征与产量直接相关,为此受到生产者的密切关注[3-4]。不同品系的凉粉草总多糖和总黄酮含量、胶体特性黏度等也有一定差异,推测化学成分差异可能由遗传因素导致[5-8]。
非靶向代谢组学分析具有高分辨率、高灵敏度的方法学优势,特别适用于植物药材多成分复杂体系的分析,可用于识别差异代谢物、品种(品系)鉴定及差异性分析和遗传基础等研究[9-10]。Fan等[11]对黄连的基源植物进行代谢组学分析,找到了控制黄连质量的代谢标记物。蔡净蓉等[12]采用非靶向代谢组学测定3个橄榄品种成熟期果实代谢物,解析橄榄果实的主要代谢成分,以期为橄榄果实品质形成、优良品种选育等研究提供理论基础。
目前,不同栽培品系凉粉草化学成分的差异缺乏系统研究,其质量控制评价系统仍不全面。本研究从凉粉草种质资源中选择了3 个栽培品系(台湾草、平远草和增城草),应用超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-TOF-MS)对3 个品系凉粉草的化学成分进行分析和鉴定,并结合多元统计分析明确不同品系的差异代谢物,对于开展凉粉草药材质量控制与评价及优良品系选育具有参考价值。
1 材料与方法
1.1 实验材料3 个品系凉粉草均于2021年4月种植于广东省梅州市平远县石正镇种植基地,于2021年9月采收长势一致、无病虫害的凉粉草植株地上部分,每个品系设6 个重复,样品采集信息见表1。样品经广州中医药大学中药资源科学与工程研究中心张桂芳副教授鉴定为凉粉草(MesonachinensisBenth.),再根据其形态特征鉴定为3 个品系(台湾草、平远草和增城草),室温阴干1周,保存备用。
表1 凉粉草样品采集信息Table 1 Sample collection information of Mesona chinensis Benth.
1.2 试剂与仪器色谱级乙腈、色谱级甲醇(德国Merck 公司);色谱级甲酸(东京化成工业株式会社);L-2-氯苯丙氨酸(上海阿拉丁公司)。Acquity I-Class PLUS 超高效液相色谱仪、UPLC Xevo G2-XS QTOF高分辨质谱仪(美国Waters公司);BSA223S千分之一天平(德国Sartorius 公司);TDZ5-WS 低速台式离心机(湖南迈克尔实验仪器有限公司);台式冷冻离心机(德国Eppendorf公司)。
1.3 方法
1.3.1 不同栽培品系形态特征对比 选取长势一致的台湾草、平远草和增城草植株顶芽以下第3对叶片及其茎,置于体视镜下观察不同栽培品系凉粉草主茎、叶先端、叶缘和花的形态特征区别。
1.3.2 样品制备及代谢物提取 分别取台湾草、平远草和增城草干燥地上部分,粉碎过筛,加入20 倍体积蒸馏水,95 ℃回流提取4 h。滤过,以4 000 r·min-1离心5 min(离心半径为15 cm),取上清液,于水浴锅中浓缩至膏状,冷冻干燥后得凉粉草水提物。称取凉粉草水提物粉末50 mg,加入1 mL 含有浓度为20 mg·L-1内标(L-2-氯苯丙氨酸)的提取液(V甲醇∶V乙腈∶V水=2∶2∶1),涡旋30 s 后用研磨仪处理10 min,冰水浴超声10 min,在4 ℃下以12 000 r·min-1(离心半径为8.2 cm)离心15 min,取500 μL 上清液进行真空浓缩。向干燥后的提取物中加入160 μL提取液(V乙腈∶V水=1∶1),涡旋30 s,冰水浴超声10 min,在4 ℃下以12 000 r·min-1(离心半径为8.2 cm)离心15 min,取120 μL 上清液于2 mL 进样瓶。使用Acquity I-Class PLUS 超高效液相色谱串联Xevo G2-XS QTOF高分辨质谱仪进行分析。
1.3.3 质控样本 各取10 μL 代谢物提取溶液制成混合标准溶液,即质控(QC)样本,上机检测,每6 个分析样品中插入一个QC 样本,用于检测仪器稳定性。
1.3.4 液相色谱条件 使用Acquity UPLC HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱;进样量1 μL;流速0.40 mL·min-1;流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸乙腈;梯度洗脱:0~10 min,2%B;10~13 min,98% B;13~15 min,2% B。
1.3.5 质谱条件 电喷雾离子源(ESI);毛细管电压:2 500 V(正离子模式)或-2 000 V(负离子模式);锥孔电压:30 V;离子源温度:100 ℃;脱溶剂气温度:500 ℃;反吹气流速:50 L·h-1;脱溶剂气流速:800 L·h-1;质核比(m/z)采集范围:50~1 200。
1.3.6 数据处理 运用Progenesis QI 软件对MassLynx V4.2 采集的原始数据进行数据预处理,包括峰提取、峰对齐等。数据处理后使用METLIN数据库、公共数据库以及百迈客自建库进行鉴定,同时进行理论碎片识别,主要参数为:母离子质量数偏差在10-4以内,碎片离子质量数偏差在5×10-5以内。先采用无监督的主成分分析(principal component analysis,PCA)来观察各组样品间的总体分布,再运用有监督的正交偏最小二乘法显著性分析(OPLS-DA)寻找组间的差异代谢物,然后使用置换试验验证OPLS-DA模型的可靠性。为防止模型过拟合,采用7次交互验证和200 次置换检验的方法来考察模型的质量。在R-3.6.1 环境下,使用“ggplot2”软件包绘制火山图,参数设置为VIP 值≥1、P≤0.05;使用“pheatmap”“RcolorBrewer”软件包绘制聚类热图,参数设置为scale 按行做Z-score 转换[Z=(x-μ)/σ],其中,μ是平均值,σ是标准差。
1.3.7 差异代谢物筛选 从OPLS-DA 模型获得变量重要性投影(Variable Importance in Projection,VIP)值,VIP 值大于1 的变量被认为是差异变量。以VIP值≥1及P<0.05为标准筛选差异代谢物。
2 结果
2.1 不同栽培品系凉粉草形态对比经实地考察,凉粉草形态特征丰富,3 个主要栽培品系形态见图1。台湾草茎、叶密生长毛茸,叶片较厚,叶缘较钝;平远草茎毛茸短且少,叶片较薄,叶缘较尖;增城草茎毛茸数量中等,叶形长椭圆形,叶片较厚,叶缘细锯齿明显,侧脉突出。台湾草和增城草花色偏蓝紫,平远草花色偏白。此外,平远花苞片偏圆形;增城草花苞片初为紫色,后逐渐变为绿色。
2.2 质控结果分析根据“1.3.3”项下方法制备QC样本,按“1.3.4”“1.3.5”项下条件进行测定,得到QC 样本的基峰强度色谱图(base peak intensity chromatograms,BPI图)。将BPI图进行重叠,见图2。由图2可知3个QC样本BPI图出峰保留时间和峰面积重叠好,说明仪器稳定性好。
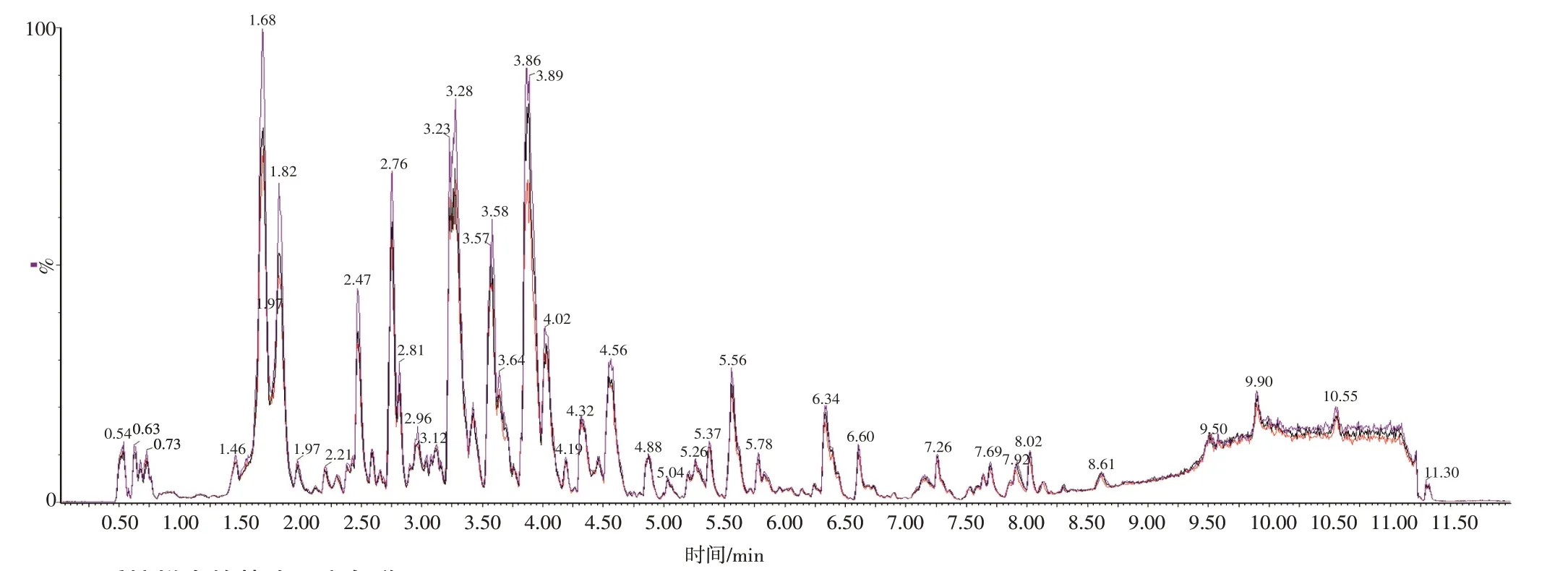
图2 质控样本的基峰强度色谱图Figure 2 The base peak intensity(BPI)chromatogram of Mesona chinensis Benth.for quality control
2.3 不同栽培品系凉粉草药材代表性色谱图取不同栽培品系样品,根据“1.3.2”项下方法制备样品溶液,按“1.3.4”“1.3.5”项下条件进行测定,得到3 个品系凉粉草样品正负离子模式下的总离子流图。见图3。通过直观分析,QC 样本总离子流图曲线重叠性高,质谱峰保留时间和峰面积一致,所建立的方法可靠、检测仪器系统稳定。3个栽培品系总离子流图总体轮廓相似,但峰响应值存在差异,表明品系间化学成分在物质种类上较为一致,但成分含量上存在一定差异。
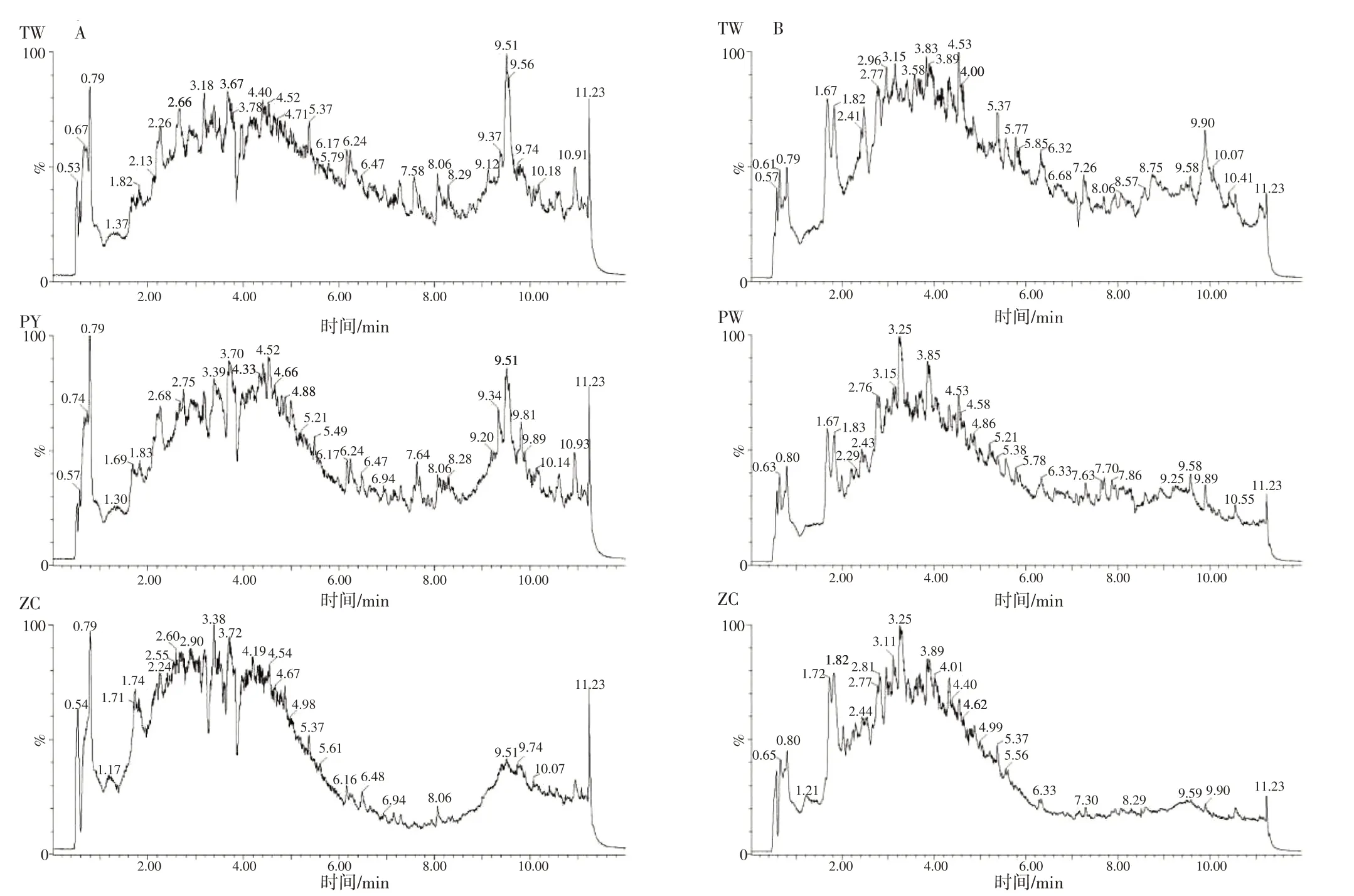
图3 不同品系凉粉草样品的总离子流图Figure 3 Total ion chromatogram of different strains of Mesona chinensis Benth.
2.4 不同品系凉粉草PCA为初步分析各组样品之间的总体代谢差异和组内样品之间的变异度大小,对各组样品进行PCA。见图4。结果显示,除少数样品外,台湾草、平远草和增城草组内样品中多数能较为集中分布,表明样品重复性较好;各组间样品分离,代谢物种类有一定的差异。PCA 对于相关性较小的变量不敏感,台湾草、平远草个别样品95%置信区间重叠,采用OPLS-DA法进一步分析。
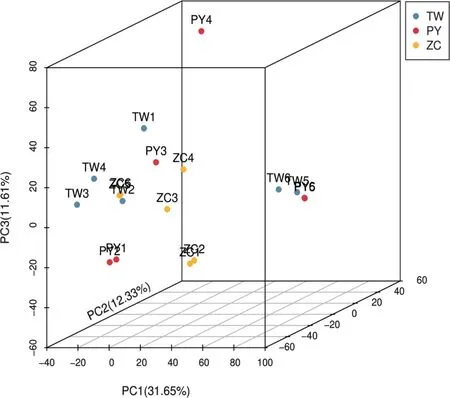
图4 不同品系凉粉草样品PCA 结果Figure 4 PCA analysis results of different strains of Mesona chinensis Benth.samples
2.5 不同品系凉粉草OPLS-DA 及模型验证使用OPLS-DA 评分图识别不同栽培品系的生物标志物。从图5 可以看出,正、负两种离子模式OPLS-DA 得分图中,每组样品均处于左右两个象限之中,图中各样品点没有重叠,区分效果都比较显著,表明3组样品代谢物存在明显的差异。台湾草与平远草组间R2X、R2Y、Q2Y值分别为0.641,0.997,0.921;台湾草与增城草组间R2X、R2Y、Q2Y值分别为0.620,0.997,0.944;平远草与增城草组间R2X、R2Y、Q2Y值分别为0.599,0.998,0.900。正负离子模式下,台湾草、平远草和增城草都能很好地分开,相同样品组内高度聚合。

图5 不同品系凉粉草的差异代谢物OPLS-DA 得分图Figure 5 OPLS-DA score plot of differential metabolites in different strains of Mesona chinensis Benth.
为检查OPLS-DA 模型的可靠性,需要进行置换检验。多次将样品的分组随机打乱(置换),建立对应的OPLS-DA 模型并计算其R2Y和Q2Y,将结果绘制成散点图,蓝点和红点分别代表置换后模型的R2Y和Q2Y,两条虚线为R2Y和Q2Y拟合的回归线。见图6。结果表明,台湾草与平远草、台湾草与增城草、平远草与增城草各组间Q2Y拟合回归线斜率均为正,说明模型有意义,R2Y普遍位于Q2Y上方,说明建模训练集和测试集的独立性较好。
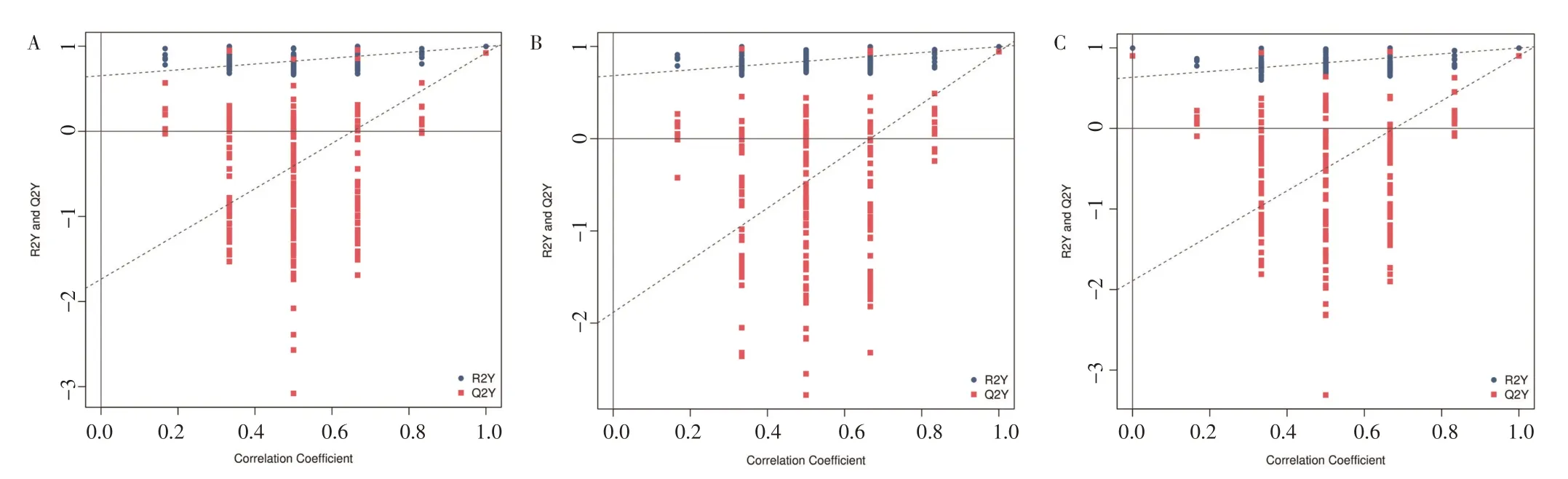
图6 不同品系凉粉草的差异代谢物置换检验图Figure 6 Permutation charts of differential metabolites in different strains of Mesona chinensis Benth.
2.6 差异代谢物的筛选与分析为直观反映在两组中代谢物含量的差异总体趋势以及代谢物差异的统计学显著性,绘制了差异代谢物的火山图。见图7。台湾草与平远草的差异代谢物上调、下调数量分别为28、41 种;台湾草与增城草的差异代谢物上调、下调数量分别为59、54 种;平远草与增城草的差异代谢物上调、下调数量分别为29、24 种。差异代谢物的聚类热图见图8。可知同一品系凉粉草,即台湾草、平远草和增城草各聚集为一类,表明样品重复性好,样品间区别明显。

图7 不同品系凉粉草样品差异代谢物火山图Figure 7 Volcano map of differential metabolites in different strains of Mesona chinensis Benth.

图8 不同品系凉粉草样品差异代谢物聚类热图Figure 8 Clustering heatmap of differential metabolites in different strains of Mesona chinensis Benth.
差异代谢物韦恩图分析结果见图9。台湾草vs平远草、台湾草vs增城草、平远草vs增城草组间分别有37、78 和25 个特异差异代谢物。3 组之间共有差异代谢物3 个,分别是3-Oxalomalate、S-Formylglutathione、4'-Oxonebramine。台湾草vs平远草与台湾草vs增城草共有差异代谢物最多,为21 个,台湾草vs平远草与平远草vs增城草、台湾草vs增城草与平远草vs增城草共有差异代谢物分别为14 个和17 个。结果表明平远草和增城草品系之间的代谢物含量更较为相近。
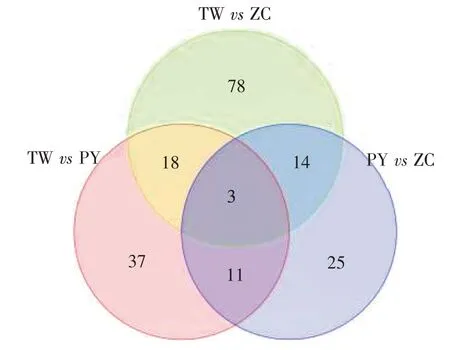
图9 不同品系凉粉草的差异代谢物韦恩图Figure 9 Venn diagram of differential metabolites in different strains of Mesona chinensis Benth.
2.7 不同品系凉粉草差异代谢物通路分析对不同栽培品系凉粉草进行差异代谢物KEGG功能注释,展示每组显著性强的前20 条通路,结果见图10。在台湾草vs平远草组中,差异代谢物主要富集在ABC 转运器、肽聚糖生物合成、甲苯降解等代谢途径;台湾草vs增城草组中,差异代谢物主要富集在丙酮酸代谢、色氨酸代谢、黄酮和黄酮醇生物合成等代谢途径;平远草vs增城草组中,差异代谢物主要富集在甲烷代谢、叶酸生物合成、ABC 转运器等代谢途径。台湾草vs平远草组和台湾草vs增城草组中显著性较强的代谢途径都有黄酮和黄酮醇生物合成KEGG途径,说明台湾草与平远草、增城草品系具有显著差异的黄酮类代谢物。
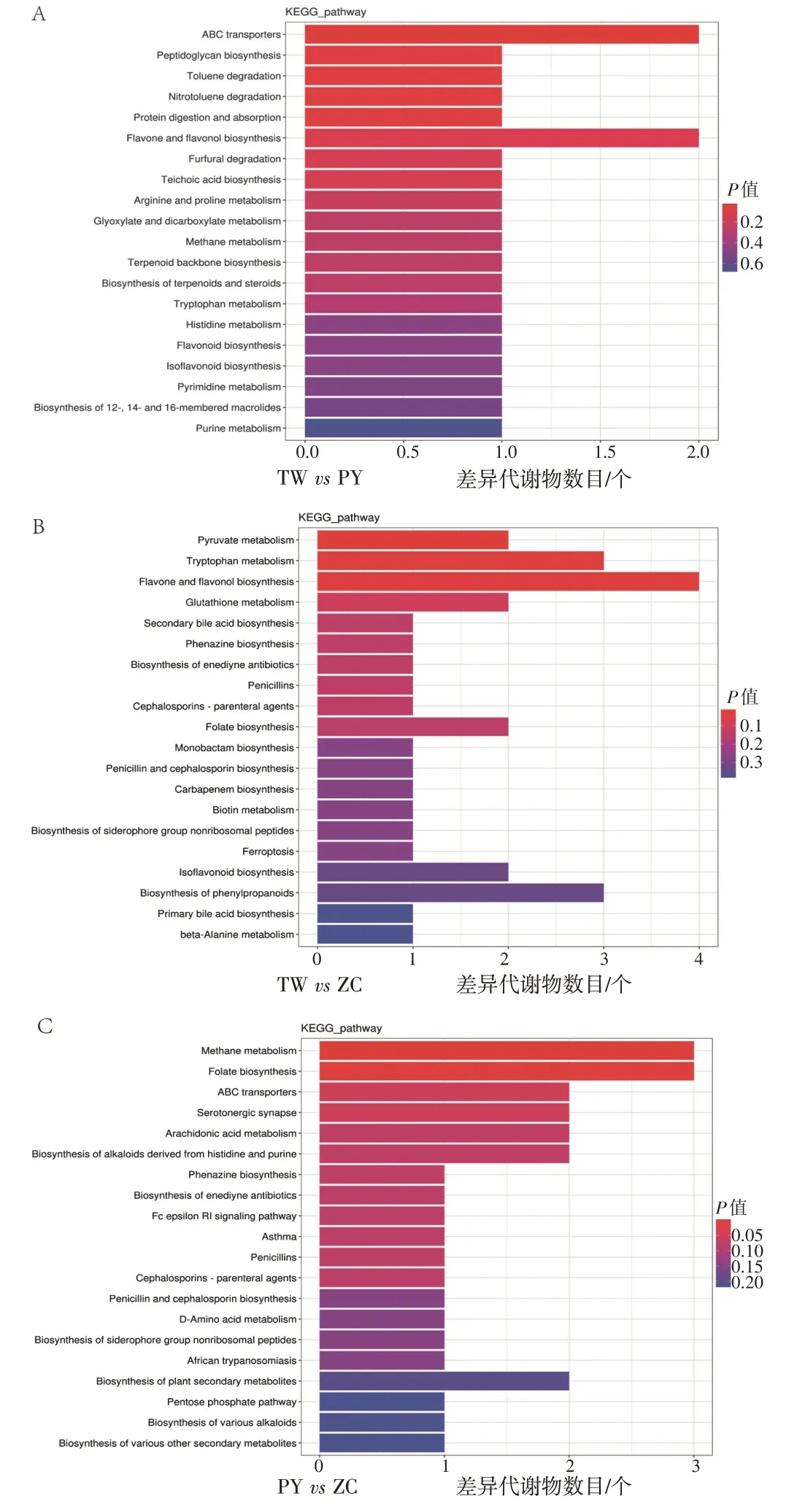
图10 不同品系凉粉草的差异代谢物KEGG 富集图Figure 10 KEGG enrichment map of differential metabolites in different strains of Mesona chinensis Benth.
在台湾草vs平远草组中,黄酮类差异代谢物有4 个,分别是柚皮素、橙皮苷甲基查耳酮、芸香苷、山奈酚3-O-葡萄糖苷,其中差异倍数最大的是山奈酚3-O-葡萄糖苷。在台湾草vs增城草组中,黄酮类差异代谢物有8 个,分别是木犀草素7-O-葡糖苷酸、芹菜素、7,4'-二羟基异黄酮、芹菜素7-O-β-D-葡萄糖苷、豌豆素、芍药素3-O-葡萄糖苷、蒺藜皂苷、槲皮素,其中差异倍数最大的是槲皮素,其次是豌豆素、木犀草素7-O-葡糖苷酸。据差异倍数可考虑将槲皮素作为区分台湾草与平远草、增城草品系的差异代谢物;将山奈酚3-O-葡萄糖苷作为区分平远草与增城草品系的差异代谢物。结果见表2。
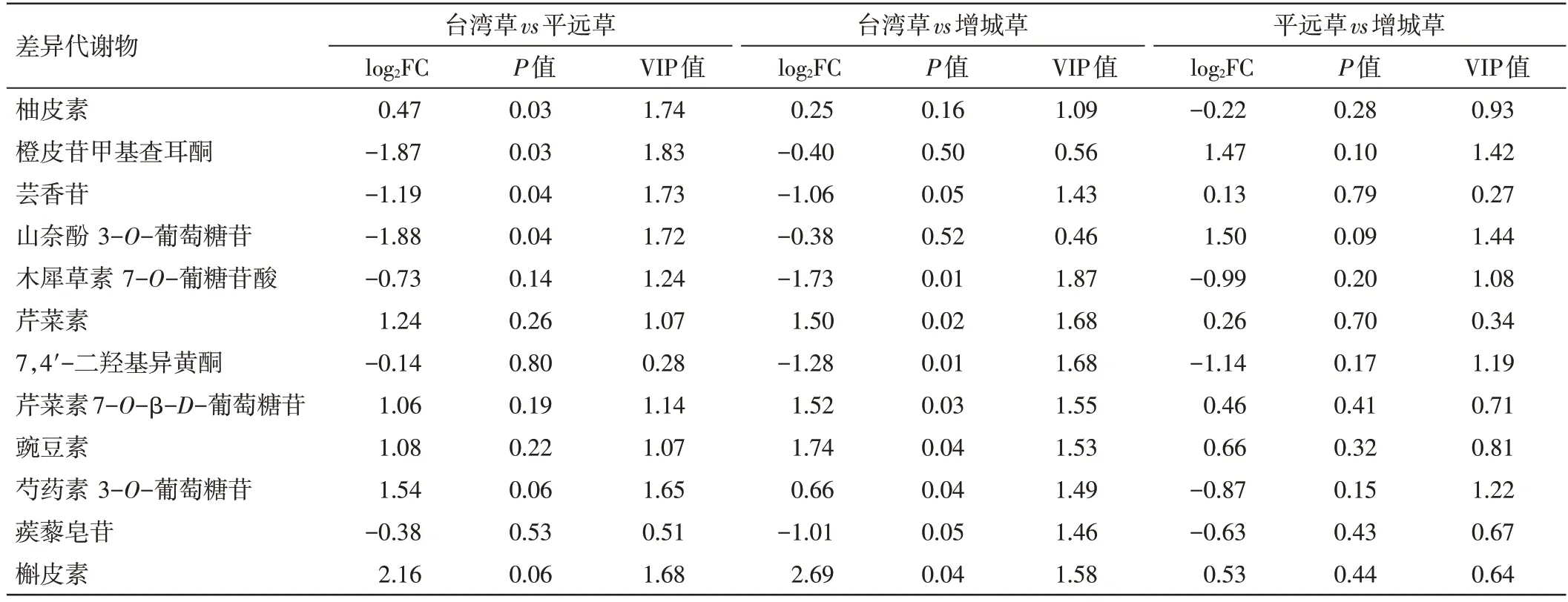
表2 不同品系凉粉草的黄酮类差异代谢物Table 2 Flavonoid differential metabolites of different strains of Mesona chinensis Benth.
3 讨论
凉粉草为药食两用的植物资源,其主要的水溶性药效成分为多糖、黄酮和酚类化合物。韦智灵等[13]建立了凉粉草药材水溶性成分HPLC 指纹图谱,鉴定出咖啡酸、异槲皮苷、迷迭香酸苷、紫云英苷、迷迭香酸的色谱峰。赖志明等[5]研究表明,酚酸类和黄酮类物质对于凉粉草的质量评价有重要贡献。
本研究采用水为溶剂加热回流提取,以UPLCQ-TOF-MS非靶向代谢组学技术对凉粉草3个栽培品系代谢物进行分析,其中台湾草vs平远草组和台湾草vs增城草组的差异代谢物显著富集于黄酮类生物合成通路。结合差异倍数和文献报道[5,13],将槲皮素与山奈酚3-O-葡萄糖苷作为3 个品系区分的差异代谢物。植物的次生代谢产物与合成代谢通路中关键酶、转录调控因子密切相关,通过代谢通路可以寻找研究对象中表型差异的原因[14]。不同栽培品系的凉粉草在化学物质成分上存在差异,其差异代谢物显著富集在类黄酮生物合成通路,推测该通路上显著富集的基因可能是引起3 种凉粉草表型不同的原因。结合已有的研究[5,13],考虑将山奈酚3-O-葡萄糖苷、槲皮素等用于凉粉草药材的质量评价,有助于凉粉草品系区分、质量评价及资源的合理开发利用。
综上所述,利用UPLC-Q-TOF-MS代谢组学技术结合多元统计分析方法,可用于区分台湾草、平远草和增城草3个品系的凉粉草,为不同品系凉粉草差异性分析提供新思路,也为凉粉草的药材质量控制与评价及优良品系选育利用提供参考。

