复方泽漆冲剂通过抑制NLRP3炎症小体活化改善咪喹莫特诱导银屑病样小鼠的作用及机制研究
吴敏,刘涛峰,刘小平,曹宇,章纬,汪长中(1.安徽中医药大学中西医结合学院,安徽 合肥 3001;.安徽中医药大学第一附属医院,安徽 合肥 30031;3.安徽省中医药科学院中西医结合研究所,安徽 合肥 3001;4.安徽中医药大学中药复方安徽省重点实验室,安徽 合肥 3001)
寻常型银屑病(Psoriasis vulgaris)是一种常见的慢性免疫炎症性皮肤病,影响全球近6 000 万人口[1],发病率呈上升趋势。寻常型银屑病的主要特征为复发性鳞片状红色斑块及丘疹,可累及任何部位的皮肤,以肘部、膝盖及头皮更为常见[2],且与高血压、肥胖、Ⅱ型糖尿病等多种疾病密切关联[3],但缺乏特效治疗药物。一般认为银屑病的发生与遗传易感性及环境因素相关[4],但确切的发病机制尚不明确。新近研究[5]证实,核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体过度活化,并产生大量白细胞介素1β(IL-1β)等炎性因子,在银屑病的发生发展过程中发挥重要作用。抑制NLRP3炎症小体活性的药物能够缓解银屑病皮损部位的免疫炎症性损伤,从而改善其临床症状[6]。复方泽漆冲剂由泽漆、大青叶、白花蛇舌草、土茯苓、板蓝根、大血藤、半枝莲、黄芩、贯众、龙胆草、莪术、五味子等中药组成,是安徽中医药大学第一附属医院的特色中药制剂,临床应用能明显改善进行期寻常性银屑病患者的临床症状,降低异常升高的血清肿瘤坏死因子α(TNF-α)、IL-8 水平,改善微血管情况[7-8]。故本研究拟从NLRP3炎症小体角度探讨复方泽漆冲剂对寻常型银屑病的作用及机制,以期为中医药治疗寻常型银屑病提供参考。
1 材料
1.1 动物雄性BALB/c 小鼠56 只,SPF 级,4~6 周龄,(20±2)g,购于杭州子源实验动物科技有限公司,实验动物生产许可证号:SCXK(浙)2019-0004,实验动物质量合格证号:20210927Abzz0105000646。本实验经安徽中医药大学实验动物伦理委员会批准,批文号:AHUCM-mouse-2021113。
1.2 药物及试剂复方泽漆冲剂,安徽中医药大学第一附属医院,批号:20201230;5%咪喹莫特软膏,四川明欣药业有限责任公司,批号:39210802;甲氨蝶呤片,上海上药信谊药厂有限公司,批号:191213;NLRP3 抑制剂(MCC950),上海宏叶生物科技有限公司,批号:GC316443;凡士林软膏,广东恒健制药有限公司,批号:210903。复方泽漆冲剂、甲氨蝶呤片均以生理盐水配制为混悬液,MCC950 以磷酸盐缓冲液(PBS,pH=7.4)溶解,4 ℃保存,用前混匀。
IL-1β ELISA 检测试剂盒(批号:GR2021-11)、IL-18 ELISA 检测试剂盒(批号:GR2021-11),武汉基因美生物科技有限公司;Novostart SYBR qPCR SuperMix Plus,安诺伦(北京)生物科技有限公司,批号:05229413;PrimeScriptTMRT reagent Kit with gDNA Eraser,日本TaKaRa 公司,批号:AL21115A;NLRP3 抗体,成都正能生物制剂有限公司,批号:LL0311;凋亡相关斑点样蛋白(ASC)抗体,亚科因(武汉)生物技术有限公司,批号:ATUMR3205;半胱氨酸蛋白酶1(Caspase-1)抗体,艾博抗(上海)贸易有限公司,批号:GR3265120-7;苏木素染液(批号:06252114)、醇溶伊红染液(批号:06242112)、中性树脂(批号:06272110),均购自上海埃德伯格科技集团有限公司;RIPA 细胞裂解液,上海碧云天生物技术有限公司,批号:09271919023;十二烷基硫酸钠(SDS,批号:723T033)、甘氨酸(批号:516V061)、Tris(批号:809C0730)、Tween-20(批号:1121S017),均购自北京索莱宝科技有限公司;TRIzol(批号:350508)、ECL 超敏发光试剂盒(批号:VC298015)、预染蛋白Marker(批号:00784045),均购自美国赛默飞世尔科技公司;山羊抗兔IgG(批号:202700514)、山羊抗小鼠IgG(批号:140193),均购自北京中杉金桥生物技术有限公司;β-actin 抗体,生工生物工程(上海)股份有限公司,批号:20210806。
1.3 主要仪器PIKOREAL 96型荧光定量PCR仪,美国赛默飞世尔科技公司;VE-180型电泳槽、EPS300型电泳仪、VE-186型转膜仪,上海天能科技有限公司;JS-1070P 型自动曝光仪,上海培清科技有限公司;RT-6000型酶标仪,深圳雷杜生命科学股份有限公司;YB-7LF 型生物组织包埋机、YT-7FB 型生物组织摊烤片机、ZT-12M型生物组织自动脱水机,湖北亚光医疗器械有限公司;RM2016型切片机,上海徕卡仪器公司;JW-3021HR 型高速冷冻离心机,安徽嘉文仪器装备有限公司。
2 方法
2.1 分组、模型复制[9]及给药适应性饲养3 d后,将56 只小鼠按照体质量随机分为7 组:正常组、模型组、甲氨蝶呤组(阳性药组)、NLRP3 抑制剂组(MCC950组)及复方泽漆冲剂低、中、高剂量组,每组8只。各组小鼠背部使用小鼠剃毛器剃毛,裸露皮肤面积约为2 cm×3 cm,再用10% Na2S 脱去剩余毛发;第1 天观察脱毛区有无红肿、破溃等异常反应;次日起,正常组小鼠背部脱毛区均匀涂抹凡士林软膏,其余6 组小鼠背部脱毛区均匀涂抹5%咪喹莫特软膏(每只62.5 mg),连续7 d。
造模同时给药治疗,按照小鼠与人体表面积换算给药剂量,复方泽漆冲剂低、中、高剂量组按照9.75、19.5、29.25 g·kg-1剂量灌胃给药,甲氨蝶呤组按照1 mg·kg-1剂量灌胃给药,各组灌胃体积为10 mL·kg-1;正常组和模型组灌胃等体积生理盐水;NLRP3 抑制剂组按照25 mg·kg-1剂量腹腔注射MCC950;每天给药1次,连续7 d。
2.2 样本采集末次给药24 h后,各组小鼠予以摘除眼球取血,每只收集0.5 mL 血液;室温下静置0.5 h后,以2 000 r·min-1(离心半径为10 cm)离心10 min,吸取上层血清,-20 ℃保存;取血后脱颈处死小鼠,取背部皮损区皮肤组织。
2.3 皮损指数评价采用PASI(Psoriasis area and severity index)评分[9]进行银屑病模型小鼠皮损指数评价。造模后每日拍照记录小鼠皮损变化情况,对皮损处的红斑、鳞屑、增厚程度分别进行0~4 级评分(无,0 分;轻度,1 分;中度,2 分;重度,3 分;极重度,4分),将三者评分合计得到PASI总分。
2.4 HE 染色法观察皮损组织病理变化采用4%多聚甲醛溶液固定新鲜的皮损组织后,经过脱水、包埋、切片、脱蜡处理;然后进行苏木素染色,再放入伊红溶液中染色3 min;最后经乙醇梯度脱水、二甲苯透明、中性树胶封片后,在光学显微镜下观察皮损组织病理变化,并利用CaseViewer软件测量皮损表皮厚度。
2.5 免疫组织化学法检测皮损组织中NLRP3 蛋白表达水平取“2.4”项下制备的小鼠皮肤组织切片,经二甲苯脱蜡、水化后,用柠檬酸盐缓冲液进行抗原热修复;待温度降至室温后,依次用3% H2O2室温孵育,PBS 冲洗;然后滴加NLRP3(1∶200)抗体,置于37 ℃培养箱孵育60 min;PBST冲洗后滴加二抗,37 ℃下孵育30 min;PBST 冲洗后DAB 显色,蒸馏水冲洗终止;然后用苏木素衬染2~5 min,水洗干净;1%盐酸乙醇分化,再次水洗;切片经碳酸锂溶液蓝化、常规脱水、二甲苯透明、中性树胶封片后镜检。每只小鼠皮肤切片在200倍镜下随机选取1 个视野,细胞核呈蓝色,阳性表达为棕色;采用Image-Pro Plus 6.0 软件测定每个视野中的积分光密度(IOD)值,并进行统计分析。
2.6 ELISA 法检测小鼠血清IL-1β、IL-18 含量取“2.2”项下制备的小鼠血清,室温下解冻后,严格按照试剂盒说明书步骤进行操作,采用ELISA法检测小鼠血清IL-1β、IL-18含量。
2.7 qRT-PCR 法检测皮损组织NLRP3、ASC、Caspase-1 mRNA 表达水平取小鼠皮肤组织50~100 mg,液氮研磨成粉末,加入1 mL TRIzol 裂解液,提取总RNA,检测RNA 浓度及纯度。按照反转录试剂盒说明书步骤操作,合成cDNA,逆转录条件为:42 ℃、2 min,冰浴1 min;37 ℃、15 min;85 ℃、5 s。以cDNA 为模板,加入靶基因上、下游引物于10 μL反应体系内,进行PCR扩增反应,反应条件为:95 ℃预变性1 min,95 ℃变性20 s,60 ℃退火1 min,共40个循环。反应结束后,根据扩增曲线及熔解曲线判断PCR 反应特异性。结果以β-actin 为内参,采用2-△△Ct法计算目的基因的相对表达水平,并进行统计分析。引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequences
2.8 Western Blot 法检测皮损组织中NLRP3、ASC、Caspase-1 蛋白表达水平称取冷冻的小鼠背部皮损组织0.1 g 至匀浆器中,剪碎,充分研磨后,加入1 mL 组织蛋白裂解液;充分匀浆后,以4 ℃、12 000 r·min-1(离心半径为10 cm)离心15 min,取上清液;采用BCA 法测定总蛋白浓度。加上样缓冲液及蛋白制备样品,沸水浴使蛋白变性;采用SDSPAGE 凝胶电泳分离蛋白,将凝胶中的蛋白转印至PVDF 膜上;用5%脱脂牛奶在室温下摇床封闭1 h后,添加一抗[NLRP3、ASC、Caspase-1(1∶1 000)、β-actin(1∶1 000)],4 ℃下孵育过夜;TBST 洗膜3 次,添加辣根过氧化物酶(HRP)标记的二抗(1∶20 000),室温下孵育1 h;TBST 洗膜3 次后,采用ECL化学发光法曝光显影,拍照;采用ImageJ图像分析软件分析蛋白条带灰度值,以β-actin 为内参,对目的蛋白进行半定量分析。
2.9 统计学处理方法采用SPSS 25.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 或Games-howell 法检验;以P<0.05为差异有统计学意义。
3 结果
3.1 复方泽漆冲剂对银屑病样小鼠皮损外观的影响结果见图1。与正常组比较,模型组小鼠在外涂5%咪喹莫特软膏次日,造模区皮肤即可见少许粗糙;第3天可见皮肤上有少许红斑,上有少许鳞屑,皮损稍增厚;第5天可见片状红斑,鳞屑较多,皮损厚度增加;第7天皮损显著增厚,并出现典型红斑、浸润及鳞屑,PASI 评分显著升高(P<0.01)。与模型组比较,给药组小鼠背部造模区皮损红斑及鳞屑明显减少,浸润程度明显减轻,PASI 评分显著降低(P<0.05,P<0.01)。结果表明,5%咪喹莫特软膏对小鼠背部造模区的皮损病理学改变符合银屑病特征,而复方泽漆冲剂可改善银屑病样小鼠的皮损。
3.2 复方泽漆冲剂对银屑病样小鼠皮损组织病理形态变化及表皮厚度的影响结果见图2。正常组小鼠背部皮肤表现为1~3 层角质层细胞,3~5 层棘层细胞,基底层细胞完整,真皮浅层及血管周围未见明显炎性细胞浸润。与正常组比较,模型组小鼠皮肤角化过度伴角化不全,棘层增厚、表皮突下延,真皮浅层淋巴细胞浸润明显,表皮厚度显著增加(P<0.01)。与模型组比较,给药组小鼠皮肤组织病理损伤程度明显减轻,复方泽漆冲剂高剂量组、甲氨蝶呤组及NLRP3 抑制剂组小鼠的表皮厚度显著降低(P<0.01)。结果表明,复方泽漆冲剂能抑制银屑病样小鼠表皮细胞增殖。
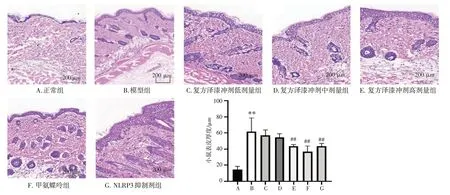
图2 复方泽漆冲剂对银屑病样小鼠皮损组织病理变化及表皮厚度的影响(HE 染色,×200;±s,n=8)Figure 2 Effects of Compound Zeqi Granules on skin lesions histopathological changes and skin thickness in psoriasis-like mice(HE staining,×200;±s,n=8)
3.3 复方泽漆冲剂对银屑病样小鼠皮损组织中NLRP3表达的影响结果见图3。与正常组比较,模型组小鼠皮损组织中NLRP3 蛋白表达量显著升高(P<0.01)。与模型组比较,给药组小鼠皮损组织中NLRP3 蛋白表达量均显著降低(P<0.01)。结果表明,复方泽漆冲剂能抑制银屑病样小鼠皮损组织中NLRP3炎症小体的表达。
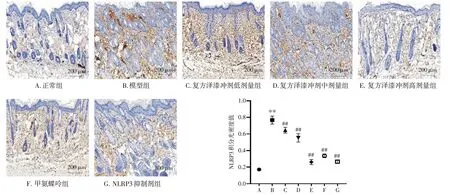
图3 复方泽漆冲剂对银屑病样小鼠皮损组织中NLRP3 表达的影响(免疫组化,×200;±s,n=8)Figure 3 Effect of Compound Zeqi Granules on NLRP3 expression in skin lesion tissue of psoriasis-like mice(IHC,×200;±s,n=8)
3.4 复方泽漆冲剂对银屑病样小鼠血清中IL-1β、IL-18 水平的影响结果见图4。与正常组比较,模型组小鼠血清IL-1β、IL-18 水平显著升高(P<0.01);与模型组比较,给药组小鼠血清IL-18水平均显著降低(P<0.05,P<0.01),复方泽漆冲剂高剂量组、甲氨蝶呤组及NLRP3抑制剂组小鼠的血清IL-1β水平均显著降低(P<0.01)。结果表明,复方泽漆冲剂能抑制银屑病样小鼠血清中炎症因子IL-1β、IL-18的表达。

图4 复方泽漆冲剂对银屑病样小鼠血清中IL-1β、IL-18 水平的影响(±s,n=8)Figure 4 Effects of Compound Zeqi Granules on serum IL-1β and IL-18 levels in psoriasis-like mice(±s,n=8)
3.5 复方泽漆冲剂对银屑病样小鼠皮损组织NLRP3、ASC、Caspase-1 mRNA 及蛋白表达的影响结果见图5、图6。与正常组比较,模型组小鼠皮损组织NLRP3、ASC、Caspase-1 mRNA 及蛋白表达显著上调(P<0.01)。与模型组比较,给药组小鼠皮损组织NLRP3、ASC、Caspase-1 mRNA 及蛋白表达均显著下调(P<0.05,P<0.01)。结果表明,复方泽漆冲剂能抑制银屑病样小鼠NLRP3炎症小体的表达。
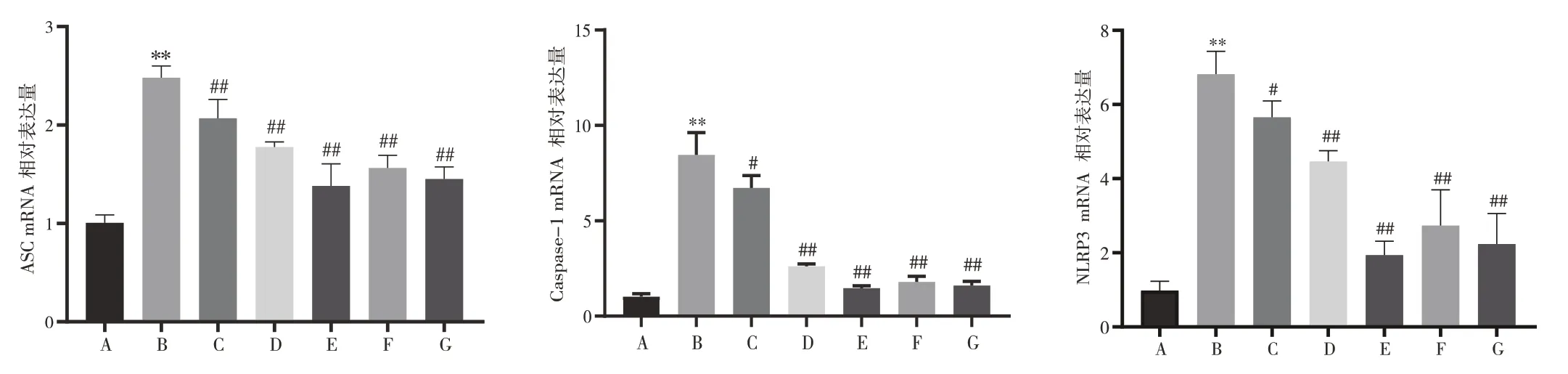
图5 复方泽漆冲剂对银屑病样小鼠皮损组织NLRP3、ASC、Caspase-1 mRNA 表达的影响(±s,n=8)Figure 5 Effects of Compound Zeqi Granules on mRNA expressions of NLRP3,ASC and Caspase-1 in skin lesion tissue of psoriasislike mice(±s,n=8)
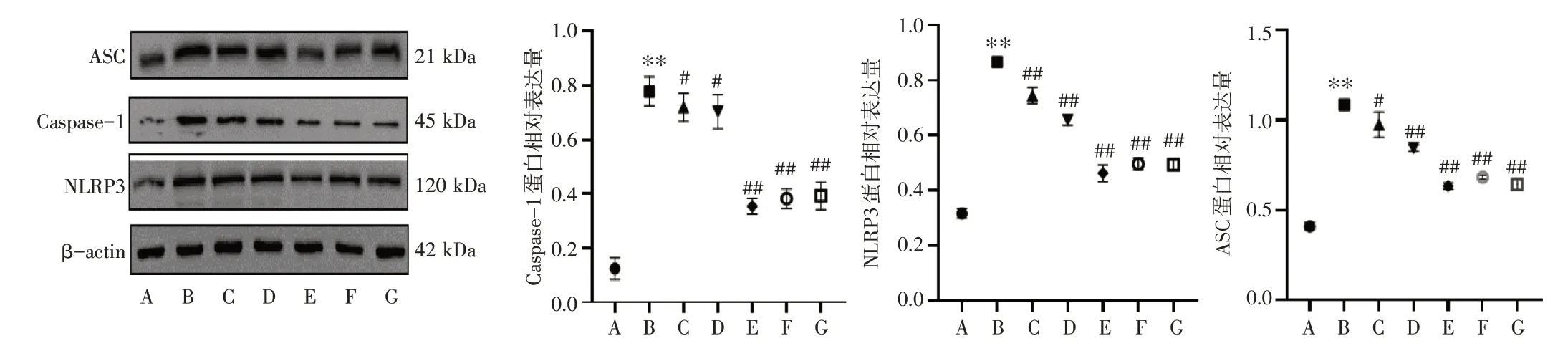
图6 复方泽漆冲剂对银屑病样小鼠皮损组织NLRP3、ASC、Caspase-1 蛋白表达的影响(±s,n=8)Figure 6 Effects of Compound Zeqi Granules on protein expressions of NLRP3,ASC and Caspase-1 in skin lesion tissue of psoriasislike mice(±s,n=8)
4 讨论
银屑病是多因素交互的复杂疾病,遗传因素与环境因素在发病过程中发挥了重要作用[10-11],共同影响银屑病的免疫病理性损伤。复方泽漆冲剂是安徽中医药大学第一附属医院开发的用于治疗银屑病的院内制剂。方中君药泽漆、大青叶、白花蛇舌草清热凉血解毒;臣药土茯苓、板蓝根、大血藤、半枝莲能够增强君药清热解毒之效;佐以黄芩、贯众、龙胆草、莪术、五味子,共奏清热凉血解毒、行气活血消瘀之功。多年来的临床应用[7-8]表明,复方泽漆冲剂对内有蕴热,郁于血分,复感毒邪所致的风热血燥型银屑病疗效显著。
研究表明,IL-17/IL-23 轴在银屑病发病过程中起重要作用[12-13],但随着对银屑病发病机制研究的不断深入,发现NLRP3炎症小体的过度活化也与银屑病密切相关,NLRP3炎症小体被视为干预银屑病的一个新的重要靶标[5-6]。炎症小体是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物,是机体固有免疫系统的重要组成部分。炎症小体能够识别病原相关分子模式(PAMPs)或宿主来源的危险信号分子(DAMPs),招募并激活半胱天冬氨酶的前体(pro-Caspase-1);活化的Caspase-1 能够切割IL-1β、IL-18 的前体,产生相应的成熟细胞因子IL-1β、IL-18,以清除病原体或应对危险信号,发挥对宿主的防御保护作用[14]。在众多炎症小体中,针对NLRP3炎症小体的研究最多,其活化失调可导致过度炎症反应,并参与了包括银屑病在内的多种免疫炎症性疾病的发生发展[15],抑制NLRP3炎症小体的过度活化有助于银屑病的治疗。研究[16]发现,寻常型银屑病患者皮损与非皮损处皮肤比较,ASC、Caspase-1 mRNA 及蛋白表达水平均显著上调。与正常皮肤比较,银屑病患者受累表皮中NLRP3炎症小体、IL-18和IL-1β表达水平明显升高[17]。洋金花有效部位可以通过调控TLR7/8-MyD88-NF-κB 通路介导的NLRP3抑制咪喹莫特诱导的小鼠银屑病样皮损形成[9];人参皂苷Rg1 可通过抑制ROS/NLRP3 通路缓解小鼠银屑病样皮损[18]。本研究结果显示,与正常组比较,外用5%咪喹莫特乳膏的模型组小鼠背部造模区银屑病样皮损处的NLRP3、ASC、Caspase-1 mRNA 及蛋白表达均显著上调,血清IL-1β、IL-18 水平显著升高,与上述研究结果基本一致。而复方泽漆冲剂干预后,能够明显抑制银屑病样小鼠NLRP3炎症小体的表达,降低血清炎症因子IL-1β、IL-18水平。
另有研究[12-13,19]指出,IL-23/Th17 轴在银屑病发病过程中发挥了重要作用,Th17 细胞活化后能够释放IL-17、IL-22、IL-21等细胞因子,促进角质细胞过度增生,使表皮显著增厚并向真皮生长,并逐渐衍变为慢性炎症性皮肤损害。本课题组前期研究[20]发现,复方泽漆冲剂能明显改善寻常型银屑病患者的临床症状,降低血清IL-17、IL-22、IL-23、IL-8 及TNF-α等炎症因子水平。研究[21]发现,NLRP3炎症小体活化所产生的IL-1β 能够通过作用于Th17 细胞促进IL-17 的产生。因此推测,复方泽漆冲剂调控NLRP3炎症小体既可能通过直接活化所产生的IL-1β影响皮肤慢性炎症性损害,也可能通过调控IL-23/Th17 轴影响皮损,具体作用机制有待进一步深入探讨。
综上所述,复方泽漆冲剂能改善银屑病样小鼠的皮损,可能与其抑制NLRP3炎症小体的表达,降低血清炎症因子IL-1β、IL-18水平有关。

