梧桐叶衍生生物炭对水中布洛芬的去除性能与机理
王寿儒
(天津市华宇膜技术有限公司,天津 300100)
药品与个人护理品(PPCPs)已广泛应用于农业、工业、医药和人们日常生活用品等领域[1].随着PPCPs消费量的不断增加,常规污水处理工艺难以将其从废水中彻底去除,导致部分PPCPs 被释放到环境中,对生态环境和人类健康造成潜在威胁[2-3].布洛芬(ibuprofen,IBP)作为世界上消费量最大的非甾体抗炎药之一,通常用于缓解关节炎、疼痛和发烧的症状,由于其相对稳定性和亲水性,在水体中呈现“伪持久性”的状态[4],同时它也是环境水体中检测最为常见的药物,在制药工业废水中甚至能达到mg/L 级[5].据报道[6-8],布洛芬可以改变胚胎的心脏生理学和血液动力学,损害斑马鱼的心血管发育,降低甲壳类动物繁殖率,还可能诱发男性代偿性性腺机能减退.因此从水中去除IBP 对维护生态环境以及人类健康具有重要意义.
目前已有多种技术去除水中的IBP,包括人工湿地、生物降解、光催化、臭氧氧化以及吸附法等[9-13].这些处理技术都有一定的优势,但由于效率低、成本高、工艺复杂、会产生有毒中间产物等问题限制了一些技术的广泛应用[14].其中吸附法具有高效、操作简单和选择性好等特点,且实际操作中基建和设备投资少,在去除IBP 方面具有很好的应用前景[15].活性炭、黏土、碳纳米管等材料已被用于吸附水中的IBP[16-18],但这些材料的制备过程通常需要多种化学反应步骤,因此,寻找一种高性能、制备简单且无需任何化学修饰的吸附材料更具有实际应用潜力[19].生物炭是生物质材料(如植物秸秆、市政污泥等)在完全或部分缺氧的条件下热解得到的高含碳量固体产物,它具有多孔结构、高比表面积、丰富的官能团等特点以及绿色环保、低成本、高效率等优势,在去除环境中污染物方面很有潜力[20].
目前,中国每年的园林绿化垃圾产量超过2.5 亿t,其中回收利用率不到10%,主要是作为垃圾进行堆肥、焚烧或填埋,造成了环境污染和资源浪费[21].法国梧桐树是中国栽植数量较多的行道树之一,落叶通常被露天焚烧或送至垃圾填埋场,产生大量温室气体,增加了垃圾处理站的负担[22].因此,利用园林绿化废弃物制备生物炭,并用来去除水中的污染物,是一种“双赢”的解决方案.
本研究目的主要是利用废弃生物质制备一种低成本的绿色吸附剂,用于从水中去除IBP,缓解IBP 造成的不利影响,并实现废弃生物质的资源化利用,并对IBP 吸附前后生物炭的表面结构、组成和官能团进行表征.此外,本文还研究P-BC 对IBP 的吸附机理,以及溶液pH 值和共存离子对吸附的影响,并对生物炭的再利用进行了实验评价.最后,对P-BC 的经济评价和安全处置进行讨论,以提高其适用性,以期为P-BC去除水中IBP 的实际应用提供支持.
1 材料和方法
1.1 材料和化学品
生物炭的原材料来源于天津城建大学(中国天津)园林绿化所种植的法国梧桐的落叶;IBP 购自北京索莱宝科技有限公司;甲醇从甲醇是从美国Thermo Fisher Scientific 公司获得;无水乙醇和冰醋酸从上海麦克林生化股份有限公司获得;NaCl、NaNO3、Na2SO4和Na3PO4均来自天津达茂化学试剂厂.使用的所有化学品或试剂均为分析纯度或更高纯度.
1.2 生物炭的制备
法国梧桐叶片收集后用自来水和蒸馏水冲洗干净,然后置于烘箱中70 ℃条件下烘干至恒重.取烘干后的材料粉碎后过筛(50 目).取适量的叶片粉末放入坩埚中,用铝箔纸密封并置于马弗炉中,升温速率为5 ℃/min,达到最终温度600 ℃,停留时间为2 h.待生物质炭冷却至室温后,研磨并过100 目筛,然后用去离子水冲洗几次,之后烘干并密封保存,命名为P-BC.
1.3 生物炭的表征
使用扫描电镜(SEM,JSM-7800F,Japan)观察生物炭的形貌结构.生物炭的表面官能团采用傅里叶变换红外(FTIR)光谱仪(NiciletiS10,USA)进行分析,在400~4 000 cm-1区域内以4 cm-1的分辨率进行32 次扫描.在573.15 K 下真空脱气6 h 后,使用比表面积和孔隙率分析仪(Tristar II 3020,USA)在77 K 下通过N2吸附/解吸等温线测定比表面积和孔隙体积.将生物炭在800 ℃加热4 h 后,通过计算前后质量损失来确定灰分含量. 利用元素分析仪(Vario EL cube,Germany)测定生物炭的碳、氢、氮的含量,根据质量守恒计算出氧的含量.通过Zeta 电位分析仪(Zetasizer Nano ZS,Malvern,UK)测定了生物炭在不同pH 下的zeta 电位.
1.4 吸附实验
将IBP 溶解在超纯水中配制质量浓度为20 mg/L的储备液.在250 mL 锥形瓶中装入100 mL 初始质量浓度为2 000 μg/L(由母液稀释)的IBP 水溶液,之后投加0.1 g P-BC,在25 ℃、150 r/min 恒温摇床振荡24 h后取样测定IBP 含量.
1.4.1 溶液pH 值的影响
取0.1 g P-BC 于100 mL 初始质量浓度为2 000 μg/L 的IBP 溶液中,溶液pH 值用1 mol/L 的HCl 和1 mol/L 的NaOH 分别调为2,3,4,5,6,7 和8,在25 ℃、150 r/min 恒温摇床振荡24 h 后取样测定IBP 含量.
1.4.2 吸附剂剂量的影响
分别取0.01,0.05,0.10,0.12,0.15 和0.20 g P-BC于100 mL 初始质量浓度为2 000 μg/L、pH 值为2 的IBP 溶液中,在25 ℃、150 r/min 恒温摇床振荡24 h 后取样测定IBP 含量.
1.4.3 共存离子的影响
取0.1 g P-BC 于100 mL 初始质量浓度为2 000 μg/L、pH 值为2 的IBP 溶液中,溶液中分别加入0.01 mol/L 的NaCl、NaNO3、Na2SO4、Na3PO4,在25 ℃、150 r/min恒温摇床振荡24 h 后取样测定IBP 含量.
重复上述操作步骤,在溶液中分别加入0.001,0.01,0.1 mol/L 的NaCl,吸附后取样测定IBP 含量.
1.4.4 再生实验
取0.1 g P-BC 于100 mL 初始质量浓度为2 000 μg/L、pH 值为2 的IBP 溶液中,在25 ℃、150 r/min 恒温摇床振荡24 h 后取样测定IBP 含量.将吸附后的生物炭用少量乙醇超声清洗2 次,每次5 min,用去离子水多冲洗几次后放入烘箱中烘干,然后再重复上述再生过程5 次.
吸附后用0.22 μm 的有机膜过滤溶液,用超高效液相色谱仪进行检测,采用C18 柱(3.5 μm,2.1 mm×100 mm)以及紫外-可见检测,波长为220 nm.使用超纯水-1%冰乙酸∶甲醇=3 ∶7(体积比)作为流动相进行低压梯度洗脱,总流速为0.4 mL/min.采用3 组平行实验,检测结果取平均值.P-BC 对IBP 的去除效率和平衡吸附容量由方程式(1)和(2)计算.
式中:R为IBP 的去除效率,%;C0为IBP 的初始质量浓度,μg/L;Ce为吸附平衡时IBP 的质量浓度,μg/L.
式中:qe为吸附平衡时生物炭的吸附容量,μg/g;m为生物炭的质量,g;V为IBP 溶液的体积,L.
1.5 吸附动力学
伪一级、伪二级、Elovich 和粒子内扩散动力学模型用于评估本研究中的吸附动力学,并分别通过方程式(3)、(4)、(5)和(6)计算.
式中:qt为在时间t(min)时P-BC 吸附IBP 的量(μg/g);qe为在吸附平衡时P-BC 吸附IBP 的量,μg/g;k1和k2分别为伪一级动力学速率常数min-1和伪二级动力学的速率常数,g·μg-1·min-1;a为化学吸附的速率常数;b为表面覆盖率常数;ki为粒子内扩散速率常数,μg·g-1·min-0.5;Ci为常数(μg/g).
1.6 吸附等温线
为了进一步探索P-BC 的吸附机理,采用Langmuir、Freundlich、Temkin 和Redlich-Peterson 模型对P-BC的吸附容量进行了评估,并分别用方程式(7)、(8)、(9)和(10)计算.
式中:Qe为P-BC 在吸附平衡时吸附IBP 的量,μg/g;Qm为IBP 的最大吸附量,μg/g;KL为朗缪尔常数,L/μg;Ce为IBP 的平衡质量浓度,μg/L;KF是一个常数,代表P-BC 的吸附能力;1/n为一个常数,表示吸附强度;R和bT分别为通用气体常数(8.314 J·mol-1·K-1)和Temkin 常数;T为以开尔文表示的温度;KT是与键的最大能量有关的平衡常数;KR、aR和βR为Redlich-Peterson 常数,指数βR介于0 和1 之间.
2 结果与讨论
2.1 生物炭的理化性质
在600 ℃条件下热解制备了法国梧桐叶片生物炭,生物炭的产率为34.3%,原因可能是大多数纤维素和半纤维素在较高温度下分解导致产率较低[23].法国梧桐叶片和P-BC 的元素组成(即C、H、O 和N)如表1 所示. 法国梧桐叶片经过600 ℃热解后,C 含量增加,H、O 和N 的含量减少.O/C、H/C 和(N+O)/C 的比值是亲水性、芳香性和极性的指标,O/C、H/C 和(N+O)/C 的比值降低说明法国梧桐叶片的热解是一个亲水性和极性降低而芳香性增加的过程[24].

表1 梧桐叶片和P-BC 的理化性质
图1 所示为P-BC 的扫描电镜图.从图1(a)和图1(b)可以看出,P-BC 的表面粗糙,具有不规则的堆积结构和排列不规则的孔隙结构,这增加了P-BC 表面的活性吸附位点.从图1(c)和图1(d)可以看出,一些不规则状物质出现在P-BC 的表面,这证明IBP 分子被吸附在这个特殊的表面上.

图1 P-BC 的扫描电镜图
P-BC 的傅里叶变换红外光谱图如图2 所示. 由图2 可见,在3 400 cm-1处有宽且尖锐的峰,表明PBC 含有—OH 官能团;2 800~3 000 cm-1以及1 390 cm-1附近为饱和C—H 的伸缩振动峰;1 630 cm-1处可能为C=C 的伸缩振动峰;1 000~1 100 cm-1附近可能是有C—O 伸缩振动引起的,870 cm-1附近为芳香族化合物[19,25].P-BC 吸附IBP 后在3 400 cm-1处的—OH 吸收振动峰减弱.1 390 cm-1处的C—H 吸收振动峰减弱并且有轻微的偏移,880 cm-1处的芳香族化合物吸收振动峰减弱,表明—OH、C—H 和芳香族化合物在P-BC对IBP 的吸附中起关键作用[26].
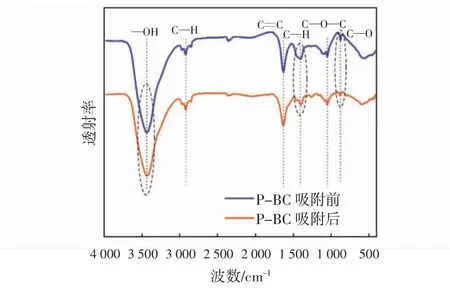
图2 P-BC 吸附IBP 前后的FTIR 红外光谱图
2.2 吸附实验
2.2.1 溶液pH 值的影响
不同pH 值对P-BC 吸附IBP 的影响如图3 所示.由图3 可以看出,在pH=2 时P-BC 对IBP 的去除率高达96.34%,随着pH 的增加,P-BC 对IBP 的去除率迅速下降.这是由于吸附剂的pHzpc和IBP 的pKa这两个因素影响的.IBP 的pKa=4.91,用zeta 电位仪测定得到了P-BC 的pHzpc=3.37,如图4 所示.pH 会影响溶液中离子存在的化学形态,通过表面官能团的质子化改变生物炭表面的电荷.当溶液的pH 值小于P-BC的pHzpc时,P-BC 表面会产生正电荷;当溶液的pH 值大于P-BC 的pHzpc,P-BC 表面会产生负电荷[27].因此,当pH 值小于IBP 的pKa时,非电离的IBP 与生物炭表面发生强相互作用[28];当pH 值大于IBP 的pKa时,IBP 以羧酸阴离子(R-COO-)形式存在的比例逐渐增加,随着pH 值增大,生物炭表面与羧酸阴离子的静电斥力增加,导致去除率降低[29].

图3 溶液pH 值对P-BC 吸附IBP 的影响
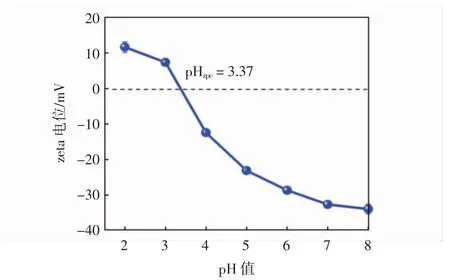
图4 P-BC 的zeta 电位分析
2.2.2 吸附剂剂量的影响
吸附剂剂量对IBP 吸附的影响结果如图5 所示.由图5 可见,当P-BC 的剂量从0.1 g/L 提高到1.0 g/L时,IBP 的去除率迅速增加,并且在剂量为1.0 g/L 时,IBP 的去除率高达94.50%,之后随着剂量增加,IBP 的去除率继续缓慢上升,当剂量达到2.0 g/L 时,IBP 未检出.这可以解释为随着P-BC 剂量的增加,用于吸附IBP 的活性位点增加,但是随着剂量不断增加,吸附剂的活性位点重叠,导致吸附效率大打折扣[30].因此考虑到去除效率以及经济性问题,该实验选取1.0 g/L 为P-BC 最佳剂量.

图5 P-BC 投加量对IBP 吸附的影响
2.2.3 共存离子的影响
实际废水中会存在很多盐类物质,不仅含有目标离子,还有许多其他共存离子,这些离子可能会影响吸附剂的吸附能力.为了研究共存阴离子对IBP 吸附的影响,选取浓度为0.01 mol/L 的Cl-、NO3-、SO42-、PO43-进行间歇吸附实验,吸附情况如图6(a)所示. 由图6(a)可知,Cl-和NO3-对P-BC 吸附IBP 干扰很小,SO42-的存在会减少生物炭对IBP 的吸附.在PO43-存在的条件下P-BC 对IBP 的吸附能力下降至448 μg/g,这可能是因为加入Na3PO4后溶液的pH 值从2.0 增加至7.9,由于静电斥力抑制了P-BC 对IBP 的吸附.为了探究离子强度对P-BC 吸附IBP 的影响,采用0.001 mol/L、0.010 mol/L、0.100 mol/L 这3 种浓度的NaCl 溶液进行探究,结果如图6(b)所示. 从图6(b)中可以看出,NaCl 溶液促进了P-BC 对IBP 的吸附,原因可能是发生了盐析效应,溶液中的共存离子会通过与水分子结合来与IBP 竞争吸附位点,减弱IBP 与水分子之间形成氢键,导致IBP 在水溶液中的溶解度降低,溶解度降低有助于IBP 在P-BC 表面扩散,增加了P-BC 对IBP 的吸附[31].
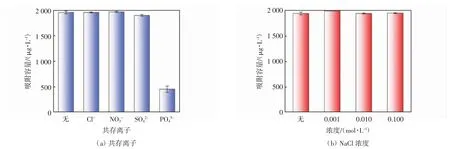
图6 不同共存离子和NaCl 浓度对P-BC 吸附IBP 的影响
2.3 吸附动力学
P-BC 对IBP 的吸附动力学拟合曲线和参数如图7 和表2 所示.通过实验数据拟合了伪一级、伪二级、elovich 和粒子内扩散动力学模型.由图7 和表2可知,P-BC 对IBP 的吸附量随时间增加,在前60 min 发生快速吸附,1 440 min 后吸附达到平衡;伪一级动力学模型qe与吸附实验值差距较大,而伪二级动力学模型qe与实验值非常接近.另外伪一级动力学模型的相关系数R2为0.973,伪二级动力学模型的相关系数R2为0.999,说明P-BC 对IBP 的吸附过程更符合伪二级动力学,吸附速率主要受化学吸附控制.

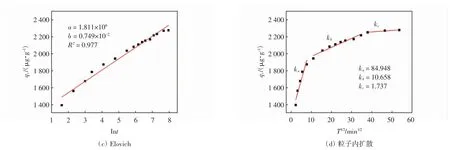
图7 P-BC 对IBP 的伪一级、伪二级、Elovich 和粒子内扩散动力学

表2 P-BC 吸附IBP 的伪一级、伪二级、Elovich 和粒子内扩散动力学参数
2.4 吸附等温线
IBP 在P-BC 上的吸附等温线拟合曲线和参数如图8 和表3 所示.Langmuir 模型基于以下假设:吸附发生在均质表面上的完整单层中,Freundlich 等温线用于描述非均相和可逆多层吸附,吸附分子之间发生横向相互作用[32]. Langmuir 模型的相关系数R2为0.996,Freundlich 模型的相关系数R2为0.989,因此Langmuir 模型更适合用来描述P-BC 对IBP 的吸附,同时也说明P-BC 均质表面上发生的是单层吸附.P-BC 对IBP 的吸附量随着平衡浓度的增加而增大,根据Langmuir 模型的拟合结果得出P-BC 对IBP 的理论最大吸附容量为10 410 μg/L.
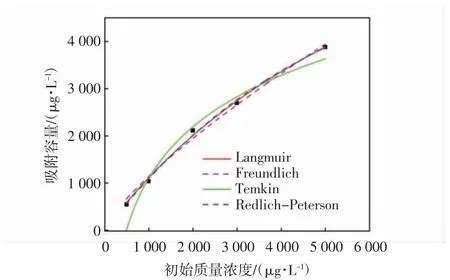
图8 P-BC 对IBP 的吸附等温线

表3 P-BC 吸附IBP 的Langmuir、Freundlich、Temkin 和Redlich-Peterson 模型参数
2.5 吸附机制
由于pH 值对吸附的影响明显,所以溶液pH 值在IBP 的吸附中起着关键性的作用.在pH=2 时,IBP 主要以分子的形式存在,摩尔分数超过99%,在pH 值>4 时,IBP 逐渐变成阴离子的形式,在pH=4 和pH=5时分别占比11%和55%,当pH=7 时,IBP 阴离子的形式(摩尔分数)超过99%[33].当溶液pH 值小于P-BC的pHzpc,P-BC 表面带正电荷,另外溶液中存在较多H+,质子化的IBP 很容易与溶液中的H+结合,与P-BC 形成静电斥力,然而此时氢键作用力要强于静电斥力[34].当溶液pH 值大于P-BC 的pHzpc,P-BC 表面酸性基团电离,给表面带负电荷,IBP 阴离子形式存在的比例逐渐增加,此时静电斥力占主导地位,导致吸附效率下降.值得注意的是,在pH=6 时,生物炭表面的酚羟基不会电离,它们可以与IBP 及其羧酸阴离子形成氢键,因此在pH=6 时出现吸附峰[29].另外,根据红外光谱分析,—OH 官能团参与了IBP 的吸附.综上,P-BC表面的—OH 官能团能作为供体和受体与IBP 形成氢键,这是P-BC 吸附IBP 的主要机理.
2.6 循环再生
为了评估生物炭重复使用性,对P-BC 进行了5次循环吸附实验.由于IBP 在有机溶剂中有较高的溶解度,选用无水乙醇作为洗脱液,图9 所示为P-BC 通过无水乙醇再生循环吸附IBP.从图9 可以看出,用无水乙醇作为洗脱液时,5 次循环吸附对IBP 的去除率分别为93.42%、93.22%、89.95%、72.25% 和70.32%.P-BC 在循环吸附5 次后对IBP 的去除效率有所下降,但仍处于一个较高的水平.这种可重复使用性是其低成本的一个优势,提高了其应用潜力.

图9 P-BC 通过无水乙醇再生循环吸附IBP
3 结 论
本实验通过高温热解法在600 ℃条件下制备了法国梧桐叶片生物炭,并且高效地去除了水中的IBP.伪二级动力学表明P-BC 对IBP 的吸附主要是化学吸附,吸附机制主要是氢键作用.此外,等温线模型中的Langmuir 模型能更好地描述P-BC 对IBP 的吸附,通过Langmuir 模型拟合得到P-BC 对IBP 的最大吸附容量为10 410 μg/L.在最适pH 值下P-BC 对质量浓度为2 000 μg/L 的IBP 去除率高达96.34%.通过乙醇再生循环吸附五次后对IBP 的去除率下降至70.32%,但吸附效率仍较高且稳定.因此,P-BC 是一种用于去除水中IBP 的低成本、环境友好、吸附效果高效且稳定的绿色材料.

