基于腰椎定量CT分析强直性脊柱炎合并肌少症危险因素
陶 超,吴树剑,洪 薇,陈鹏飞,王蓓蓓,俞咏梅
(皖南医学院第一附属医院放射科,安徽 芜湖 241001)
强直性脊柱炎(ankylosing spondylitis, AS)为好发于青壮年男性的慢性炎症性疾病,易累及骶髂关节、脊柱及椎旁软组织[1]。肌少症为渐进性、全身性骨骼肌疾病,可导致肌肉质量减少及功能丧失,影响患者活动能力;在AS患者中发病率约20%~35%[2-3]。早期评估AS合并肌少症非常重要。诊断肌少症需依靠肌肉数量、肌肉力量、肌肉质量及躯体功能等参数[4-5]。定量CT(quantitative CT, QCT)为无创、可重复性强的三维影像技术,能够较为精准地对肌肉、脂肪及骨密度进行定量分析[6]。本研究基于腰椎QCT参数分析AS合并肌少症的危险因素。
1 资料与方法
1.1 研究对象 前瞻性收集2022年5月—12月100例皖南医学院第一附属医院收治的AS患者,男75例、女25例,年龄16~58岁、平均(37.7±11.8)岁。纳入标准:①符合美国风湿病协会AS诊断标准[7];②接受腰椎QCT检查;③QCT检查后1周内检测红细胞沉降率(erythrocyte sedimentation rate, ESR)及C反应蛋白(C reactive protein, CRP);④临床资料完整。排除标准:①QCT图像质量不佳;②既往L1、L2椎体手术史;③合并恶性肿瘤;④接受系统的运动疗法。同时,选择100名性别、年龄相匹配的健康体检者为对照组,男75例、女25例,年龄14~59岁,平均(37.6±10.4)岁。本研究经院伦理委员会批准[(2022)伦审研第(17)号],所有受试者检查前均签署知情同意书。
1.2 仪器与方法 采用Philips Brilliance 64排CT仪、美国Mindways QCT PRO 5.0.V系统及欧洲脊柱质量控制体模。嘱患者仰卧,自L1上缘至L3下缘,以含QCT PRO标识的序列进行扫描;参数:管电压120 kV,自适应管电流,螺距1.375,FOV 50 cm,矩阵512×512,层厚及层间距均为5 mm。扫描结束后以层厚、层间距均为1.25 mm重建图像,并传输至Mindways QCT工作站进行存储、处理。
1.3 测量相关参数 由具有3年及8年工作经验的放射科医师各1名分别测量QCT参数,包括腰椎骨密度(bone mineral density, BMD)、L3骨骼肌面积(skeletal muscle area, SMA)、椎后肌群脂肪浸润(muscle fat infiltration, MFI)程度及竖脊肌CT脂肪百分数(CT fat fraction, CTFF);意见不一致时经协商决定。
1.3.1 腰椎BMD 采用3D spine exam analysis模块测量L1、L2椎体BMD,于椎体中心区域勾画ROI(图1A),以L1、L2椎体BMD平均值为腰椎BMD;以BMD≤80 mg/cm2为骨质疏松症,BMD>80 mg/cm2为非骨质疏松症[8]。
1.3.2 L3 SMA 采用“tissue composition”模块于L3椎体中部轴位图中沿骨骼肌边缘勾画ROI(图1B);计算L3骨骼肌指数(skeletal muscle index, SMI):L3 SMI=L3 SMA/身高2。以男性L3 SMI<44.77 cm2/m2、女性L3 SMI<32.50 cm2/m2为标准诊断肌少症[9],由此将AS组患者归入肌少症亚组(n=26)或非肌少症亚组(n=74)。
1.3.3 椎后肌群MFI 采用“tissue composition”模块于L3椎体中部轴位图中沿椎后肌群边缘勾画ROI(图1C);计算椎后肌群MFI:MFI=脂肪面积(fat area, FA)/[肌肉面积(muscle area, MA)+FA]×100%。
1.3.4 竖脊肌CTFF 采用“measure muscle fat”模块于L3椎体中部轴位图中双侧竖脊肌选取密度相对均质区域勾画ROI(图1D),单侧ROI面积为90~110 mm2,计算双侧竖脊肌平均CTFF。
1.4 统计学分析 采用SPSS 26.0统计分析软件。以Kolmogorov-Smirnov检验进行正态性分析。以±s表示符合正态分布的计量资料,组间行独立样本t检验;以中位数(上下四分位数)表示非正态分布的计量资料,组间行Mann-WhitneyU检验。以频数表示计数资料,组间行χ2检验。以Pearson或Spearman相关分析观察AS组病程、体质量指数(body mass index, BMI)、腰椎BMD、椎后肌群MFI及竖脊肌CTFF与L3 SMI的相关性:│r│≥0.8为高度相关,0.5≤│r│<0.8为中度相关,0.3≤│r│<0.5为低度相关,0<│r│<0.3为弱相关。构建多因素logistic回归模型,分析影响AS合并肌少症的独立因素。P<0.05为差异有统计学意义。
2 结果
2.1 组间比较 AS组腰椎BMD、L3 SMI及椎后肌群MA均低于(P均<0.05),而椎后肌群FA、MFI及竖脊肌CTFF均高于对照组(P均<0.05);组间受试者性别、年龄均无统计学差异(P均>0.05)。见表1。
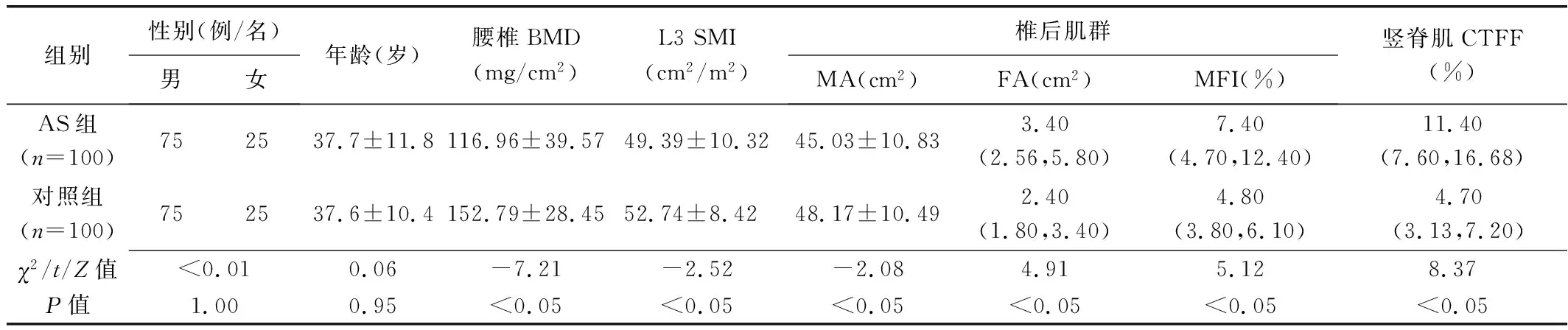
表1 AS患者与健康人一般资料及QCT参数比较
2.2 AS组内比较 AS组内肌少症亚组BMI及腰椎BMD均低于非肌少症亚组(P均<0.05),而病程、椎后肌群MFI及竖脊肌CTFF均高于非肌少症亚组(P均<0.05);2亚组间患者年龄、ESR及CRP均无统计学差异(P均>0.05)。见表2。
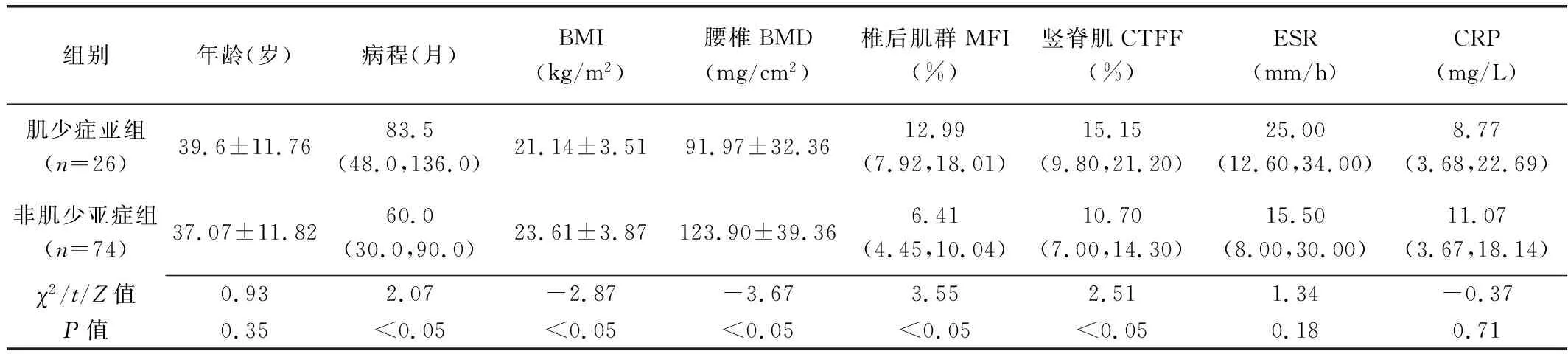
表2 合并肌少症与未合并肌少症AS患者一般资料及QCT参数比较
2.3 相关性分析 AS组中,BMI及腰椎BMD均与L3 SMI呈低度或弱正相关(r=0.42、0.22,P均<0.05);椎后肌群MFI及竖脊肌CTFF均与L3 SMI呈低度或弱负相关(r=-0.45、-0.26,P均<0.05);AS病程与L3 SMI无明显相关性(P=0.58)。
2.4 多因素logistic回归分析 将病程、BMI、腰椎BMD、椎后肌群MFI及竖脊肌CTFF纳入多因素logistic回归分析,结果显示骨质疏松症(腰椎BMD≤80 mg)是AS合并肌少症的独立危险因素(P<0.05),低BMI为其保护因素(P<0.05),见表3。

表3 多因素logistic回归分析结果显示AS患者合并肌少症的独立影响因素
3 讨论
目前对于AS合并肌少症的发病机制尚不明确,可能与骨质流失及疾病活动期有关[10]。本研究AS患者肌少症发病率为26.00%(26/100),与既往研究[2-3]结果相符;且AS组腰椎BMD明显低于对照组,提示骨质疏松症(腰椎BMD≤80 mg/cm2)为AS合并肌少症的独立危险因素;原因可能在于AS患者长期处于慢性炎症状态,促炎性细胞因子升高并通过内分泌、旁分泌等多种途径共同导致骨质疏松及肌少症[11]。BMI可反映机体营养状态。本研究AS组患者BMI与L3 SMI呈低度正相关,低BMI AS患者可能肌肉质量更差、肌肉丢失更多,即低BMI为AS合并肌少症的保护因素。临床制定AS诊疗方案时,应在积极控制炎症的基础上关注BMD及BMI。
有学者[12]指出,QCT评估椎后肌群及椎旁肌MFI的准确性较高。本研究采用QCT定量分析AS患者肌肉及脂肪含量,发现AS组椎后肌群MFI及竖脊肌CTFF均高于对照组且与L3 SMI呈负相关,提示AS可致椎后肌群脂肪化,尤其在L3 SMI较低者;分析原因,可能在于AS使肿瘤坏死因子-α升高、骨骼肌蛋白质分解与合成代谢失衡,进而导致肌纤维变细、胶原纤维及脂肪组织增多[13];且AS常致腰背部肌肉痉挛、僵硬,患者为避免疼痛而减少活动,使肌肉萎缩及脂肪化加重[14]。
ÖZTÜRK等[15]报道,相比非肌少症,肌少症患者ESR及CRP更高。本研究AS组中肌少症亚组与非肌少症亚组ESR及CRP无明显差异,可能与ESR及CRP易受个体差异及AS是否处于活动期影响、且在AS病程较长时对疾病是否处于活动期无明显提示作用有关。
综上,骨质疏松症是AS合并肌少症的独立危险因素。本研究的主要局限性:①为单中心研究,样本量有限;②手动勾画ROI可能存在一定误差;③目前诊断肌少症尚缺乏统一标准;④对于L3椎体层面肌肉量与全身肌肉量是否具有良好一致性有待进一步观察。

