临床资料及超声表现鉴别诊断儿童腹膜后混杂型与结节型节细胞神经母细胞瘤
贺 爽,汪朝霞,唐 毅,顾 凯,杜逸飞,蔡文瑜,钟 艺*
(1.重庆医科大学附属儿童医院 国家儿童健康与疾病临床医学研究中心 儿童发育疾病研究教育部重点实验室 儿科学重庆市重点实验室超声医学科,2.骨科,3.肿瘤科,重庆 400014;4.首都医科大学附属北京朝阳医院新生儿科,北京 100020)
外周神经母细胞性肿瘤(peripheral neuroblastic tumor, pNT)在儿童肿瘤中约占8%~10%,好发于腹膜后[1-2]。神经母细胞性肿瘤中,节细胞神经母细胞瘤(ganglioneuroblastoma, GNB)约占20%[3],具有中等恶性潜能[1],主要分为混杂型(GNB-intermixed, GNBi)和结节型(GNB-nodular, GNBn);主要治疗方式为手术切除辅以化学治疗[4]。研究[5]发现,GNBi与节细胞神经瘤(ganglioneuroma, GN)具有部分类似的临床和生物学特征,且均有良好的组织学特征、预后良好;但手术治疗GNBi并发症发生率可达20%~30%[6],确诊后以随访观察为主,故术前准确鉴别GNBi与GNBn具有重要临床意义。本研究观察临床资料及超声表现鉴别儿童腹膜后GNBi与GNBn的价值。
1 资料与方法
1.1 研究对象 回顾性分析2012年5月—2023年3月73例重庆医科大学附属儿童医院初诊腹膜后GNB患儿,男33例、女40例,年龄7个月~12岁、中位年龄36个月;根据病理结果将其分为GNBi组(n=42)和GNBn组(n=31):GNBi组男20例、女22例,年龄11个月~10岁、中位年龄48个月,GNBn组男13例、女18例,年龄7个月~12岁、中位年龄36个月;临床表现包括发热(GNBi 11例、GNBn 11例)、腹痛(GNBi 18例、GNBn 10例)、腹胀(GNBi 3例、GNBn 5例)、腹部包块(GNBi 7例、GNBn 2例)、四肢疼痛(GNBi 4例)及腹泻(GNBn 1例)。排除标准:①曾接受放射、化学治疗或手术治疗;②图像质量不佳。本研究获院伦理委员会批准[(2023)年伦审(研)第(422)号]。
1.2 仪器与方法 采用Philips iU22、GE Logiq E9及GE E80等彩色多普勒超声诊断仪、频率3~5 MHz腹部探头。使患儿侧卧或仰卧,充分暴露腹部,扫查并记录GNB病灶形态(类圆形/浅分叶状/分叶状/结节状/不规则)、最大径、边界(清楚/模糊)、有无液化、是否包绕腹膜后大血管、是否跨越中线、内部回声(无/低/中偏低/中等/中偏高)、是否出现钙化及钙化类型(直径≤3 mm点状或条状钙化/直径>3 mm粗大或团状钙化[7-8])等;之后以CDFI观察肿瘤内部和周边血流情况,并根据Adler血流分级进行评估[9]:0级,肿瘤内未见血流信号;Ⅰ级,少量血流,肿瘤内见点状、短棒状血流信号;Ⅱ级,中等量血流,某一切面肿瘤内可见1条主要血管(其长度超过肿瘤半径)或2~4个点状血流信号;Ⅲ级,丰富血流,肿瘤内可见4条以上血管或弥漫交织呈网状的血流信号。
1.3 实验室检查 记录治疗前尿香草基扁桃酸(vanillylmandelic acid, VMA)、血神经元特异性烯醇化酶(neuron specific enolase, NSE)及骨髓穿刺结果。
1.4 统计学分析 采用SPSS 26.0统计分析软件。以中位数(上下四分位数)表示非正态分布的计量资料,组间行非参数检验;以频数表示计数资料,组间行χ2检验或Fisher精确概率法。行二元logistic回归分析,绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评估临床及超声资料鉴别GNB病理类型的价值。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 组间血NSE及骨髓穿刺结果差异均有统计学意义(P均<0.05),见表1。
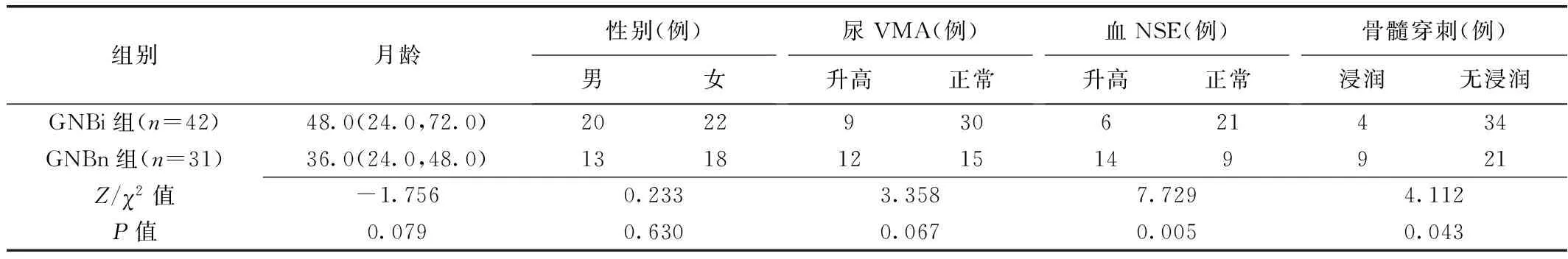
表1 腹膜后GNBi与GNBn患儿临床资料比较
2.2 超声表现 组间肿瘤钙化类型及Adler血流分级差异均有统计学意义(P均<0.05),见图1~4及表2。

图1 GNBi患儿,女,2岁10个月 声像图示右侧腹膜后低回声肿块,内见点状强回声钙化(箭) 图2 GNBn患儿,女,4岁9个月 声像图示右侧腹膜后低回声肿块,内见粗大强回声钙化(箭) 图3 GNBi患儿,女,1岁10个月 CDFI示左侧腹膜后肿瘤内部Alder血流Ⅰ级 图4 GNBn患儿,男,4岁3个月 CDFI示左侧腹膜后肿瘤内部Alder血流Ⅲ级

表2 儿童腹膜后GNBi与GNBn超声表现比较
2.3 ROC曲线 以病理结果为金标准,基于年龄、肿瘤钙化类型及Alder血流分级行二元logistic回归分析;单一以上述3项参数及其联合鉴别GNB病理亚型的AUC分别为0.619、0.702、0.611及0.864,后者大于前三者(P均<0.05)。见图5。
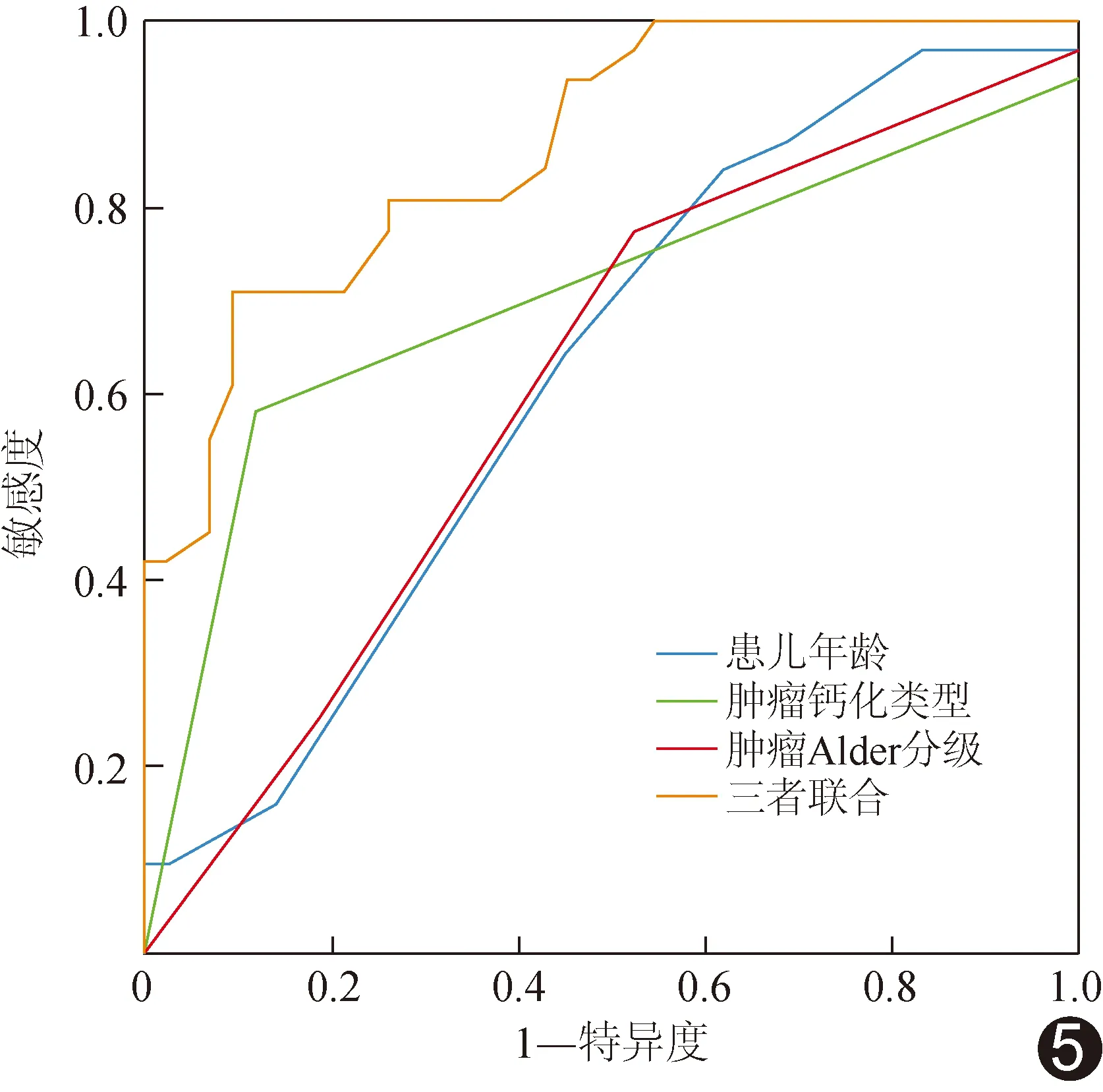
图5 单一以年龄、肿瘤钙化类型及Alder血流分级及其联合鉴别儿童腹膜后GNBi与GNBn的ROC曲线
3 讨论
GNB是起源于神经嵴交感神经细胞的恶性肿瘤,组织病理学上分为GNBi和GNBn,具有不同的生物学、病理和临床特点;临床一般对GNBi予以观察随访,而对GNBn则行手术切除辅以化学治疗。
HE等[10]报道,GNBi和GNBn患儿确诊中位年龄分别为47.5、38.4个月,且差异有统计学意义;并认为患儿年龄越小,GNBn可能性越高。本研究GNBi、GNBn患儿中位年龄分别为48个月和36个月。
NSE存在于神经组织和神经内分泌组织中,测定血NSE对于早期诊断神经母细胞性肿瘤、监测疗效及判断有无复发等均有较高临床价值[11]。本研究中,GNBn组血NSE升高占比高于GNBi组,可能原因在于相比GNBi,GNBn中活性神经组织更多、恶性程度更高;GNBn组骨髓浸润占比亦高于GNBi组,亦与GNBn恶性程度高、更易发生转移有关。以上结果提示,血NSE及骨髓穿刺结果可作为鉴别GNB类型的参考,发现血NSE升高和/或骨髓浸润时,GNBn可能性更大。
肿瘤钙化的原因在于其生长较快而血供相对不足导致细胞坏死,继而形成钙化复合体结构[12]。既往研究[13]认为神经母细胞性肿瘤钙化类型及形态与其性质相关:肿瘤恶性程度越高、生长越快、钙化复合体越大,而点状、针尖状钙化则提示良性可能。肿瘤血管生成可提供肿瘤组织代谢所需氧气和营养,同时为其远处转移提供能量[14-15]。本研究结果显示组间肿瘤钙化类型和Alder血流分级差异有统计学意义,即GNBn恶性程度更高、更易发生转移、内部血管生成更多,而GNBi恶性程度较低,Alder血流分级多为Ⅰ、Ⅱ级。
本研究单一以年龄、肿瘤钙化类型及Alder血流分级及其联合鉴别GNB病理亚型的AUC分别为0.619、0.702、0.611及0.864,以三者联合的AUC最大。
综上所述,年龄、肿瘤钙化类型及Alder血流分级联合有助于鉴别儿童腹膜后GNBi与GNBn。本研究的主要不足:①为单中心、小样本回顾性分析;②仅纳入腹膜后GNB患儿;③部分病例未接受全部检查;有待后续深入探讨。

