腮腺分泌性癌1例并文献复习
李远志 曾勇明 刘 强 娄 豪 韦 桅
(1 重庆宏仁一医院放射科,重庆 408400;2 重庆宏仁一医院病理科,重庆 408400)
腮腺分泌性癌是一种少见的低度恶性唾液腺肿瘤。目前该病的文献报道较少。本文通过报道1例青年男性囊实性腮腺分泌性癌病例,并复习相关文献,旨在提高对本病的认识。
1 病历资料
患者男性,32岁,患者自述入院前5年前,无意间发现左侧耳后包块,约胡豆大小,局部无压痛,质中,边界清楚,活动度可,无红肿,无皮肤凹陷,无橘皮样改变,无全身自觉症状,未予重视,未治疗。入院查体:体温36.6 ℃,脉搏76次/分,呼吸20次/分,血压126/76 mm Hg;神智清楚,营养良好,正常步入病房,自动体位,回答切题,查体合作;皮肤及巩膜无黄染,无贫血貌,全身浅表淋巴结无肿大,颈部软,无颈静脉怒张,颈静脉回流征阴性,甲状腺不肿大;心率齐,各瓣膜听诊区未闻及病理性杂音,双肺呼吸音清晰,未闻及干湿啰音、哮鸣音,全腹柔软,无压痛、无反跳痛,腹部未扪及包块,肝区无扣痛,肝脾肋下未扪及,肾区无叩痛。专科检查:左耳后可扪及大小2.0 cm×1.5 cm包块,质地较硬,边界清楚,活动度欠佳,局部皮肤无明显红肿。入院后完善相关检查。心电图检查:未见异常心电图表现。实验室检查:血常规、C反应蛋白、凝血功能系列、空腹血糖、肾功能、电解质、血清HIV及梅毒两项结果均在正常范围。胸部X线检查:胸部正侧位未见明显异常。彩色超声检查:左侧耳后患者所述包块处扫查,于左侧腮腺内探及到多个不均质低回声团,较大者约1.8 cm×1.3 cm,内部回声不均质,形态规则,边界尚可,内可见血流信号。超声诊断结果:左侧腮腺实性占位,混合瘤可能。CT检查:平扫示双侧腮腺、颌下腺及舌下腺形态、大小正常,密度均匀,左侧腮腺浅叶见一直径约2 cm囊实性结节影,边缘光滑、锐利,外缘与皮肤关系密切,CT值12~32 HU,密度不均匀;增强扫描后结节内实性部分呈轻度不均匀强化,动脉期CT值38 HU、静脉期CT值44 HU、延迟期CT值45 HU,呈“慢进缓出”表现,可见环形强化壁,见图1。余各涎腺未见结石及占位征象,所扫层面未见肿大淋巴结;右侧上颌窦黏膜增厚,未见增多软组织密度影;双侧中耳乳突气化良好,未见异常密度影。CT诊断结果:左侧腮腺轻度强化结节,考虑良性肿瘤性病变,多形性腺瘤可能性大。入院后次日患者在全身麻醉下行 “左腮腺肿瘤切除术”。术中所见:术中于左侧腮腺包块区域上方顺皮纹切口,长约3 cm,打开皮肤及皮下组织,发现包块位于腮腺包膜下方,打开腮腺包膜,可见大小2.0 cm×1.5 cm包块,呈囊实性,质地中等偏硬,活动度欠佳,顺包块边缘顿锐结合完整分离包块,游离并结扎包块滋养血管,取出包块。术后解剖发现包块内囊液合并腺瘤样组织。术后病理:肿瘤被纤维间隔排列呈分叶状,肿瘤细胞似在包膜浸润,并见淋巴细胞及淋巴滤泡,见图2。免疫组化结果:CK7肿瘤细胞弥漫强阳,S100肿瘤细胞弥漫强阳,见图3。术后患者经抗炎及对症治疗,恢复良好,3 d后出院。电话随访1年,未见肿瘤复发。
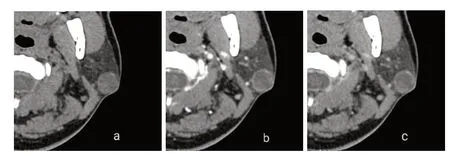
图1 腮腺分泌性癌患者术前CT图像

图2 腮腺分泌性癌患者术后病理(HE低倍放大)
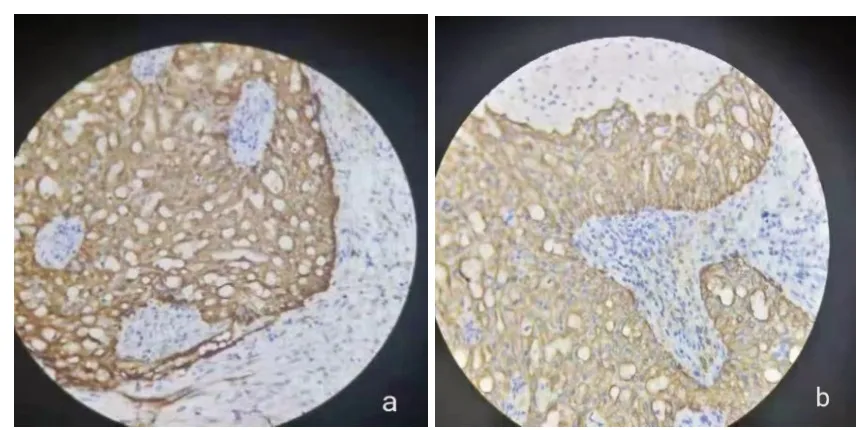
图3 腮腺分泌性癌患者术后免疫组化
2 讨论
腮腺分泌性癌也被称为腮腺乳腺样分泌性癌,因其形态学、免疫表型、分子学上与分泌型乳腺癌相似而得名,由Skálová等[1]于2010年首次报道。2017年,腮腺乳腺样分泌性癌被纳入WHO头颈部肿瘤分类中的涎腺肿瘤部分,简称为腮腺分泌性癌[2]。腮腺分泌性癌属于唾液腺分泌性癌的一种,唾液腺分泌性癌70%发生于腮腺,其余发生在颌下腺及小唾液腺。腮腺分泌性癌占所有涎腺肿瘤的比例<0.3%[3]。腮腺分泌性癌是一种低度恶性肿瘤,可发生于任何年龄,以年轻患者多见,男性较女性稍多,临床表现为无痛性、缓慢生长的肿块[4]。王松杰等[5]收集10例腮腺分泌性癌有超声、CT及MRI检查资料病例进行影像学分析,认为其影像学表现缺乏特征性。腮腺分泌性癌的诊断需组织病理和免疫组化联合诊断,部分还需借助分子学方可确诊。腮腺分泌性癌的病理组织形态与其他多种涎腺肿瘤的生长模式相近,易被误诊为腺泡细胞癌、黏液表皮样癌等。因此,腮腺分泌性癌的术前诊断尤为重要。
腮腺分泌性癌好发于青年人,以男性居多,临床表现多为无痛性肿块。本例患者为男性,年龄32岁,处于该病好发年龄段,于5年前无意间发现左耳旁无痛性包块。腮腺分泌性癌病灶的影像学表现多数以囊实性改变为主、少数为实性病变。超声、CT及MRI等影像技术均可用于腮腺分泌性癌的诊断,各自表现出不同的影像学特点。文献报道[6-7],腮腺分泌性癌的超声表现为包膜不完整的实性低回声,边界欠清晰,形态不规则,内部回声不均匀,肿块内可见钙化点,彩色多普勒血流显像示肿块内及周边均可探及血流信号。本例超声检查表现为左侧腮腺内探及到多个不均质低回声团,内部回声不均匀,形态规则,边界欠清晰,内可见血流信号。腮腺分泌性癌CT影像学表现明显无特征性。有研究表明[8],腮腺分泌性癌表现为类圆形、边界清晰的稍低密度灶,也可表现为多房性肿块,伴高级别转化时呈巨大不均质肿块影。多表现为浅分叶状,可见囊性低密度区及结节状影像。增强扫描病变实性部分呈均匀或不均匀强化,壁局部增厚并呈轻度强化,呈“快进缓出”型[9]。本病例CT检查表现:平扫示左侧腮腺浅叶见直径约2 cm囊实性结节,边缘光滑、锐利,病变外缘与皮肤关系密切,CT值12~32 HU,密度不均匀;增强扫描后病变实性部分呈轻度不均匀强化,动脉期、静脉期和延迟期CT值分别为38 HU、44 HU和45 HU,呈“慢进缓出”表现,可见环形壁,强化模式与文献报道相似。本例未行MRI检查,复习文献阐述其MRI表现。MRI检查表现为伴有乳头状突起的囊实性肿块影,T1WI呈等、高混杂信号,T2WI呈高、低混杂信号,病变内信号不均匀;囊性成分与组织学上的蛋白样囊性液体相对应,实性成分与组织学上的细胞微囊区对应[10]。DWI序列呈高信号,ADC图呈低信号。增强扫描附壁软组织结节可明显强化或无明显强化[11]。腮腺分泌性癌常因出血而伴有含铁血黄素的沉积,特征性表现为T2WI低信号[12]。除了腮腺分泌性癌的定位、定性诊断,肿瘤与面神经的关系一直是临床医师关注的问题,面神经一般从茎乳孔出颅进入腮腺实质[13],因此应在MRI多方位多序列图像上进行观察。
腮腺恶性肿瘤相对少见,由于腮腺分泌性癌的临床表现及影像学均缺乏明显特征性,因而,腮腺分泌性癌除了与腮腺恶性肿瘤相鉴别,还应与多形性腺瘤等良性肿瘤进行鉴别诊断。①黏液表皮样癌:为腮腺最常见的恶性肿瘤,临床症状主要为无痛性肿块。CT检查低分化黏液表皮样癌多为密度不均匀的软组织肿块,内部可出现液化坏死和钙化,病变呈侵袭性生长,增强后强化明显。MRI的T2WI呈不均匀低等信号,低级别的黏液表皮样癌内可见高信号区域,与大量的黏液细胞存在有关[14]。②腺样囊性癌:以50~60岁中老年多见,无明显性别差异,易早期侵犯神经,患者常有自发性疼痛。CT表现低度恶性的腺样囊性癌常和良性肿瘤相似,高度恶性者为边缘不清的软组织肿块,内部可出现囊性变和坏死。增强扫描筛孔样强化,晚期常伴肺部转移[15]。③多形性腺瘤:因肿瘤中含有肿瘤性上皮组织、黏液样组织或软骨样组织,组织学形态呈显著的多形性和混合性,又称腮腺混合瘤。多形性腺瘤是最常见的腮腺良性肿瘤,占腮腺良性肿瘤的70%~80%,发病年龄较为广泛,多见于40岁左右的中年女性。早期为腮腺无痛性肿块,生长缓慢,常无自觉症状。以腮腺浅叶多见,也可位于深叶。CT表现为腮腺区的圆形或类圆形肿块,少数可呈分叶状或不规则形,边缘清楚;肿瘤较小时病灶位于腮腺实质内,肿瘤增大可占据整个腮腺;肿块密度均匀或不均匀,可合并囊变、钙化,增强后呈持续渐进性强化。MRI表现为T1WI呈低信号,T2WI多呈高信号,周边常可见T2WI低信号包膜影;其内部含有黏液样组织部分,信号常不均匀。T2WI抑脂序列显示肿瘤较清楚。
腮腺分泌性癌属于低度恶性肿瘤,目前的治疗原则多采用手术全切除,并视肿瘤局部侵袭性和淋巴结转移情况行淋巴清扫术,辅以放射性治疗,有远处转移者配合化疗,预后相对较好,局部复发率较低。部分患者可采用基因靶向治疗。总之,腮腺分泌性癌具体的临床治疗方案,需结合患者实际情况而定。
综上所述,腮腺分泌性癌的临床表现及影像学特点均缺乏明显特征性,最终确诊依靠病理检查。对腮腺分泌性癌的诊断,超声、CT能起到定位及初步定性作用,清晰显示腮腺肿块的大小、形态、增强特征、内部回声、血流成像及与周边组织的位置关系;常规MRI的诊断作用不容忽视,能够提供重要的形态学特征。总之,影像学检查有助于提高腮腺分泌性癌诊断的准确性,为临床提供重要信息,对预测疾病的发展、制订治疗计划和评估预后等方面有重要价值。

