磷对苦草种子及幼苗生长和根系泌氧的影响
李冠廷,张永婷,孙文正,徐东昱*,瞿小杰
(1.中国水利水电科学研究院水生态环境研究所,北京 100038;2.甘肃省地矿局四勘院,甘肃酒泉 735000;3.梧州学院食品与制药工程学院,广西梧州 543000)
随着当前工农业用水量的增加,我国农村黑臭水体日趋严重,其中以生活源、农业源为主体的污染是造成农村黑臭水体的主要原因[1]。农村黑臭水体中氮、磷含量远远超过了水体的自净能力,导致农村水体富营养化程度严重,水体生态平衡被破坏,引起水体富营养化[2-3]。特别是当水体中磷营养盐浓度增加时,植物的生长和分配格局被改变,这些改变对植物的形态及生理代谢具有一定的影响[4]。在植物的生长发育过程中,磷是不可或缺的营养物质之一,是植物合成酶、叶绿素等物质的基础物质,且磷亦是能量转移载体物质,能够参与到植物代谢过程、调节植物光合作用和呼吸作用,因此磷的浓度会对植物形态和生理机制产生一系列的调控性影响[5-6]。然而,过多的磷仍然能够胁迫植物的生长发育[7]。
植物修复技术是被广泛认可的治理和修复富营养化水体的有效方法[3]。沉水植物具有能够控制藻类生长、净化水质和调解物质循环等功能[8],对富营养化水体中的氮磷等污染物的去除具有明显效果。范真等[9]研究了多种湿地植物对含氮磷水体的吸附能力,发现湿地植物可以净化水体。姚瑶等[10]通过筛选研究表明,苦草可以对富磷水体进行净化。赵建成等[11]使用苦草[Vallisnerianatans(Lour.)Hara]等植物净化农村水体,其中苦草对水体中氮磷的净化效果明显。由此可见,苦草对于修复水体中氮磷含量过多具有重要意义。以往研究多聚焦于修复水体的植物选择上,而较少关注磷是否影响苦草种子的生长发育及其生理代谢。因此,该研究以苦草种子及其苗期单株为试验材料,探究富磷水体对苦草生长发育及其生理代谢的影响,为苦草净化富磷水体效果提供科学的理论依据。
1 材料与方法
1.1 试验材料该研究采用市售的已包衣苦草种子及苗期单株,并将苦草单株进行清洗,以防止枯死叶片及其根部泥土污染水体。采用磷酸二氢钾(KH2PO4)固体配制磷酸盐浓度为500 mg/L的母液,然后逐级稀释至目标浓度[12]。
1.2 试验方法
1.2.1磷酸盐对苦草种子发芽率的影响。磷酸盐浓度分别设置为0(去离子水)、10、50、100、200、300 mg/L,分别编号为Ⅰ~Ⅵ组。每组设置3个平行,并以Ⅰ组为试验对照组。用培养皿作为种子的培养容器,并使用含有不同浓度的浸湿滤纸为种子提供磷营养盐,且每天定时用滴管给种子添加对应浓度的磷酸盐溶液,以保持滤纸的湿润。种子发芽试验共进行12 d[13]。分别在0、3、6、9、12 d的固定时间观察并记录种子发芽率及根长。试验初期对种子进行遮光处理,后期给予种子一定的光照,但要防止强光损伤种子。
1.2.2磷酸盐对苦草单株生理指标的影响。选取生长状态良好、生长发育情况相似的单株,去除黄叶枯叶反复洗净后分别放入编号为Ⅰ~Ⅵ的烧杯中,并在烧杯中加入250 mL的磷酸盐溶液,浓度同种子发芽试验,每组处理设置3个平行。试验共进行20 d,每隔5 d取样一次,测定溶液中PO43--P浓度以及植株叶片的生理代谢参数(主要包括叶绿素和丙二醛含量)。每次取样后添加去离子水补充取样、蒸发、植物蒸腾所消耗的水分。
1.2.3苦草根际泌氧分析。苦草根际泌氧情况以及根周pH使用平面光极技术(PO)[14]对苦草根际周围O2和pH分布进行拍照成像,首先是调节灯与苦草之间的距离,设置光强参数,其次将苦草容器前窗替换为O2偏光器和pH偏光器窗,接着保持环境的黑暗进行拍照成像,并用ImageJ软件绘制O2和pH的二维分布图,观察植物根系泌氧和泌酸的过程。
1.3 生理参数测定
1.3.1磷酸盐浓度的测定。溶液中磷酸盐浓度采用《水和废水监测分析方法》(第四版)中钼锑抗分光光度法[15]测定。
1.3.2叶绿素含量的测定。叶绿素含量的测定参考刘湘庆等[16]的方法。具体如下:选取成熟的苦草叶片,将叶片用去离子水冲洗干净后吸干表面水分,称取0.1 g的叶片并将其剪碎成长宽均约为2 mm的碎块后放入50 mL试管中,加入25 mL叶绿素提取剂(丙酮、无水乙醇和去离子水按4.5∶4.5∶1混合配制),盖上盖子,避光浸提24 h,以提取剂作为空白,分别在663和645 nm波长下测定其吸光度。并根据以下公式计算叶绿素a、叶绿素b浓度(mg/L):
Chl a=12.72A633-2.69A645
(1)
Chl b=22.80A645-4.67A663
(2)
在得到叶绿素的浓度后,再按下式计算组织中鲜重的各种色素的含量:
(3)
式中:W为叶绿素含量(mg/g);Chl为色素浓度(mg/L);v为提取液体积(mL);n为稀释倍数;g为样品鲜重(g)。
1.3.3丙二醛(MDA)含量的测定。MDA含量的测定参考张琼等[17]的方法。具体如下:称0.5 g叶片于研磨钵中,然后加入2 mL l0%的三氯乙酸(TCA)和少量石英砂研磨至匀浆,匀浆以4 000 r/min的速度离心10 min,然后吸取上清液2 mL(对照为2 mL去离子水),之后加入2 mL 0.6%硫代巴比妥酸(TBA)溶液,于沸水浴中反应15 min,迅速冷却后再离心10 min。用紫外分光光度计在450、532、600 nm波长下测定上清液吸光度。MDA含量计算公式如下:
C=6.45(A532-A600)-0.56A450
(4)
式中:C为MDA含量(μmol/L);A532、A600、A450分别为波长532、600、450 nm处的吸光度。
1.4 数据分析采用SPSS软件进行数据分析和origin软件进行图形绘制。
2 结果与分析
2.1 磷酸盐对苦草种子发芽率的影响从图1可以看出,各个处理组种子发芽率随时间的增加而逐步上升,在0~6 d时,各组种子发芽速率较高,在6 d时Ⅰ~Ⅵ组发芽率分别为70%、70%、80%、83%、77%、73%,前6 d Ⅰ组和Ⅱ组种子萌发率明显滞后于其他组。在6 d后,各组发芽率没有明显提升,趋于稳定,其中Ⅲ组在9 d时发芽率到达90%后停止,Ⅳ组在6 d时发芽率到达83%后停止,Ⅴ组在9 d时发芽率到达83%后停止,Ⅵ组在9 d时发芽率到达87%后停止。在12 d时,Ⅰ~Ⅵ组发芽率分别为80%、83%、90%、83%、83%、87%,Ⅱ~Ⅵ组苦草种子发芽率均大于Ⅰ组,可见苦草种子受磷营养盐胁迫更易发芽。
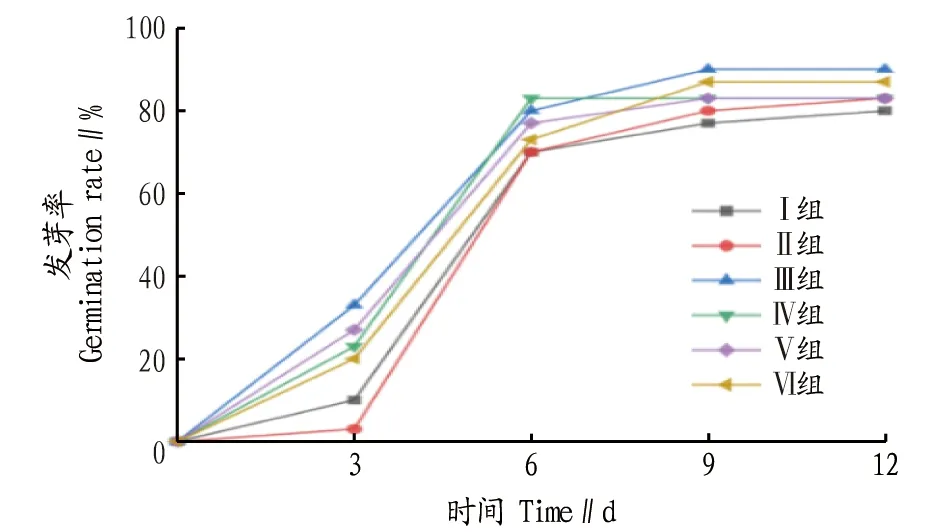
图1 不同浓度磷酸盐溶液对种子发芽率的影响Fig.1 Effect of different concentrations of phosphate solutions on germination rate of seeds
从表1可以看出,磷酸盐浓度对苦草根长有较大影响,随着磷酸盐浓度的增加,苦草根长平均增长长度总体呈增加趋势。磷酸盐苦草根长总体随磷酸盐浓度增加而增长。在不同浓度的磷酸盐溶液中,根系从第3天开始具有明显的长度增加,在12 d时,Ⅰ~Ⅵ组对应的根长分别为2.80、3.13、4.04、5.17、4.89、5.38 cm;与对照组相比,各处理组根长随磷酸盐浓度增加而增长速率加快。
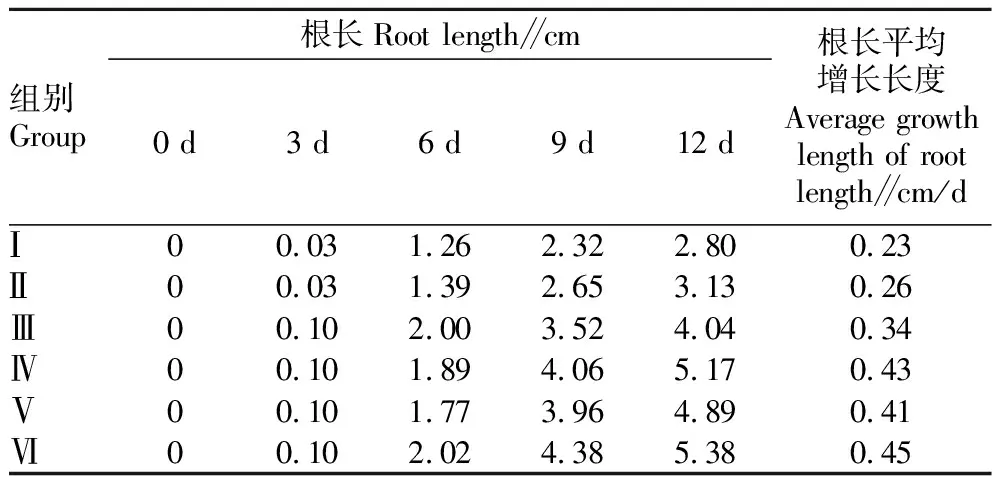
表1 不同浓度磷酸盐溶液对苦草根长的影响Table 1 Effects of different concentrations of phosphate solutions on the root length of Vallisneria natans
2.2 磷酸盐对苦草叶片中叶绿素及MDA含量的影响植物叶绿素广泛存在于植物组织中,其含量是反映植物光合作用和生长状况的重要指标。从图2a可以看出,随着时间的延长,Ⅰ组、Ⅱ组、Ⅵ组中叶绿素含量出现了先降低后升高的趋势,其中Ⅰ组最终叶绿素含量较初始减少了0.269 mg/g,Ⅱ组最终叶绿素含量较初始减少了0.241 mg/g,Ⅵ组最终叶绿素含量较初始减少了0.212 mg/g;而Ⅲ组、Ⅳ组、Ⅴ组中叶绿素含量变化差异不明显。综合来看,中高浓度(50~200 mg/L)的磷酸盐溶液可以维持苦草体内叶绿素的稳定。
当植物受到胁迫时,细胞原生质膜中的不饱和脂肪酸会发生过氧化产生丙二醛(MDA),其含量可反映出植物的受损程度[18]。从图2b可以看出,各组植株中MDA含量随时间的变化整体呈上升趋势。与0 d时相比,试验最初的10 d内,各处理组下的苦草叶片MDA含量变化不明显,Ⅰ~Ⅵ组均是在15 d时MDA含量明显增加,而Ⅵ组从5 d时开始明显增加。总体而言,Ⅰ~Ⅴ组均在20 d时苦草单株体内MDA含量最高,Ⅱ组中MDA含量变化幅度最大,相比0 d时增加了0.026 μmol/L,变化最小的是Ⅴ组,MDA含量增加了0.008 μmol/L;Ⅵ组中MDA含量呈现在15 d之前增加、15 d之后减少的趋势。

图2 不同浓度磷酸盐溶液对苦草中叶绿素(a)和MDA(b)含量的影响Fig.2 Effect of different concentrations of phosphate solutions on chlorophyll(a)and MDA(b)content in Vallisneria natans
为了进一步验证苦草根系泌氧与磷酸盐胁迫的响应关系,以磷酸盐最高浓度组(300 mg/L)苦草根部为样本,拍摄平面光极的动态图片,观察苦草根际活性氧和pH随时间的变化情况(图3~4)。从图3可以看出,在苦草根际几毫米区域内氧气量随着时间的增加而持续增多,说明根系发生了泌氧现象。图4显示,溶液中苦草根系周围pH较低,均在6.50~6.75,并且该现象持续存在。
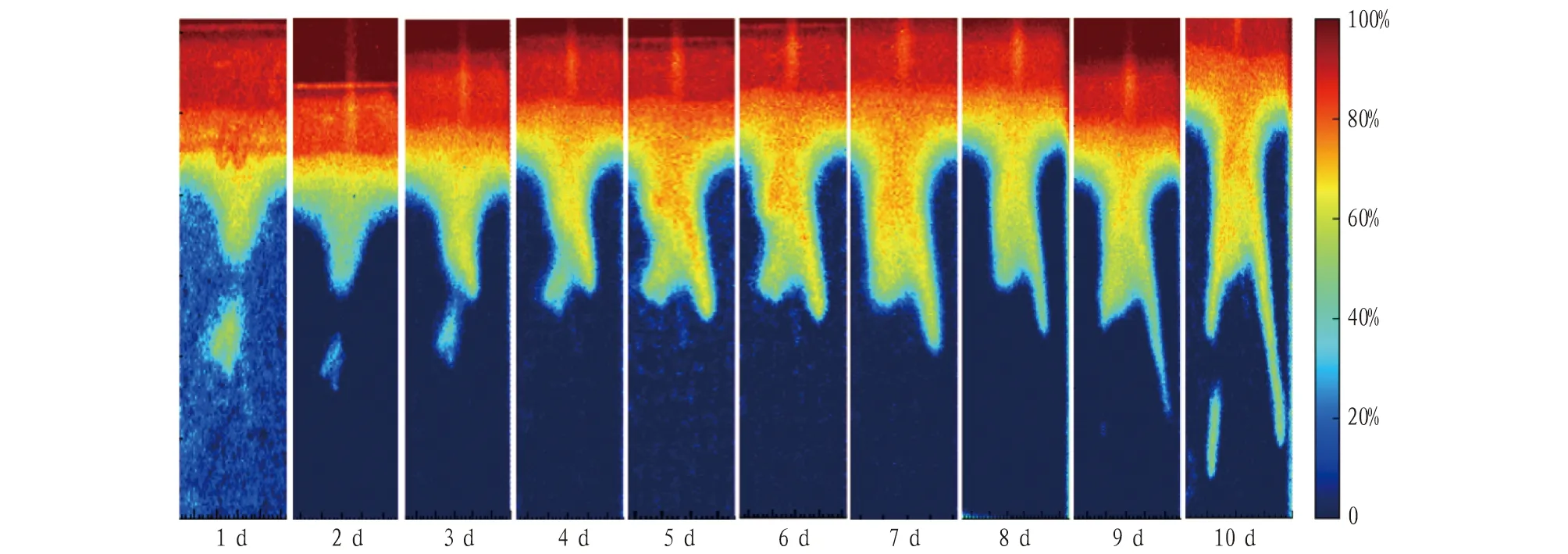
图3 苦草根际活性氧随时间变化Fig.3 Changes of reactive oxygen species in the rhizosphere of Vallisneria natans with time
2.3 苦草对水中磷酸盐的去除效果该试验以水中磷酸盐浓度的下降量来反映苦草对磷酸盐的吸收量。从图5a可以看出,在20 d时,各处理组中磷酸盐浓度与0 d时相比均有大幅度降低,Ⅳ组中20 d时水中磷酸盐浓度下降了57.8 mg/L,Ⅴ组中20 d时水中磷酸盐浓度下降了134.6 mg/L,Ⅵ组20 d时水中磷酸盐浓度下降了73.2 mg/L;可以明显判断出Ⅴ组苦草对水中磷酸盐的吸附量高于Ⅳ组和Ⅵ组,Ⅴ组中苦草对水中磷酸盐的吸附量最大。
从图5b可以看出,各处理组(除Ⅰ组)的去除率与对照组相比明显增加,其中,Ⅱ组中在处理5 d时,去除率已达到81%,20 d时达到了99.6%;Ⅵ组中,随着处理时间的延长,苦草对磷酸盐的去除率呈线性增加。但Ⅰ组中却出现了在15 d 之后水中磷酸盐去除率为负的现象,也就是苦草向水中释放磷酸盐。出现此现象的原因可能是由于苦草部分根系衰亡脱落,造成了磷的释放[19]。

图4 苦草根际pH随时间变化Fig.4 Change of pH in the rhizosphere of Vallisneria natans with time
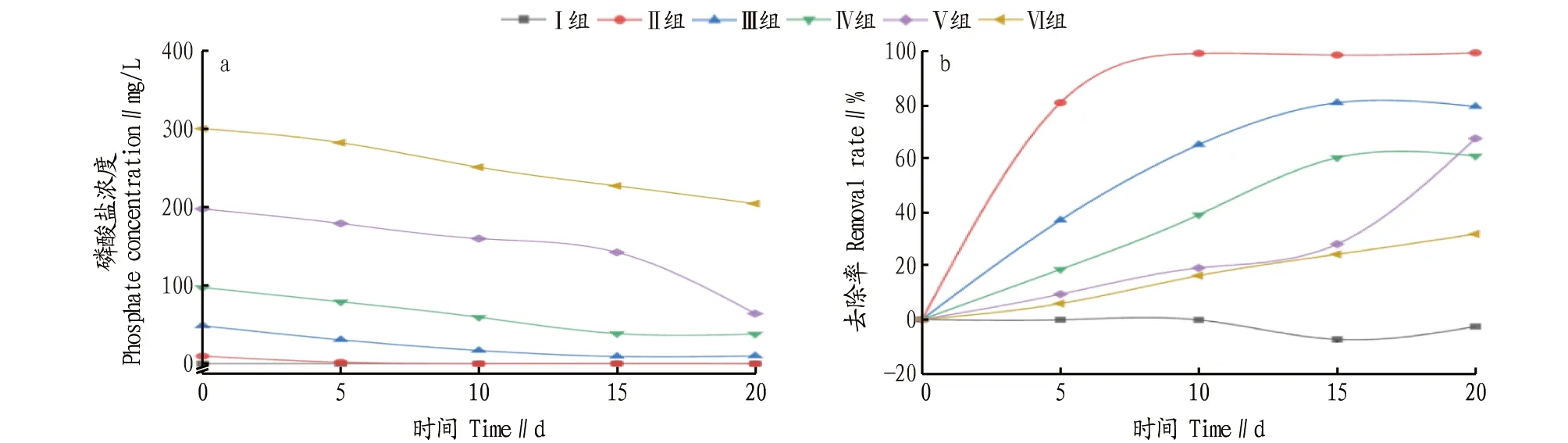
图5 水中磷酸盐浓度(a)和去除率(b)随时间的变化Fig.5 Changes of phosphate concentration(a)and removal rate(b)in water with time
3 讨论
3.1 不同浓度磷酸盐对种子发芽的影响一定浓度的磷营养盐溶液对苦草种子会产生一定的胁迫作用,体现出对苦草种子生长发育的促进作用。杨丽丽等[20]研究表明,白及种子在受低浓度磷酸盐的胁迫下更容易发芽。然而,该研究发现不同磷酸盐浓度对苦草种子的发芽具有一定程度的促进作用。为了进一步验证该研究的结果,对发芽率进行显著性检验发现,不同浓度磷营养盐溶液均可以促进苦草种子的发芽,但是各个浓度的促进效果没有显著差别。这与Vetterlein等[21]的研究结果一致。磷酸盐营养液促进种子生长发育,主要是由于磷可以帮助修复种子的膜结构,提高种子淀粉酶的活性,使种子对营养元素的吸收加快,从而促进种子的萌发[22]。
3.2 不同浓度磷酸盐对苦草根系生长的影响植物的生长发育过程对水分的利用受限于磷,从而影响植物根系的生长发育[23],在植物耐受范围之内,可以实现以磷促水。这与该研究的结果一致,磷酸盐浓度对苦草根长产生的是正相关性影响,随着磷酸盐浓度的增加,苦草根长总体逐渐增加。这与朱士江等[24]对香蒲、美人蕉对磷的耐受程度的研究结果相似。因此,在较高浓度磷营养盐条件下,磷对苦草根长生长仍然具有促进作用。
出现苦草根长随磷酸盐浓度增加而增长更快的原因可能是在高浓度磷营养盐条件下,植物可以清除体内过氧化氢,保持植物体内活性氧的代谢平衡,保护植物细胞膜结构,从而在水体中阻止高浓度氮磷对植物的伤害[25]。对此,对最高磷酸盐浓度组的苦草根部进行pH测量,观测到溶液中苦草根系周围pH较低,均在6.50~6.75,并且该现象持续存在。该现象验证了苦草在受到高浓度磷酸盐胁迫时,激发了自我保护体系,将体内产生过氧化氢排出体外,导致苦草根系周围的pH升高。这也说明苦草具有很强的抗逆性,在此次试验中,由于苦草并未长出叶片,不能进行光合作用,所以过高浓度的磷营养盐溶液对苦草的负面影响较小。
3.3 不同浓度磷酸盐对苦草叶绿素和MDA含量的影响在苦草单株的生长发育过程中,中高浓度的磷溶液可以维持苦草正常生长并且维持苦草中叶绿素浓度的稳定,在正常的有氧代谢过程中苦草进行正常的光合呼吸作用,但是当磷溶液浓度过高时,苦草的活性氧动态平衡被打破[26],产生大量活性氧,使得苦草光合功能下降,其体内的叶绿素含量明显下降,影响枯草的健康生长,对苦草产生毒害作用。刘文竹等[27]研究也发现,植物组织在盐胁迫下产生活性氧,活性氧对植物功能分子有破坏作用。
磷酸盐在苦草体内累积到一定的浓度后,会影响细胞膜的渗透性,产生活性氧,使膜脂过氧化[28],导致MDA含量升高。Ⅵ组(磷酸盐浓度300 mg/L)中MDA含量出现升高早于其他组,是由于Ⅵ组磷酸盐含量过高,在苦草体内积累较快,使MDA含量在试验中期开始显著升高;而其他处理组浓度较低,加之苦草耐受性较强,因此磷酸盐在苦草体内积累较慢,在试验后期MDA含量才开始明显升高。李佩[29]研究也发现,MDA含量随磷浓度的升高而增加,也随时间延长而累积,这与该研究的观点一致。
综合叶绿素和MDA含量的变化情况,磷酸盐对苦草的胁迫影响了苦草根系活性氧的产生过程,黄玉源等[30]研究结果也表明,不同浓度的磷酸盐溶液影响苦草对氧气的吸收与释放,从而影响苦草的生长发育过程。
3.4 苦草对富磷水体中磷酸盐的去除效果随着水中磷酸盐浓度的增加,苦草对磷酸盐的吸附量不断增加,Ⅵ组(磷酸盐浓度300 mg/L)的吸附量明显低于Ⅴ组(磷酸盐浓度200 mg/L),这是由于Ⅵ组中磷酸盐浓度过高,对苦草生理代谢与结构的影响较大,MDA与叶绿素指标均可说明此现象。文明章等[31]研究也表明过高浓度的磷营养盐溶液会对苦草产生胁迫作用。Ⅴ组在15 d之后去除率突然间大幅度增加,结合MDA含量的结果,原因可能是由于Ⅴ组植株的抗逆性相较于其他组更强,且Ⅴ组中磷酸盐的浓度依然在苦草承受范围之内。综合各组苦草对水中磷酸盐去除的结果,Ⅴ组为磷酸盐吸附量最高的组,因此,当磷酸盐浓度在200 mg/L时,苦草对水中磷酸盐的吸附量最高。
4 结论
该研究以苦草为模式植物,采用原位根系泌氧图像分析(平面光极技术)的方法,研究不同浓度富磷水体对苦草种子和植株生长发育以及根系泌氧的影响。结果表明:不同浓度的富磷水体对苦草种子发芽均有促进效果,苦草幼苗根长生长随富磷水体中磷酸盐浓度的增加而加快。当磷酸盐浓度在50~200 mg/L时,苦草中叶绿素含量变化稳定;当磷酸盐浓度超过200 mg/L时,苦草中叶绿素含量波动显著,后期呈现出升高趋势。当磷酸盐浓度超过200 mg/L时,苦草累积MDA速度较快,此浓度下,苦草对磷酸盐吸附量最多,去除率达67.6%。植物根系的养分吸收程度会直接影响植物中叶绿素的合成以及MDA的释放,苦草根系泌氧研究表明,磷酸盐胁迫下根系pH降低,活性氧含量呈增加趋势。
综合来看,不同浓度富磷溶液对苦草生长发育影响较大,在选择用苦草作为修复富营养化水体植物时,应考虑水体的富营养化程度中水体磷酸盐的含量,因地制宜,因水制宜,在提高对水体富营养化的修复效率的同时,达到节约成本和美化环境的最终目的。

