替雷利珠单抗联合培美曲塞、顺铂化疗在晚期肺癌患者中的应用效果分析
王子慧,王永,王汉林
(1.兰陵县人民医院肿瘤化疗科,山东临沂 277700;2.兰陵县人民医院心内科,山东临沂 277700)
肺癌是临床常见恶性肿瘤,早期患者多无明显症状,随着病情进展,会出现呼吸困难、咳血等症状,此时病情多处于晚期,已失去最佳手术时机[1]。化疗是晚期肺癌的首选方案,可杀死癌细胞,预防疾病进展,对延长患者生存期具有一定价值,但化疗过程中会对正常组织细胞造成一定损伤,导致疗效降低、免疫功能下降等,增加复发、转移风险[2]。近年来,随着靶向治疗技术的持续发展,临床发现肿瘤细胞转移、复发与免疫逃逸能力紧密相关, 免疫治疗愈发受到临床重视。替雷利珠单抗是一种PD-1 抑制剂,可与肿瘤细胞表面PD-L1 结合,阻断内源性PD-L1、PD-1 结合,以降低肿瘤细胞免疫力,现已在食管癌、肝细胞癌等治疗中广泛应用,但对于其在晚期肺癌患者中的应用效果尚需进一步研究[3]。 基于此,本研究选择2020 年10月—2022 年12 月兰陵县人民医院收治的92 例晚期肺癌患者为对象, 分析替雷利珠单抗联合培美曲塞、顺铂化疗的临床效果。 现报道如下。
1 资料与方法
1.1 一般资料
选择兰陵县人民医院收治的晚期肺癌患者92 例为研究对象。纳入标准:符合《中华医学会肺癌临床诊疗指南(2018 版)》[4]肺癌的诊断标准;肿瘤分期Ⅲ~Ⅳ期;凝血功能均正常;精神无障碍。 排除标准:合并其他恶性肿瘤者;存在急慢性感染者;合并肝、肾等器质性疾病者;对本研究所用药物不耐受者。 本研究获院医学伦理委员会审批,患者、家属均签署同意书。按照随机数字表法分为对照组和观察组,各46 例。对照组男25 例,女21 例;年龄52~75 岁,平均年龄(63.54±3.61)岁;腺癌27 例,鳞癌19 例;肿瘤分期Ⅲ期30例,Ⅳ期16 例。观察组男26 例,女20 例;年龄50~78岁,平均年龄(63.61±3.65)岁;腺癌25 例,鳞癌21 例;肿瘤分期Ⅲ期28 例,Ⅳ期18 例。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 对照组
对照组采用培美曲塞(湖南科伦制药有限公司,国药准字H20223539,规格:100 mg)、顺铂(齐鲁制药有限公司,国药准字H20213819,规格:50 mL:50 mg)化疗。化疗第1 d,静脉滴注培美曲塞500 mg/(m2・d);化疗第1~3 d,静脉滴注顺铂25 mg/(m2・d),化疗前将培美曲塞、 顺铂溶于100 mL 0.9%氯化钠注射液(陕西诚信制药有限公司, 国药准字H61023395,规格:100 mL:0.9 g)稀释,滴注时间≥30 min,以21 d 为一个化疗周期,共治疗4 个周期。
1.2.2 观察组
于对照组基础上,观察组联合替雷利珠单抗(广州百济神州生物制药有限公司,国药准字S20190045,规格:100 mg/瓶)治疗,200 mg/次,将其溶于200 mL 0.9%氯化钠溶液中,进行静脉滴注,第1 次滴注时间≥60 min,若患者耐受良好,后续滴注时间≥30 min即可,以21 d 为一个治疗周期,共治疗4 个周期。
1.3 观察指标
(1)临床疗效。完全缓解(CR):患者经治疗,肿瘤病灶完全消失,未出现新病灶。 部分缓解(PR):患者经治疗,病灶最长径总和减少幅度≥30%。稳定(SD):患者经治疗,病灶最长径总和减少幅度<30%,或增加幅度<20%。 进展(PD):患者经治疗,病灶最长径总和减少幅度≥20%,或出现新病灶。总有效率=(CR+PR)/总例数×100%。(2)肿瘤标志物。治疗前后,抽取患者5 mL 空腹肘静脉血,离心分离血清,通过酶联免疫法检测血清癌胚抗原 (CEA)、 细胞角蛋白19 片段(CYFRA21-1)、糖类抗原125(CA125)。 (3)免疫功能。 治疗前后,抽取患者5 mL 空腹肘静脉血,采用流式细胞仪(深圳迈瑞生物医疗电子股份有限公司,粤食药监械20142400295,型号:BriCyte E6)检测T 淋巴细胞亚群(CD3+、CD4+、CD8+)水平。 (4)不良反应。统计两组恶心、贫血、疲乏、甲状腺功能异常、皮疹等发生情况。
1.4 统计方法
采用SPSS 20.0 统计学软件进行数据分析。 计数资料用[n(%)]表示,组间比较采用χ2检验;计量资料以(x依s)表示,组间比较采用t检验。P约0.05 为差异有统计学意义。
2 结 果
2.1 两组临床疗效比较
观察组治疗总有效率高于对照组,差异有统计学意义(P<0.05)。 见表1。

表1 两组晚期肺癌患者临床疗效比较[n(%)]
2.2 两组肿瘤标志物水平比较
治疗前,两组肿瘤标志物水平比较,差异无统计学意义(P>0.05);治疗后,观察组CEA、CYFRA21-1、CA125 水平均低于对照组,组间差异有统计学意义(P<0.05)。 见表2。
表2 两组晚期肺癌患者肿瘤标志物比较(±s)
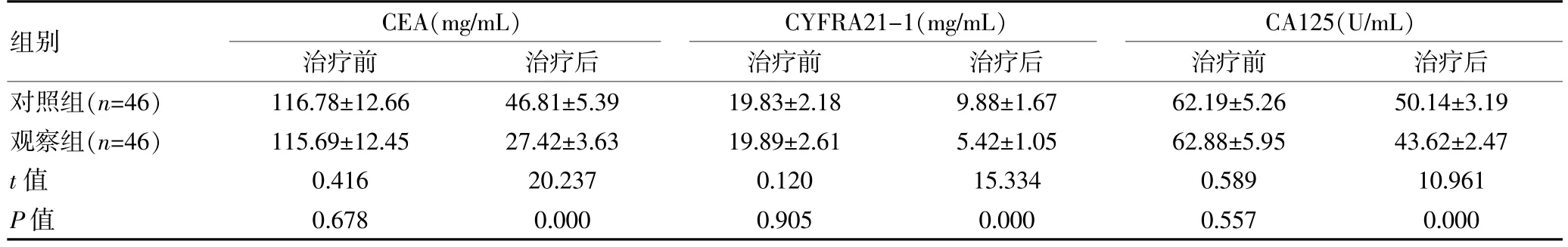
表2 两组晚期肺癌患者肿瘤标志物比较(±s)
组别CEA(mg/mL)治疗前治疗后CYFRA21-1(mg/mL)治疗前治疗后CA125(U/mL)治疗前治疗后对照组(n=46)观察组(n=46)t 值P 值116.78±12.66 115.69±12.45 0.416 0.678 46.81±5.39 27.42±3.63 20.237 0.000 19.83±2.18 19.89±2.61 0.120 0.905 9.88±1.67 5.42±1.05 15.334 0.000 62.19±5.26 62.88±5.95 0.589 0.557 50.14±3.19 43.62±2.47 10.961 0.000
2.3 两组免疫功能比较
治疗前,两组免疫功能比较,差异无统计学意义(P>0.05);治疗后,观察组CD3+、CD4+水平均高于对照组,CD8+水平低于对照组, 组间差异有统计学意义(P<0.05)。 见表3。
表3 两组晚期肺癌患者免疫功能比较[(±s),%]
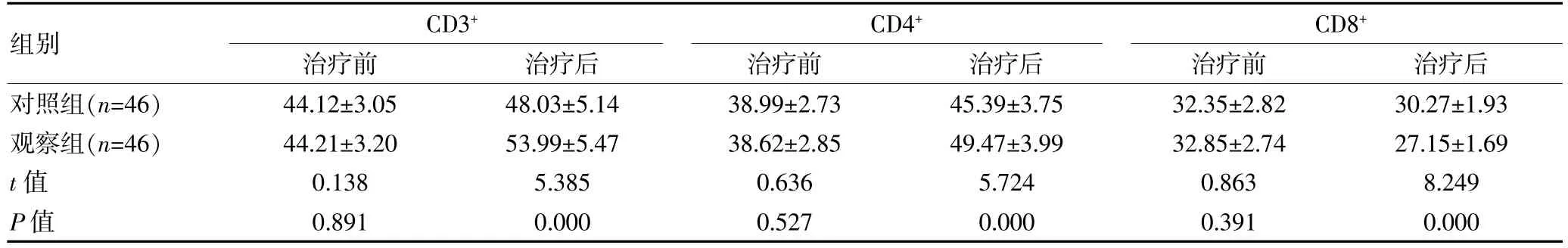
表3 两组晚期肺癌患者免疫功能比较[(±s),%]
组别CD3+治疗前治疗后CD4+治疗前治疗后CD8+治疗前治疗后对照组(n=46)观察组(n=46)t 值P 值44.12±3.05 44.21±3.20 0.138 0.891 48.03±5.14 53.99±5.47 5.385 0.000 38.99±2.73 38.62±2.85 0.636 0.527 45.39±3.75 49.47±3.99 5.724 0.000 32.35±2.82 32.85±2.74 0.863 0.391 30.27±1.93 27.15±1.69 8.249 0.000
2.4 两组不良反应发生情况比较
对照组治疗期间出现恶心3 例、贫血3 例、疲乏2 例、甲状腺功能异常2 例、皮疹3 例,不良反应发生率为28.26%;观察组治疗期间出现恶心4 例、贫血4例、疲乏3 例、甲状腺功能异常3 例、皮疹2 例,不良反应发生率为34.78%。两组不良反应发生率对比,差异无统计学意义(χ2=0.453,P=0.501)。
3 讨 论
肺癌是起源于肺部支气管黏膜或腺体的恶性肿瘤,病因未明,临床认为与吸烟、职业暴露、空气污染等因素均相关,近年来发病率逐渐上升,严重威胁患者生命安全[5]。晚期肺癌患者病情较重,已错过最佳手术时机,多采用化疗治疗,培美曲塞、顺铂是临床常用化疗方案,培美曲塞能够催化叶酸多谷氨酸转换为多聚谷氨酸盐,使胸苷酸合成酶活性降低,拮抗叶酸生成,有效抑制肿瘤细胞繁殖;顺铂可损伤肿瘤细胞,促使肿瘤细胞DNA 变异,进而抑制其复制功能[6-7]。 然而,近年来临床研究发现,肿瘤进展、转移与免疫功能密切相关,免疫治疗逐渐成为肿瘤研究的新方向。
CEA 是广谱肿瘤标志物,在多种恶性肿瘤中均有表达;CYFRA21-1 在上皮细胞中广泛存在,肺癌患者体内呈高表达水平;CA125 为非特异性肿瘤标志物,其水平变化可预测晚期肺癌患者生存期[8]。 本研究结果显示,观察组治疗总有效率高于对照组,治疗后CEA、CYFRA21-1、CA125 水平均低于对照组,CD3+、CD4+水平均高于对照组,CD8+水平低于对照组(P<0.05),两组不良反应比较,差异无统计学意义(P>0.05),提示在晚期肺癌患者中采用替雷利珠单抗联合培美曲塞、顺铂化疗治疗对降低血清肿瘤标志物水平、改善免疫功能效果显著,且安全性高。其原因为PD-1 是免疫球蛋白家族成员,存在于激活T 细胞、B细胞中,能够稳定机体正常免疫机制,防止发生免疫性疾病;PD-L1 作为PD-1 配体, 与PD-1 结合会阻滞招募蛋白酪氨酸酶-1,使下游信号通路受阻,影响细胞因子释放,最终导致T 细胞失活。 替雷利珠单抗属于PD-1 抑制剂,能够阻断肿瘤细胞PD-L1、PD-1结合,促进T 细胞增殖与分化,进而有效改善T 淋巴细胞亚群值,增强患者免疫功能[9-10]。 同时,替雷利珠单抗能够提高T 细胞对肿瘤病灶的识别能力,增强其杀伤作用,从而提高抗肿瘤效果,降低血清肿瘤标志物水平。
综上所述,替雷利珠单抗联合培美曲塞、顺铂化疗治疗晚期肺癌患者效果显著,能够降低血清肿瘤标志物水平,改善免疫功能,且具有较高安全性。

