天珠散对缺血性脑卒中大鼠神经功能缺损及Wnt3a、MAP-2表达的影响
程 刚,付平方,殷 莉,包江平,兰 俊,匡颖文,吴云毅
(1. 十堰市中西医结合医院,湖北 十堰 442000;2. 十堰市食品药品检验检测所,湖北 十堰 442000;3. 贵州中医药大学第一附属医院,贵州 贵阳 550001)
脑卒中系脑组织损伤的一组急性脑血管疾病,通常表现为出血性和缺血性两大临床分型,可导致肢体瘫痪、言语障碍、吞咽困难、认知障碍和精神抑郁等,具有发病率高、致残率高、病死率高、复发率高及经济负担高的“五高”特点[1]。缺血性脑卒中(即脑梗死)占所有卒中的75%以上,临床上常针对性采用溶栓、抗血小板、抗凝、神经保护以及控制血压、血脂、血糖等非特异性治疗[2]。目前快速恢复血管的血氧供应是公认获益措施,但血管再通微环境的改变往往进一步加重缺血组织结构与功能的障碍,故修复降低脑缺血再灌注损伤导致的神经功能缺损成为治疗的重点。脑缺血再灌注损伤的发生常涉及能量代谢障碍、Ca2+超载、炎症反应、细胞凋亡、氧自由基损伤、兴奋性氨基酸毒性等多环节[3-5],而Wnt信号通过调控神经干细胞增殖分化和突触形成与脑缺血再灌注损伤病理机制密切相关[6]。微管相关蛋白2(MAP-2)是神经生长和修复相关蛋白,对脑缺血非常敏感,是神经元缺血损伤的分子指标,常为神经可塑性研究的理想标志物[7-8]。中药复方通过辨证化裁防治脑卒中可发挥多成分、多靶点、多途径的优势和潜力。源于《鄂西药物志》的天珠散由头顶一颗珠和天麻组成,具补虚强体、镇静安神、祛风散痰、补脑安神之效,对血管性痴呆及学习记忆障碍等有保护作用[9-11]。然其作为土家、苗族民间地域特色验方应用并未普及,历史文献和现代药理研究资料仍十分匮乏,均在不同程度限制了天珠散的开发和推广。本研究通过建立局灶性脑缺血再灌注损伤大鼠模型,进一步观察了天珠散对脑缺血再灌注损伤及Wnt3a、MAP-2蛋白表达的影响,探讨其抗脑缺血神经保护机制。
1 实验材料与方法
1.1动物 SPF级雄性SD大鼠90只,6~8周龄,体重(200±20)g,购自湖北省实验动物研究中心[许可证号:SCXK(鄂)2020-0018],饲养于武汉大学附属人民医院实验动物中心[许可证号:SYXK(鄂)2017-0065],室温20~25 ℃,相对湿度50%~60%,自由进食饮水,适应性饲养5 d后进行实验。本实验经十堰市中西医结合医院实验动物伦理委员会批准(202003)。
1.2药物 头顶一颗珠(批号:191210)、天麻(批号:210801)均购于十堰华源三江医药有限公司,经湖北省中医院严劲松主任药师鉴定分别为百合科延龄草属植物延龄草(TrilliumtschonoskiiMaxim.)的干燥根及根茎和兰科天麻属植物天麻(GastrodiaelataBl.)的干燥块茎;天珠散超微粉(300目)由十堰市宏康医药有限公司按药材比1∶2制备;尼莫地平片(亚宝药业集团股份有限公司,批号:211211)。
1.3主要试剂与仪器 2,3,5-氯化三苯基四氮唑(TTC,Sigma公司,批号:T8877-25G);苏木素(Sigma公司,批号:H9627);伊红(国药集团,批号:71014544);苯甲磺酰氟(100 mM PMSF,Beyotime公司,批号:ST506);RIPA裂解液(强)(Beyotime公司,批号:P0013B);BCA蛋白浓度测定试剂盒(Beyotime公司,批号:P0010);SDS-PAGE蛋白上样缓冲液(5×,Beyotime公司,批号:P0015);SDS-PAGE凝胶快速配制试剂盒(Beyotime公司,批号:P0012A);化学发光底物(ECL,Thermo Fisher公司,批号:NCI5079);预染蛋白Marker(10-250KD,Thermo Fisher公司,批号:26619-1);PVDF膜(Millipore公司,批号:IPVH00010);Wnt3a单抗(proteintech公司,批号:26744-1-AP)、GAPDH单抗(proteintech公司,批号:60004-1-Ig)、羊抗兔IgG二抗(proteintech公司,批号:SA00001-2)、羊抗鼠IgG二抗(proteintech公司,批号:SA00001-1);MAP-2单抗(Abcam公司,批号:ab96378);其余试剂均为国产分析纯。JJ124BC电子分析天平(常熟市双杰测试仪器厂),XR-6C小鼠转棒式疲劳仪(上海欣软信息科技有限公司),TOPO 220呼吸麻醉机(美国Kent公司),BioSpec 70/20USR小动物磁共振成像仪(德国Bruker公司),RM2016轮转式切片机(德国Leica公司),JB-P5组织包埋机(武汉俊杰电子有限公司),JK-6生物组织摊烤片机(武汉俊杰电子有限公司),BX53生物显微镜(奥林巴斯株式会社),HI650台式高速离心机(湖南湘仪实验室仪器开发有限公司),DYCZ-40G转印电泳仪(北京六一仪器厂),ChemiDocTMXRS+凝胶成像系统(美国Bio-rad公司),EnSpire®多模式微孔板检测仪(美国PerkinElmer公司)。
1.4实验方法 取10只大鼠作为假手术组,其余大鼠参考改良的Longa线栓法[12]制备大脑中动脉栓塞局灶性脑缺血再灌注模型。具体方法:术前12 h禁食不禁水,室温环境下,大鼠经10%水合氯醛(35 mg/kg)腹腔注射麻醉后仰卧位固定,颈部备皮消毒后沿正中切开约4 cm,逐层钝性分离出右侧颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉和颈外动脉的近心端,微动脉夹暂时夹闭远心端颈内动脉血流,用手术剪在颈外动脉近颈总动脉分叉1 cm处剪一斜细切口,移去颈内动脉动脉夹,将带有圆形尖端的6-0尼龙丝线经颈外动脉残端向颅内颈内动脉方向缓缓推进18~20 mm,微感阻力即停止。此时提示栓线已穿过较细的大脑中动脉起始部阻断了血流,结扎切口固定线栓,消毒逐层缝合,待缺血2 h后缓慢拔出线栓恢复再灌注。大鼠手术苏醒后出现明显偏瘫症状、身体倾斜、爬行旋转等视为造模成功。假手术组仅动脉分离,不进行线栓处理,余操作同上。将造模成功后的SD大鼠随机分为模型组、尼莫地平组、天珠散低剂量组、天珠散中剂量组、天珠散高剂量组,每组16只。于造模12 h后,按照文献[13]计算给药量,尼莫地平组给予尼莫地平(溶于蒸馏水中)20 mg/kg灌胃,天珠散低、中、高剂量组分别给予天珠散(溶于蒸馏水中)300 mg/kg、600 mg/kg、1 200 mg/kg灌胃,假手术组和模型组给予蒸馏水灌胃,灌胃量均为10 mL/kg,均1次/d,连续10 d。
1.5检测指标及方法
1.5.1神经功能缺损程度 参照Longa评分法(评分范围0~5分)[14]分别于灌胃第1天、第3天、第5天、第7天、第10天(当天灌胃后2 h)对各组大鼠进行神经功能缺损程度评估。0分:活动正常,无神经缺损表现;1分:损伤对侧前肢不能完全伸展;2分:损伤对侧前肢呈蜷曲态,轻度转圈;3分:行走时向损伤对侧倾倒;4分:无自发行走,意识模糊;5分:死亡。排除0分和5分的大鼠,评分越高代表神经功能缺损越重。
1.5.2运动和共济水平 采用转棒实验(检测啮齿类动物运动功能的简便方法,正常大鼠可在旋转加速的横杆上不断行走,而脑缺血大鼠因神经功能缺损则会坠落[15])评估各组大鼠的运动和共济水平。大鼠适应性训练3 d后进行正式测试:各组随机选取5只大鼠,分别于灌胃第1天、第3天、第5天、第7天、第10天(当天灌胃后2 h)置于转棒疲劳仪的旋转杆上,5个隔室中同时各放1只,接通电源,设定转速30 r/min,转动时间1 min,中途间隔休息10 s,连续测定5次,记录大鼠从开始转动至坠落时在转棒杆上的停留时间。
1.5.3脑梗死体积 采用MRI扫描和TTC染色测定各组大鼠脑梗死体积。
1.5.3.1MRI扫描 末次灌胃2 h后,各组随机取1只大鼠,吸入3%异氟烷麻醉后,仰卧位固定于扫描床,送入单通道大鼠线圈中心,利用7.0T动物磁共振成像仪行T2加权成像(T2WI)动态检测脑缺血梗死损伤情况。实验中保持异氟烷接入大鼠呼吸面罩中,并实时监测其呼吸频率。参考文献[16-17]设置T2WI扫描参数:采用快速自旋回波序列,回波时间(TE)=12 ms,重复时间(TR)=2 000 ms,重复1次,反转角(FA)=180°,矩阵(Matrix)=256×256,视野(FOV)=2 cm×2 cm,层厚1 mm,层数10。扫描完成将MRI数据导入Para Vision 5.1工作站处理。
1.5.3.2TTC染色 末次灌胃2 h后,各组随机取5只大鼠,予以10%水合氯醛(35 mg/kg)腹腔注射麻醉,立即断头取脑,置于-20 ℃冰箱中冷冻30 min。切除嗅球、小脑及低位脑干,于视交叉冠状面连续切分5张2 mm厚的脑片。将切片轻放入2%TTC染色液中,37 ℃避光孵育15 min,不时用镊子翻动使切片充分接触染色均匀。再以4%多聚甲醛溶液固定24 h,取出滤纸吸干并拍照。正常脑组织线粒体内琥珀酸脱氢酶与TTC反应呈鲜红色,而脑缺血梗死部位因脱氢酶活性缺失不能反应呈苍白色。应用Image J软件测定每层切片脑梗死面积,计算各组大鼠脑梗死体积比。脑梗死体积比=(S1+S2+……+Sn)H/(S1’+S2’+……+Sn’)H×100%,Sn为每层梗死区面积,Sn’为每层脑片面积,H为层厚。
1.5.4脑组织HE染色病理形态 末次灌胃2 h后,各组随机取3只大鼠,予以10%水合氯醛(35 mg/kg)腹腔注射麻醉,立即断头取脑,PBS缓冲液清洗2次,4%多聚甲醛溶液4 ℃下继续固定24 h。固定后的脑组织经梯度浓度乙醇脱水、石蜡包埋、切片(厚4μm)及脱蜡后,即行HE染色(苏木素染液5~7 min、伊红染液2 min)。切片脱水透明,风干后中性树胶封片,置于显微镜下观察。
1.5.5脑组织中Wnt3a和MAP-2蛋白表达情况采用 Western blot法检测:末次灌胃2 h后,各组随机取5只大鼠,予以10%水合氯醛(35 mg/kg)腹腔注射麻醉,立即断头取脑置于液氮罐中速冻,-80 ℃冰箱备存。剪取约0.1 g脑组织样品研磨,加入RIPA进行冰上组织裂解及PMSF匀浆提取总蛋白,并于4 ℃下12 000 r/min离心5 min,BCA法对其上清进行蛋白定量。将提取的蛋白上清与蛋白上样缓冲液(5×)金属浴5 min变性,取25 μg蛋白样品进行SDS-PAGE电泳分离,并转印至PVDF膜上,用5%脱脂奶粉室温封闭1 h,加入Wnt3a和MAP-2一抗(1∶1 000)4 ℃孵育过夜,TBST洗膜(3×10 min),再将PVDF膜放入辣根过氧化物酶标记的羊抗兔及羊抗鼠IgG二抗(1∶5 000)中,室温摇床孵育1 h,同样TBST洗膜(3×10 min),ELC化学发光液曝光显影,凝胶成像系统观察拍照。应用Image J软件分析各蛋白条带灰度值,以GAPDH为内参计算目标蛋白的相对表达量。
2 结 果
2.1各组大鼠Longa评分比较 假手术组大鼠均评0分;各造模组大鼠均出现神经功能损伤,各组间灌胃第1天、第3天的Longa评分比较差异均无统计学意义(P均>0.05),但随时间的延长,各组Longa评分呈下降趋势;其中尼莫地平组灌胃第5天、第7天、第10天的Longa评分,天珠散高剂量组灌胃第7天、第10天的Longa评分和天珠散中剂量组灌胃第10天的Longa评分均明显低于同期模型组(P均<0.05),而天珠散低剂量组各时间点的Longa评分与模型组比较差异均无统计学意义(P均>0.05);各给药组间比较,仅天珠散低剂量组灌胃第10天的Longa评分明显高于尼莫地平组(P<0.05)。见表1。

表1 脑缺血再灌注各组大鼠神经功能Longa评分分)
2.2各组大鼠转棒停留时间比较 模型组大鼠各时间点的转棒停留时间均明显短于假手术组(P均<0.05);尼莫地平组和天珠散高剂量组大鼠灌胃第3天、第5天、第7天、第10天的转棒停留时间和天珠散中剂量组灌胃第5天、第7天、第10天的转棒停留时间均明显长于同期模型组(P均<0.05),天珠散低剂量组大鼠各时间点转棒停留时间与模型组比较呈上升趋势但差异无统计学意义(P均>0.05);各给药组间比较,仅天珠散低剂量组灌胃第3天的转棒停留时间明显短于尼莫地平组(P<0.05)。见表2。

表2 假手术组和脑缺血再灌注各组大鼠转棒停留时间比较
2.3各组大鼠脑梗死体积比较 MRI扫描显示,假手术组大鼠T2WI成像无异常高信号影,余各组大鼠则呈现不同程度范围的异常高信号影成像,见图1。TTC染色显示,假手术组大鼠无白色梗死组织;模型组大鼠见明显白色梗死组织,脑梗死体积比为(25.24±4.07)%;尼莫地平组和天珠散低、中、高剂量组大鼠脑梗死体积比分别为(14.23±4.58)%、(24.13±3.29)%、(17.97±5.33)%、(14.13±5.79)%,除天珠散低剂量组,其余各给药组的脑梗死体积比均明显低于模型组(P均<0.05),尼莫地平组大鼠脑梗死体积比明显低于天珠散低剂量组(P<0.05),与天珠散中、高剂量组比较差异均无统计学意义(P均>0.05)。见图2。
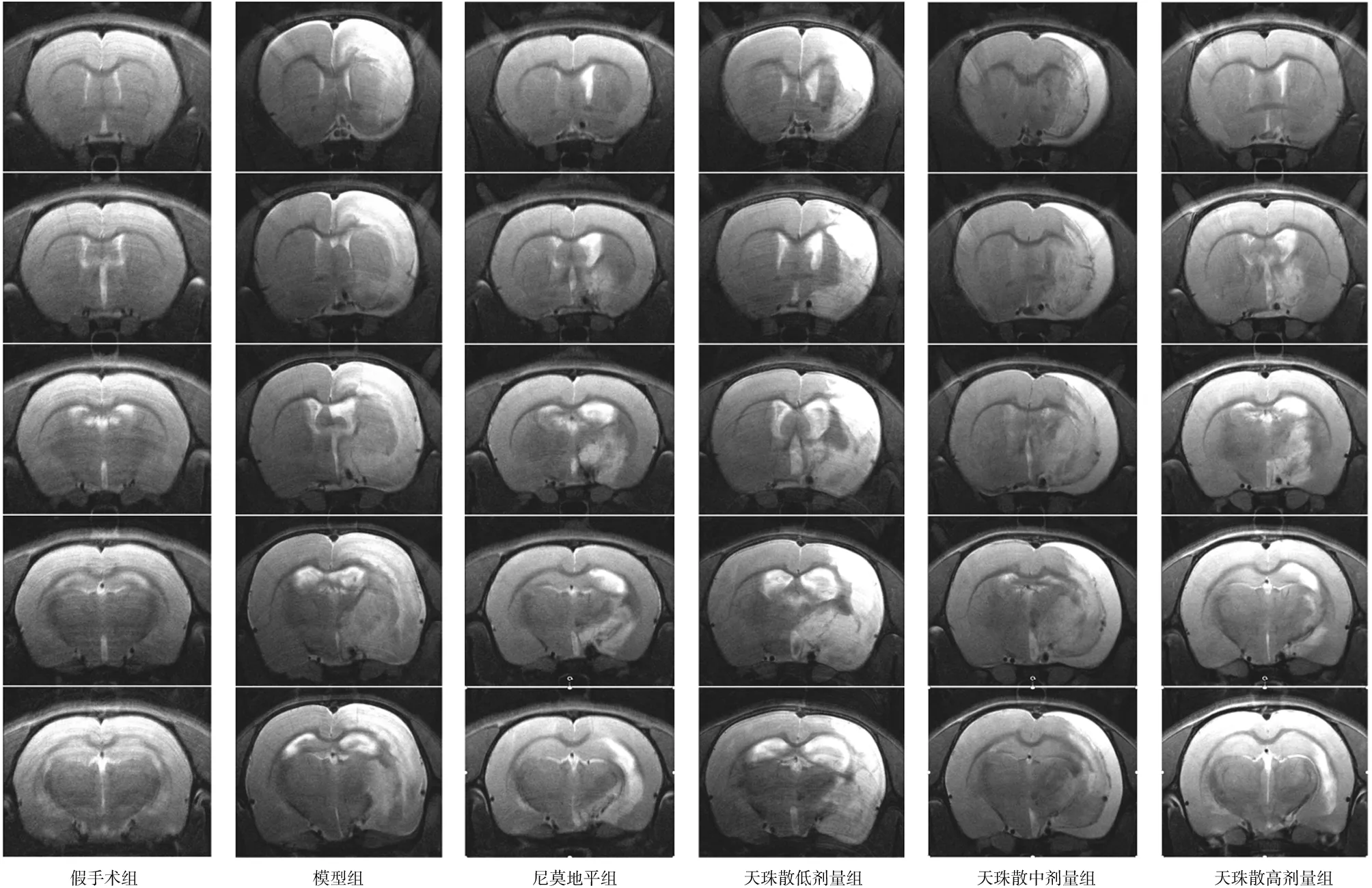
图1 假手术组和脑缺血再灌注各组大鼠脑组织MRI成像情况

图2 假手术组和脑缺血再灌注各组大鼠脑组织TTC染色情况
2.4各组大鼠脑组织病理学形态比较 假手术组海马CA1区锥体细胞排列整齐紧密,层次较多,皮质神经元形态正常,胞核居中,核仁清晰,胞浆丰富,分布密集,未见明显神经细胞炎性浸润或坏死;模型组缺血侧海马CA1区锥体细胞排列稀疏紊乱,皮质出现水肿和坏死,神经元肿胀或萎缩脱失,空泡样改变,胞膜轮廓不清,胞体皱缩,胞核深染;各给药组缺血侧脑组织病理形态学变化较模型组有所减轻,神经细胞排列规则,空泡样变和坏死数相对减少,核仁完整,其中尼莫地平组和天珠散高剂量组改善更明显。见图3。

图3 假手术组和脑缺血再灌注各组大鼠脑组织HE染色表现(×200)
2.5各组大鼠脑组织中Wnt3a和MAP-2蛋白表达情况比较 与假手术组比较,模型组大鼠脑组织中Wnt3a蛋白相对表达量明显升高(P<0.05),MAP-2蛋白相对表达量明显降低(P<0.05);与模型组比较,各给药组大鼠脑组织中Wnt3a蛋白相对表达量均明显降低(P均<0.05),MAP-2蛋白相对表达量均明显升高(P均<0.05);尼莫地平组大鼠脑组织中Wnt3a和MAP-2蛋白相对表达量较天珠散低、中剂量组变化更明显(P均<0.05),仅天珠散高剂量组大鼠脑组织中Wnt3a蛋白相对表达量与尼莫地平组比较差异无统计学意义(P>0.05)。见图4。
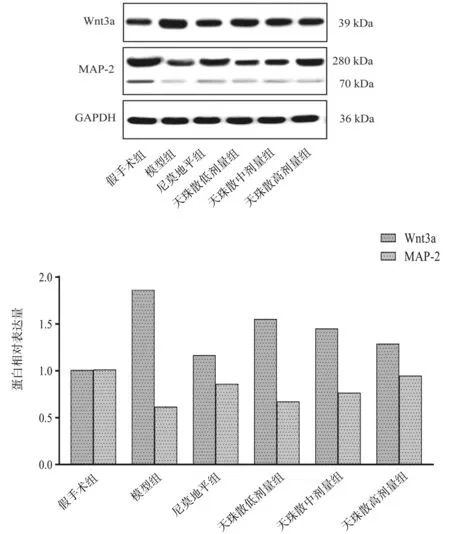
图4 假手术组和脑缺血再灌注各组大鼠脑组织中Wnt3a和MAP-2蛋白表达情况
3 讨 论
中医学将脑卒中归属于“中风”,认为“风、火、痰、瘀、虚”导致的本虚标实是其主要病机,肝肾阴虚、气血衰少等“本虚”极易引起气血津液运行不畅,以致血瘀、痰毒等“标实”互生,由此毒邪侵袭,脑络受损累及神明[18-19]。传统中药防治脑卒中积累了丰富实践经验,20世纪80年代湖北恩施地区中药资源普查发掘出散在民间的天珠散,《土家医方剂学》谓之为“神衰症风痰型而设”,具有鲜明的地域性、民族性[20]。处方中的头顶一颗珠被誉为“神农架四大瑰宝”,极具道地性,乃治疗头痛眩晕之圣药,具有镇静安神、抗肿瘤、抗炎镇痛和改善脑缺血等药理作用[21-22];另一配伍天麻息风止痉、平抑肝阳、祛风通络,具有镇静、镇痛、抗惊厥、改善记忆、神经保护及增强免疫等药理作用[23]。土家民族医学对脑中风“玍毒内生,脑筋不用”病机的独特理解与中医经典理论实则契合,天珠散通过祛风散痰、解毒通络达到脑府得养、神明自复的功效。
本研究借鉴经典Longa线栓法复制大鼠局灶性脑缺血再灌注模型,采用神经功能缺失评分评估亚急性期(数小时至数天)神经功能缺损程度,结果显示造模后大鼠出现明显神经功能损伤,但随时间的延长,各组大鼠Longa评分呈下降恢复趋势,说明在动物脑梗死后期有自发性好转倾向,这可能由于啮齿类动物自身神经再生修复性强,部分皮质区血液重新分配和代偿,使处于缺血半暗带的脑组织代谢和功能得到局部恢复[24]。另外天珠散高剂量组灌胃第7天、第10天的Longa评分和天珠散中剂量组灌胃第10天的Longa评分均明显低于同期模型组,说明一定剂量的天珠散能够促进脑缺血再灌注损伤大鼠神经功能恢复。
运动障碍是脑卒中最常见的后遗症之一,因此行为学测试中设置转棒实验评估大鼠的运动和共济水平。本实验结果显示,天珠散能不同程度延长脑缺血再灌注损伤大鼠的转棒停留时间,从宏观行为学上表明天珠散具有保护神经功能作用。
欧洲卒中组织(ESO)发布的《急性缺血性脑卒中静脉溶栓指南(2021版)》中强调指出高级脑成像(颅脑MRI或CTP)为症状诊断发作或醒后卒中是否启用阿替普酶静脉溶栓治疗的重要依据[25]。本研究结合高空间分辨率的MRI动态影像和TTC染色结果显示天珠散能有效降低脑缺血再灌注大鼠脑梗死体积,客观表明天珠散可抗脑缺血再灌注损伤。中枢神经系统中的灰质主要由神经元的胞体树突组成,主导神经中枢的高级功能如语言、思维、运动等;白质由神经元髓鞘包围的轴突组成,负责大脑的神经传导系统;海马则是脑内参与记忆贮存功能的重要部分,与认知关系密切;肢体瘫痪、言语不清、认知障碍等症状均与这些部位脑缺血损伤息息相关。本研究HE染色结果从微观病理学上表明天珠散能减轻缺血脑组织的病理损伤。
Wnt信号是中枢神经系统发育和成熟过程中重要的调控信号通路之一,肿瘤、心脑血管疾病、衰老等诸多疾病的病理生理机制都与此信号转导相关。Wnt信号转导模式有经典Wnt/β-catenin、平面细胞极性(PCP)和Wnt/Ca2+3种途径,而神经干细胞的生长、增殖分化主要由经典Wnt/β-catenin途径调控,其影响涉及神经元突触结构、神经血管单元重塑和维持血脑屏障稳态等过程[6]。通路启动因子Wnt蛋白包含Wnt1和Wnt5a两个亚族,Wnt3a则是激活经典途径配体Wnt1家族重要成员[26]。当Wnt信号激活时,Wnt配体蛋白与跨膜受体卷曲蛋白(Frizzled)及低密度脂蛋白受体相关蛋白(LRP5/6)结合,通过募集胞质中的散乱蛋白(Dishevelled)拮抗糖原合成酶激酶3β、APC和Axin蛋白形成降解复合物(GSK-3β/APC/Axin)以此阻断β-catenin磷酸化降解,胞质中聚集的游离β-catenin进入核内与转录因子家族(TCF/LEF)结合,特异性启动下游靶基因转录及表达的调控[6,27]。MAP-2作为神经细胞骨架成分,既是一种结构蛋白又是功能蛋白,主要在神经元胞体、树突和突触后致密区表达,其在神经元发育过程中发挥着稳定结构、调节树突生长和突触可塑性等重要功能[28],决定着修复脑缺血再灌注损伤的神经发生作用。目前研究发现Wnt信号与骨形成蛋白在神经分化过程中发挥重要协同作用,Wnt3a蛋白不同活性时神经干细胞增殖分化则表现不同,当Wnt3a活性下调时,神经干细胞的增殖和血小板源生长因子(PDGFR)标记阳性的少突胶质细胞分化被抑制,转向MAP-2标记阳性的神经元和胶质纤维酸性蛋白(GFAP)标记阳性的星形胶质细胞分化[29]。活化的星形胶质细胞通过摄取谷氨酸、清除氧自由基和分泌神经营养因子等方式保护神经元[30]。本实验结果显示,Wnt信号在大脑中动脉缺血再灌注损伤刺激下介导Wnt3a蛋白应激性高表达,同时诱导缺损神经元MAP-2蛋白表达降低,神经元细胞骨架遭破坏,轴突条索断裂,轴浆转运功能下降;天珠散干预后Wnt3a蛋白表达降低而MAP-2蛋白表达增加,说明其通过调节Wnt3a与MAP-2蛋白表达影响Wnt信号转导,继而调控神经干细胞的增殖分化和突触重构。
综上所述,天珠散能降低脑缺血再灌注大鼠Longa评分和脑梗死体积,延长转棒停留时间,促进运动功能恢复并减轻缺血脑组织的病理损伤程度,整体发挥抗脑缺血再灌注神经功能缺损的作用,其机制可能与调控Wnt信号转导关键效应分子Wnt3a及MAP-2蛋白的表达,促进神经干细胞对神经元和星形胶质细胞的增殖分化,稳定神经细胞骨架结构改善突触功能重塑有关。但除Wnt/β-catenin信号通路外,诸如PI3K/Akt、AMPK、NF-κB、Notch/Nrf2等其他信号转导也参与调控脑缺血再灌注损伤病理生理过程中的能量代谢、细胞焦亡、信号传递及神经炎性[31],天珠散促进脑缺血再灌注损伤后神经保护尚需多机制、多靶点切入研究。同时,行为学测试仅根据评分量表和肢体运动的简单反射观察,难以全面反映脑缺血大鼠在运动、感觉、情感等方面的缺失,建立基于中医证候下模拟卒中因素的高血压、糖尿病等品系动物复合模型及综合评价体系可能更具临床指导性。
利益冲突:所有作者均声明不存在利益冲突。

