红果樫木叶中1个新的三萜类化合物
闫慧娇,陈雨洁,林云良,李恩霞,段文娟,耿岩玲*
• 化学成分 •
红果樫木叶中1个新的三萜类化合物
闫慧娇1, 2,陈雨洁3,林云良1, 2,李恩霞1, 2,段文娟1, 2,耿岩玲1, 2*
1. 齐鲁工业大学(山东省科学院),山东省分析测试中心,山东省大型精密分析仪器应用技术重点实验室,山东 济南 250014 2. 齐鲁工业大学(山东省科学院)药学院,山东省高等学校天然药物活性成分研究重点实验室,山东 济南 250014 3. 山东省食品药品审评查验中心,山东 济南 250014
研究红果樫木的化学成分及抗肿瘤活性。采用多种色谱方法结合进行化合物分离纯化,根据1D和2D核磁共振及质谱数据鉴定结构。采用MTT法对化合物进行肿瘤细胞增殖毒性评价。从红果樫木叶提取物中得到2个具有由C2-C3碳键断裂C2-C6碳键闭环产生的双环[3,2,1]辛烷环骨架结构的三萜类化合物,分别为2,3-2,6-cyclo2a,29-dihydroxytirucalla-7,24-dien-23-oxo-3,9b-olide(1)、aphanamgrandiol A(2)。化合物1对人肺癌H1975细胞和人结肠癌HCT116细胞的半数抑制浓度(half inhibitory concentration,IC50)分别为(48.8±2.4)、(28.7±1.6)μmol/L,化合物2对2种肿瘤细胞的IC50值分别为(44.4±2.1)、(32.5±1.8)μmol/L。化合物1为新化合物,命名为大叶山楝三萜B。化合物2首次从樫木属植物中分离得到。化合物1和2对肿瘤细胞具有一定的增殖抑制作用。
红果樫木;三萜;大叶山楝三萜B;aphanamgrandiol A;肿瘤细胞增殖毒性
红果樫木(Roxb.) Hook. f. ex Bedd.为楝科(Meliaceae)樫木属(或称葱臭木属)Blume乔木。樫木属全属约75种,主要分布于热带亚热带地区[1]。樫木属植物具有很高药用价值,多为斯里兰卡、印度等东南亚地区居民的传统用药,用于治疗发烧、关节炎、神经性厌食症、痉挛、驱逐小肠蠕虫、四肢麻木等症[2-3]。据《中国植物志》载,中国产樫木属有15种以及1变种,主要分布于台湾、云南、广西、广东、海南等省区[4]。楝科植物富含由三萜类化合物高度氧化、降碳、分子重排等形成的结构复杂的化学成分,其中以柠檬苦素类为代表。樫木属植物中三萜种类丰富,存在A环开环及侧链降碳,但高度氧化变形三萜的报道相对较少[5-9]。
本研究从红果樫木叶90%乙醇提取物中鉴定了2个具有稀有骨架结构的三萜类化合物,其结构特征为原甘遂烷型四环三萜A环C2-C3碳键断裂形成C2-C6碳键,从而使化合物具有双环[3,2,1]辛烷环结构,分别为2,3-2,6-cyclo2a,29-dihydroxytirucalla- 7,24-dien-23-oxo-3,9b-olide(1)、aphanamgrandiol A(2),见图1。化合物1为新化合物,命名为大叶山楝三萜B。双环[3,2,1]辛烷环体系被认为是一种存在于天然产物中的重要活性结构单元,在一些具有生物活性的倍半萜、二萜中发现[10-11]。如近年来报道的抗肿瘤的异贝壳杉烯二萜,包括eriocalyxin B、oridonin、ludongnin J等,代表性的结构单元是官能团化的C/D双环[3.2.1]辛烷环体系。具有抗肿瘤活性的赤霉素(gibberellins)类中也含有双环[3,2,1]辛烷碳结构。新型天然抗生素平板霉素platensimycin中包括双环[3,2,1]辛烷骨架的笼状结构是其主要的活性位点[12-15]。
据文献报道,aphanamgrantiol A是第1个具有双环[3,2,1]辛烷环结构的三萜化合物。Aphanamgrandiol A是由张卫东课题组[16]2013年从大叶山楝中分离得到的新骨架化合物,并经过X-ray确定结构。而此次发现的新化合物,根据scifinder搜索结果,化合物1为第2个具有此类骨架的三萜。此外,本研究还对这2个化合物进行了抗肿瘤活性研究。细胞毒活性测试结果显示化合物1和2对人肺癌H1975细胞和人结肠癌HCT116细胞表现出较好的细胞毒活性。
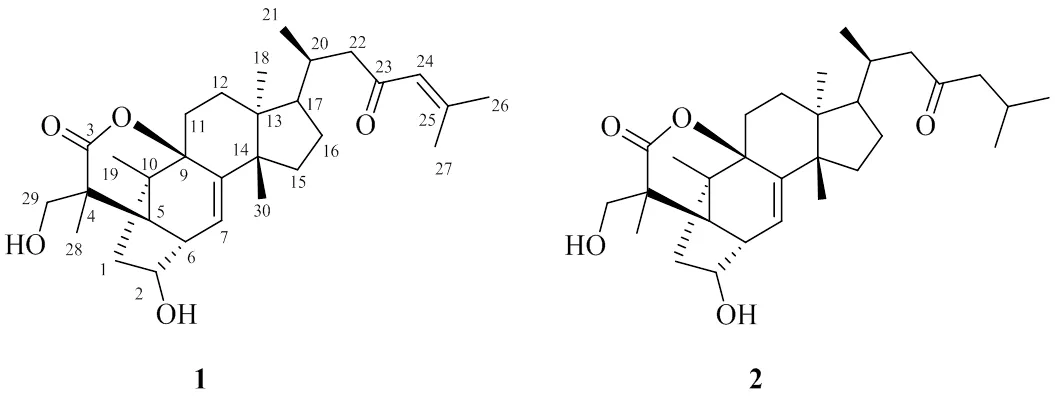
图1 化合物1和2的结构
1 仪器与材料
岛津LC-6AD型半制备高效液相(日本岛津公司);S6000型高效液相色谱仪(北京华谱科仪科技有限公司);R100型旋转蒸发仪(瑞士Buchi公司);安捷伦6520型质谱仪(美国Agilent公司);布鲁克Bruker AVIII HD 600核磁共振波谱仪(德国Bruker公司);Spark多功能酶标仪(美国TECAN公司)。
D101大孔树脂(净品级,沧州宝恩树脂);正相柱色谱用硅胶(100~200目,青岛海洋化工);Sephadex LH-20(20~150 μm,美国GE Healthcare);分析纯乙醇、甲醇、二氯甲烷、石油醚、醋酸乙酯(天津市化学试剂厂);色谱纯乙腈(山东禹王试剂有限公司);顺铂(cisplatin,上海源叶生物科技有限公司,批号180901)、四甲基偶氮唑盐(MTT,上海源叶生物科技有限公司);PMI Medium 1640培养基、DMEM高糖培养基、胎牛血清(美国Gibco公司);胰酶溶液、磷酸盐缓冲溶液(phosphate buffer saline,PBS,碧云天生物技术有限公司)。
人结肠癌HCT116细胞(ATCC目录号TCHu99)、人肺癌H1975细胞(ATCC目录号TCHu193)购于中国科学院上海细胞库。
红果樫木于2022年8月采集于斯里兰卡Matara,经西双版纳热带植物园张顺成研究员鉴定为楝科樫木属植物红果樫木(Roxb.) Hook. f. ex Bedd.叶,标本(HG202208S)保存于山东省分析测试中心。
2 提取与分离
干燥后的红果樫木叶(约5.0 kg)经5倍量的90%乙醇-水加热回流提取,每次3 h,提取3次。合并提取液,减压浓缩得粗浸膏(300 g)。上述粗浸膏用3 L水混悬,依次以等体积石油醚、二氯甲烷及醋酸乙酯分别萃取3次。二氯甲烷萃取物(60 g)经D101大孔树脂柱色谱色谱,乙醇水(100%水~100%乙醇)梯度洗脱,得5个组分Fr A~E。Fr D(5 g)经硅胶柱色谱分离,以二氯甲烷-甲醇(100∶1~1∶1)梯度洗脱,TLC检测合并得6个组分Fr D1~D6,Fr D2(300 mg)经Sephadex LH-20凝胶柱(甲醇)分离及半制备高效液相色谱制备(76%乙腈-水洗脱,体积流量8 mL/min)得到化合物1(1.1 mg,R=37.9 min)和2(2.1 mg,R=44.1 min)。
3 结构鉴定
化合物1:白色无定型粉末。[α]20 D+34.9° (0.04, MeOH),HRESIMS显示分子离子峰/485.326 4 [M+H]+(calcd for C30H45O5,485.326 2),提示该化合物分子式为C30H44O5,不饱和度为9。IR谱图显示化合物1存在羟基(3435 cm−1)、羰基(1711,1685 cm−1)和双键(1620 cm−1)等特征吸收峰。1H- NMR谱中显示出6个角甲基的特征单峰信号H0.69 (s, H-18), 1.23 (s, H-19), 2.17 (s, H-26), 1.91 (s, H-27), 1.38 (s, H-28), 1.10 (s, H-30), 1个甲基双峰信号0.94 (d,= 6.6 Hz, H-21),2个烯氢信号H5.65 (d,= 6.6 Hz, H-7),6.07 (s, H-24),3个连氧氢信号H4.07 (d,= 6.4 Hz, H-2),3.88 (d,= 10.8 Hz, H-29a),3.37 (d,= 10.8 Hz, H-29b)。在13C-NMR谱中显示30个碳原子信号,结合1H-NMR、13C-NMR及HSQC谱图信息,这30个碳信号可以分为:7个甲基碳信号、7个亚甲基碳信号(包含1个连氧碳C70.6)、7个次甲基碳信号(包含1个连氧碳C73.2和2个烯碳C124.5, 124.5)、9个季碳信号(包含2个烯碳C145.3, 155.0,1个酮羰基碳C201.2,1个酯羰基碳C178.7和1个连氧季碳C84.2)。初步提示该化合物为变形的四环三萜衍生物。
仔细对比化合物1的1D和2D NMR数据,与已知化合物aphanamgrandiol A有相同类型的新颖的骨架结构。其结构特征为原甘遂烷型四环三萜A环C2-C3碳键断裂形成C2-C6碳键,从而使化合物具有双环[3,2,1]辛烷环结构。同时C-3与C-9通过酯键相连形成包括C-3、C-4、C-5、C-9和C-10的六元内酯环。化合物aphanamgrandiol A在本实验中亦分离得到,二者结构非常相似,不同之处为化合物1侧链C-24和C-25之间存在双键。
借助2D-NMR实验可以进一步确证结构(图2)。角甲基Me-18与C-12、C-13、C-14和C-17的HMBC相关信号,角甲基Me-30与C-8、C-15、C-13和C-14的HMBC相关信号确证了甘遂烷型四环三萜C、D环的基本骨架。烯氢5.65 (d,= 6.6 Hz, H-7) 与C-9 (C84.2),C-5 (C48.1) 和C-14 (C50.7) 的HMBC相关信号,提示C-7和C-8之间双键的存在。
HMBC谱中未观测到H2-1及H-2与C-3和C-4之间的相关信号,提示C-2与C-3之间开环。HMBC谱中连氧次甲基质子H4.07 (d,= 6.4 Hz, H-2) 与C-7 (C124.5)、C-5 (C48.1) 的HMBC相关信号,H2-1 (H2.39) 与C-10 (C43.4) 的HMBC相关信号,H-6 (H2.53) 与C-2 (C73.2)、C-1 (C44.5)、C-7 (C124.5)、C-8 (C145.3) 的HMBC相关信号,H-5 (H2.07) 与C-7 (C124.5)、C-9 (C84.2) 的HMBC相关信号,提示C2与C6直接相连,与B环组形成了双环[3,2,1]辛烷环结构。
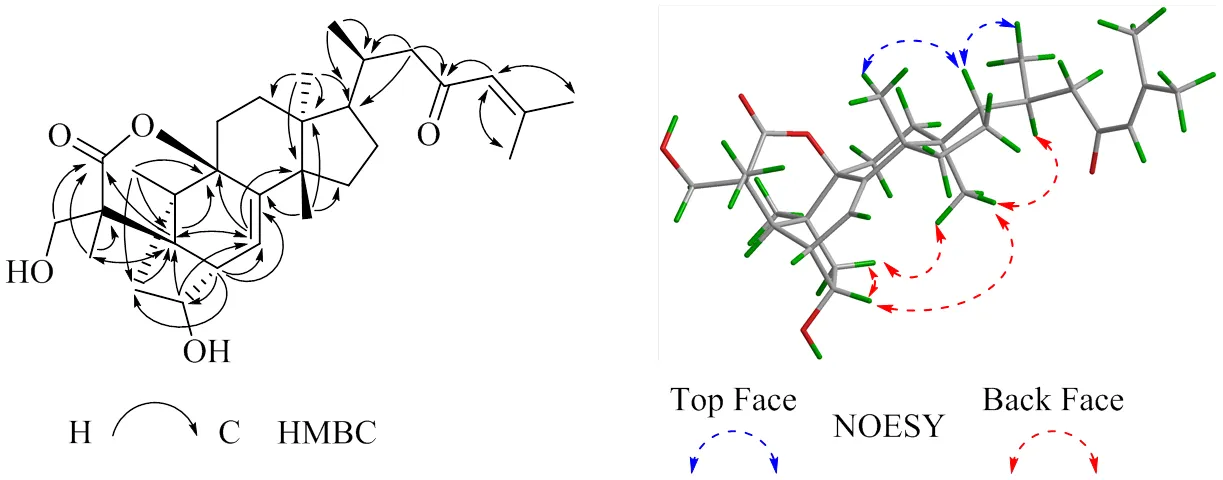
图2 化合物1的主要HMBC和NOESY相关
C-9信号(C84.2) 的低场化学位移提示存在C-3、C-4、C-5、C-9及C-10组成的六元内酯环。HMBC谱中H-5 (H2.07) 与酯羰基C-3 (C178.7),连氧碳C-9 (C84.2),连氧亚甲基C-29 (C70.6) 相关信号,Me-28 (H1.38) 与C-3 (C178.7)、C-4 (C42.6)、C-5 (C48.1)、C-29 (C70.6) 相关信号,H-29b与C-3 (C178.7)、C-4 (C42.6)、C-5 (C48.1)、C-28 (C20.8) 相关信号,H-29a与C-3 (C178.7)、C-28 (C20.8) 相关信号证实了六元内酯环的存在。
侧链的结构同样通过HMBC谱图证明。Me-21 (H0.94) 与C-17 (C50.2)、C-20 (C33.2)、C-22 (C51.4) 的HMBC相关,H-22a (H2.49, dd,= 15.7, 2.7 Hz) 与C-17、C-21 (C20.0)、C-20 (C33.2)、C-23 (C201.2) 的HMBC相关,证明C-23位上存在羰基。Me-26和Me-27与C-25 (C155.0) 和C-24 (C124.5) 的HMBC相关,以及H-24 (H0.94) 与C-23 (C201.2)、C-26 (C20.7)、C-27 (C27.9) 的HMBC相关,证明了存在C-24 (25) 位双键。其他的HMBC信号(图2)进一步的确定了侧链的结构。
如前所述,化合物1是由原甘遂烷型四环三萜C2-C3开环,C2-C6闭环产生的新型三萜。NOESY谱中可以观察到Me-30b/H-17b, H-17b/Me-21,Me-18a/H-20a特征性的信号,表明化合物1符合甘遂烷型三萜结构特征。同时存在H-2/H-18a、H2-1/H-18a及H-2/H2-1的NOESY信号,仔细对比化合物1与化合物aphanamgrandiol A(文献经过X-ray确定构型[16])的一维以及二维核磁数据信号,发现二者除侧链数据外,其余信号非常相似,由此进一步推定化合物1结构见图1。
综合上述信息,对化合物1的碳氢信号进行了准确的归属(表1)。经过SciFinder Scholar网络检索,未发现相关报道,表明化合物1为1个新的三萜类化合物,将其命名为大叶山楝三萜B。

表1 化合物1和2的1H-和13C-NMR数据(600/150 MHz, CDCl3)
4 活性测试
采用MTT法对得到的化合物进行抗肿瘤的活性评价,以顺铂为阳性药[17]。数据分析显示,化合物1对H1975细胞和HCT116细胞的半数抑制浓度(half inhibitory concentration,IC50)分别为(48.8±2.4)、(28.7±1.6)μmol/L,化合物2对2种肿瘤细胞的IC50值分别为(44.4±2.1)、(32.5±1.8)μmol/L,顺铂对2种肿瘤细胞的IC50值分别为(10.9±1.8)、(10.7±1.6)μmol/L。
5 讨论
本实验从红果樫木叶中共分离鉴定了2个具有双环[3,2,1]辛烷环骨架结构的三萜类化合物,化合物1为新化合物,也是目前为止发现的第二个具有此类骨架的三萜。而此类化合物的发现可能为研究甘遂烷型三萜的结构转变转化提供新的思路。张卫东课题组[16]认为此类化合物形成以tirucallol [(3β,13α,14β,17α,20)-lanosta-8,24-dien-3-ol]为前体,首先,通过Wagner-Meerwein重排形成Δ6,7双键。其次,通过氧化反应形成C-2和C-3的酮羰基,然后在C-2和C-3之间通过如Bayer-Villiger氧化反应发生A环裂解。第三,经过氧化反应和酯化反应,C-3与C-9通过酯键相连形成六元内酯环。第四,C-2和C-6的羰基之间发生亲核反应,同时发生Δ6,7双键裂解。第五,随着H-8的丢失,C-2和C-6连接与Δ7,8双键形成。侧链则由Δ24,25经过系列氧化反应,生成羰基及双键。生物活性表明化合物1和2对2种肿瘤细胞表现出了较好的抗肿瘤活性,后期可针对其抗肿瘤机制进行深入研究。以上结果丰富了樫木属化学成分,为进一步阐明樫木属植物药效物质基础提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 邹寿青. 云南樫木属植物修订 [J]. 云南植物研究, 1989, 11(2): 154-158.
[2] Weiner M A.[M]. Berkely: University of California, 1984.
[3] Arya D.hook. f.: A promising herbal drug used in folk medicine by tharu community of uttarakhand [J]., 2017: 296-301.
[4] 中国科学院中国植物志编辑委员会. 中国植物志 (第 43 卷) [M]. 北京: 中国科学出版社, 1997: 90.
[5] Naini A A, Mayanti T, Supratman U. Triterpenoids fromgenus and their biological activities [J]., 2022, 45(2): 63-89.
[6] Yan H J, Wang J S, Kong L Y. Cytotoxic dammarane-type triterpenoids from the stem bark of[J]., 2014, 77(2): 234-242.
[7] Pham N K, Bui H T, Tran T H,. Dammarane triterpenes and phytosterols fromPierre and their anti-inflammatory activity against liver X receptors and NF-κB activation [J]., 2021, 175: 108902.
[8] Zou Y H, Liu W T, Zhang J X,. Triterpenoids from the bark ofand their anti-inflammatory and radical scavenging activity [J]., 2017, 121: 159-163.
[9] Huang R, Zhao Y, Wang Y,. Cytotoxic ring A-seco triterpenoids from the stem bark of[J]., 2018, 20(9): 860-866.
[10] Abad A, Agulló C, Cuñat A,. Synthesis of highly functionalised enantiopure bicyclo[3.2.1]-octane systems from carvone [J]., 2004, 9(5): 287-299.
[11] Hanson J R. Diterpenoids [J]., 2002, 19(2): 125-132.
[12] Mao Z W, Li Y, Chen J B,. Recombination of diterpenoid structure units: Synthesis of antitumor amides bearing functionalized bicyclo[3.2.1]octane ring [J]., 2010, 20(14): 4116-4119.
[13] Wang L, Zhao W L, Yan J S,. Eriocalyxin B induces apoptosis of t(8;21) leukemia cells through NF-κB and MAPK signaling pathways and triggers degradation of AML1-ETO oncoprotein in a caspase-3-dependent manner [J]., 2007, 14(2): 306-317.
[14] Meade-Tollin L C, Kithsiri Wijeratne E M, Cooper D,. Ponicidin and oridonin are responsible for the antiangiogenic activity of, a constituent of the herbal supplement PC SPES [J]., 2004, 67(1): 2-4.
[15] Han Q B, Zhao A H, Zhang J X,. Cytotoxic constituents ofvar.[J]., 2003, 66(10): 1391-1394.
[16] Zeng Q, Guan B, Ren J,. Aphanamgrandiol A, a new triterpenoid with a unique carbon skeleton from[J]., 2013, 86: 217-221.
[17] Yan H J, Si H L, Zhao H W,. Four new cycloartane triterpenoids from the leaves of[J]., 2021, 41: 101-105.
A new triterpenoid from leaves of
YAN Hui-jiao1, 2, CHEN Yu-jie3, LIN Yun-liang1, 2, LI En-xia1, 2, DUAN Wen-juan1, 2, GENG Yan-ling1, 2
1. Shandong Key Laboratory for Applied Technology of Sophisticated Analytical Instruments, Shandong Analysis and Test Center, Qilu University of Technology (Shandong Academy of Sciences), Jinan 250014, China 2. Key Laboratory for Natural Active Pharmaceutical Constituents Research in Universities of Shandong Province, School of Pharmaceutical Sciences, Qilu University of Technology (Shandong Academy of Sciences), Jinan 250014, China 3. Shandong Center for Food and Drug Evaluation and Inspection, Jinan 250014, China
To study the constituents fromand their anti-tumor activities.Various column chromatographic methods were used for chemical constituents isolation. The structures were identified by NMR and MS spectral analysis, and their cytotoxic activities to cancer cells were investigated by MTT method.Two triterpenoid with a bicycle [3,2,1]octane ring skeleton produced by 2,3-ring opening and 2,6-ring closure were obtained, which were identified as 2,3-2,6-cyclo2a,29-dihydroxytirucalla-7,24-dien-23-oxo-3,9b-olide (1) and aphanamgrandiol A (2). The half inhibitory concentration (IC50) of compound 1 on human lung cancer H1975 cells and human colon cancer HCT116 cells was (48.8 ± 2.4) and (28.7 ± 1.6) μmol/L, respectively. IC50of compound 2 on H1975 and HCT116 cells was (44.4 ± 2.1) and (32.5 ± 1.8) μmol/L.Compound 1 is identified as a new compound and named 24(25)-en aphanamgrandiol A and compound 2 is isolated fromfor the first time. Compound 1 and 2 exhibited moderate cytotoxicity.
(Roxb.) Hook. f. ex Bedd.; triterpenoids; structure identification; 24(25)-en aphanamgrandiol A; aphanamgrandiol A; cytotoxic activities to cancer cells
R284.1
A
0253 - 2670(2023)22 - 7331 - 05
10.7501/j.issn.0253-2670.2023.22.009
2023-08-25
国家自然科学基金资助项目(32200311);济南市高校20条(202228020);齐鲁工业大学(山东省科学院)科教产融合创新试点工程项目(2022PX029)
闫慧娇,博士,副研究员,研究方向天然药物化学。E-mail: yanhuijiao01@163.com
通信作者:耿岩玲,女,副研究员,研究方向为中药学,天然活性成分高值化利用。E-mail: gengyanling@126.com
[责任编辑 王文倩]