松萝提取物对胶原诱导性关节炎大鼠HMGB1-RAGE通路及自噬相关基因的影响
赵青青,安 阳,张 军,徐 晖,陆道敏,曹跃朋,宁乔怡,王 莹
(1.贵州中医药大学,贵阳 550001;2.贵州中医药大学第二附属医院风湿免疫科,贵阳 550001)
类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,其主要病理改变在滑膜组织,以对称性、破坏性关节炎为特征,致残率高[1]。滑膜细胞自噬参与了RA关节的炎症与损坏,高迁移率族蛋白B1(high mobility group protein,HMGB1)是重要的细胞自噬调节基因,近年来研究认为其与高亲和力受体也就是晚期糖基化终产物受体(the receptor of advanced glycation endproducts,RAGE)结合,促进滑膜成纤维细胞(synovialfibroblast,SF)迁移、增殖和分化,进而导致关节破坏和功能丧失[2]。研究证实,HMGB1-RAGE可以激活死亡相关蛋白激酶(death-associated protein kinase,DAPK)促使Beclin1磷酸化,诱导Beclin1与B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)分离,调节细胞自噬[3],调控关节炎症。
侗药松萝性味甘、平,有除湿通络、清热解毒之功。有研究证实,松萝提取物有抗炎、镇痛、抑制血管生成等作用[4]。课题组在前期的临床研究中证实松萝的组方可改善RA患者的临床症状和体征,降低炎症水平[5]。动物实验研究显示,松萝制剂能减轻胶原诱导性关节炎(collagen-induced arthritis,CIA)模型大鼠关节肿胀,降低滑膜细胞活化核转录因子κB(nuclear factor kappa B,NF-κB)的蛋白活性[6-7]。本研究探讨松萝提取物对HMGB1-RAGE通路及自噬相关基因的影响。
1 材料与方法
1.1 材料
SPF级Wistar大鼠54只,雌性,5周龄,体重(160±10)g,购自湖北省实验动物研究中心,许可证号SCXK(鄂)2020-0018,饲养于贵阳中医学院实验动物中心。电热恒温培养(ICV-450)购自日本ASONE公司;离心机(HI650)购自湖南湘仪实验室仪器开发有限公司;HMGB1检测试剂盒(SEA399Ra)购自武汉优尔生商贸有限公司;QuantiCyto®Rat IL-6 ELISA kit(ERC003.48)购自深圳欣博盛生物科技有限公司;磷酸酶抑制剂(S1873)、RIPA裂解液(P0013B)、BCA蛋白浓度测定试剂盒(P0010)购自上海碧云天生物技术有限公司;Taq Plus DNA Polymerase(ET105-01)购自日本TINGEN公司;松萝提取物[批号:IU0130,其主要成分为松萝酸(纯度>98%)]、羟氯喹(HCQ,批号:IH0720)购自北京索莱宝科技有限公司。
1.2 方法
1.2.1分组和建模
饲养环境(22±2)℃、湿度约70%,适应性豢养1周启动实验。采用随机数字表法将大鼠分为松萝提取物低剂量组、松萝提取物中剂量组、松萝提取物高剂量组、HCQ组、模型组、空白组[8],每组9只。
牛Ⅱ型胶原放置醋酸(0.1 mol/L)内溶解,充分混合(2 mg/mL溶液),4 ℃冰箱静置1 d。等量混合弗氏全佐剂同时乳化得到Ⅱ型胶原乳液,向大鼠尾根部注射0.1 mL以诱导炎症,构建稳定的CIA大鼠模型[9]。有效建模的标准:经由关节炎评分显示模型大鼠的趾端到踝关节区域见红肿现象,同时关节炎评分在4分以上[10]。
根据课题组先前的实验经验[4]及临床成人用量(常规15 g、小量6 g、大量120 g)之间的比例,本研究松萝提取物给药低剂量为2 mg/kg,中剂量为6 mg/kg,高剂量为54 mg/kg。HCQ成人用量为每天400 mg,根据60 kg成人和动物药物剂量对应换算系数表,双方换算系数W=5.4,即大鼠用药剂量为人用药剂量的5.4倍[11],由此每只大鼠用药量为每天36 mg。各组给予相应药物灌胃,空白组及模型组灌胃等量生理盐水,每天1次,连续灌胃28 d。
1.2.2样品采集
待最后1次灌胃结束后2 h,经腹腔注入0.4 mL/100 g氨基甲酸乙酯行麻醉处理,采集5 mL左右的股动脉血液室温下静置0.5 h,3 000 r/min离心15 min,提取血清,待后续实验。处死大鼠,取后右足踝关节,分离出滑膜组织,检测蛋白水平。
1.2.3ELISA检测血清致炎因子水平
采集大鼠血液,常规离心,分离血清,ELISA检测HMGB1、IL-6水平。按照相关试剂盒说明进行操作,37 ℃反应30 min温育,洗板5次,加入酶标试剂,37 ℃反应,再洗板5次,加入显色液A、B,37 ℃显色10 min,加入终止液,酶标仪在450 nm波长处测量吸光度(A)值。
1.2.4RT-PCR检测Bcl-2、Beclin1和Ⅲ型磷酸肌醇3激酶(ptdlns3K Class 3,PI3K C3)mRNA表达
完成总RNA的提取和对cDNA的逆转录合成。合成条件:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 30 s,60 ℃ 30 s,40个循环。测定Bcl-2、Beclin1、PI3K C3 mRNA表达。引物设计见表1。

表1 Beclin1、Bcl-2、PI3K C3引物序列
1.2.5Western blot检测HMGB1、RAGE、Beclin1、Bcl-2和PI3K C3蛋白表达
将剪碎的滑膜组织块匀浆,冰上裂解30 min后,在4 ℃下12 000 r/min离心5 min,取上清液。以BSA为标准,Bradford 法对上清液进行蛋白定量。随后进行蛋白变性,SDS-PVDF电泳,TBST封闭液浸泡PVDF膜,室温摇床封闭2 h。一抗4 ℃过夜,二抗孵育2 h,反复洗膜,显色曝光,分析目的条带相对灰度值。
1.2.6关节滑膜病理形态学观察
取关节滑膜组织,4%多聚甲醛溶液,石蜡包埋,常规HE和胶原纤维染色。光镜下观察滑膜细胞病理改变,图像分析系统分析结果。
1.2.7透射电子显微镜观察自噬体情况
将待观察细胞离心,洗涤,戊二醛、锇酸固定,丙酮梯度脱水,浸泡,包埋,修块,定位,切片,染色。在透射电镜下观察细胞自噬体和自噬泡的形成。
1.3 统计学处理
2 结 果
2.1 各组大鼠关节炎指数和关节肿胀情况
与模型组[(3.50±0.53)分]比较,HCQ组[(1.62±0.74)分]和松萝提取物中、高剂量组[(2.25±0.88)分、(1.75±0.70)分]关节炎指数降低(P<0.05),关节红肿情况明显缓解;与HCQ组比较,松萝提取物中、高剂量组关节炎指数、红肿情况无明显变化(P>0.05),松萝提取物低剂量组[(3.00±0.75)ng/mL]关节炎指数升高(P<0.05),见图1。

A:空白组,无关节发红、肿胀;B:模型组,可见脚趾延续到整个踝关节重度红肿;C:松萝提取物低剂量组,可见足爪关节红肿较模型组稍缓解;D、E、F:分别为松萝提取物中、高剂量组及HCQ组,可见足爪关节红肿明显缓解。
2.2 关节滑膜细胞病理形态学
空白组病理结构正常。模型组可见滑膜细胞明显增生,并伴有炎性细胞浸润,血管翳形成。与模型组比较,各剂量松萝提取物组及HCQ组滑膜细胞增殖程度逐渐减低,滑膜细胞层数减少,排列更整齐,见图2。

A:空白组;B:模型组;C:松萝提取物低剂量组;D:松萝提取物中剂量组;E:松萝提取物高剂量组;F:HCQ组。
2.3 各组大鼠IL-6、HMGB1水平
与空白组比较,模型组IL-6与HMGB1水平升高(P<0.05);与模型组比较,松萝提取物低、中、高剂量组、HCQ组HMGB1、IL-6水平降低(P<0.05);与HCQ组比较,松萝提取物低剂量组HMGB1、IL-6水平升高(P<0.05),松萝提取物中、高剂量组HMGB1、IL-6水平无明显变化(P>0.05),见表2。
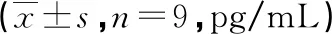
表2 各组大鼠血清中IL-6、HMGB1水平比较
2.4 各组大鼠滑膜组织Beclin1、Bcl-2与PI3K C3 mRNA表达
与空白组比较,松萝提取物不同剂量组、HCQ组和模型组Bcl-2、PI3K C3 mRNA表达升高,Beclin1 mRNA表达降低,差异有统计学意义(P<0.05);与模型组比较,HCQ组和松萝提取物中、高剂量组Bcl-2、PI3K C3 mRNA表达降低,Beclin1 mRNA表达升高(P<0.05);与HCQ组比较,松萝提取物高、中剂量组上述指标无明显变化(P>0.05),见表3。
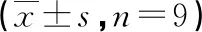
表3 各组大鼠滑膜组织Beclin1、Bcl-2与PI3K C3 mRNA表达比较
2.5 各组大鼠滑膜组织HMGB1、RAGE、Bcl-2、PI3K C3与Beclin1蛋白表达
与空白组比较,模型组HMGB1、RAGE、Bcl-2、PI3K C3蛋白表达升高,Beclin1蛋白表达降低,差异有统计学意义(P<0.05);与模型组比较,HCQ组和松萝提取物中、高剂量组HMGB1、RAGE、Bcl-2、PI3K C3蛋白表达降低,Beclin1蛋白表达升高,差异有统计学意义(P<0.05);与HCQ组比较,松萝提取物中、高剂量组上述指标无明显变化(P>0.05),见图3、表4。
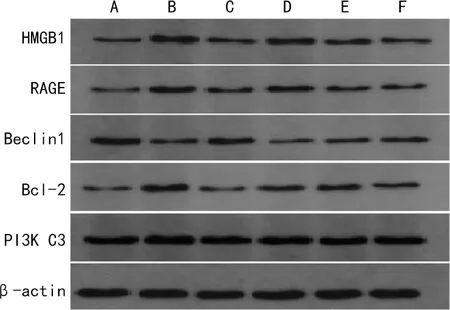
A:空白组;B:模型组;C:松萝提取物低剂量组;D:松萝提取物中剂量组;E:松萝提取物高剂量组;F:HCQ组。
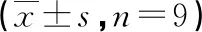
表4 各组大鼠滑膜组织HMGB1、RAGE、Bcl-2、PI3K C3与Beclin1蛋白表达比较
2.6 透射电子显微镜观察自噬体情况
透射电子显微镜观察发现,空白组滑膜组织中细胞线粒体结构完整,有少量自噬体形成,维持正常细胞代谢需求;与空白组比较,模型组细胞线粒体结构完整,数量有所增加,自噬体数量相对较少;与模型组比较,松萝提取物低剂量组细胞自噬体数量未见明显异常变化,松萝提取物中剂量组细胞自噬体数量增加,细胞出现一定固缩,凋亡程度加重,松萝提取物高剂量组及HCQ组自噬体数量增加更明显,见图4。
3 讨 论
RA属于一类尚无确切病因的多因素自身免疫性疾病,侗族医学属“水热病”范畴,主要是由于外感风、寒、湿、热等邪毒,导致“气血热、水火交争”的变化,致使脉道不通、气血水津代谢异常,机体蕴生“邪热”所致,不通则痛,不荣则痛,疼痛乃邪热蕴阻关节之外像[12]。在病因、病机及治疗理论上,侗医名家吴定元著《草木春秋》系统的描述了风湿病的发病特征,对风湿病提出“赶邪、消水”的诊疗方法,认为有邪当驱赶,肿胀宜消水。侗药松萝性味甘、平,有气无味而属阳,主表散、上升,使在表之邪气得以发散,在内的水湿得以宣发肃降、通调水道,让水液自流;该药生于树颠而下垂,位阳兼有阴的属性,主里、下降,可通过利水分消在内之邪。具有祛风除湿通络、消肿止痛、清热解毒化邪气之功[13],可治风湿痹痛、跌打损伤。
自噬是一种参与细胞解决应激、修复损伤和维持稳态的重要代谢过程。但过度自噬或持续时间过长,会引起细胞代谢紊乱甚至细胞凋亡[14]。研究表明,自噬在滑膜炎的发生和发展中发挥了重要作用,自噬失调可能导致炎症反应的加剧和RA发病[15]。HMGB1及其受体RAGE的表达和激活可以促进自噬的发生和早期阶段的进展,同时HMGB1还可以通过启动NF-κB和丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)等多种信号通路,促进IL-6等炎症因子的释放来促进炎症反应,进而影响自噬的进程[16]。在自噬初期,Beclin1与PI3K C3蛋白结合形成复合物[17],促进磷脂酰肌醇3-磷酸产生,从而促进自噬体形成和成熟。另外,Beclin-1与Bcl-2通过调节线粒体自噬清除病态线粒体等[18],保证细胞代谢的平稳和能量的供应。Brazilin(具有抗炎特性)处理RA滑膜细胞后,LC3-Ⅱ和Beclin1等与自噬相关的蛋白表达升高[19]。此外,用自噬抑制剂如氯喹类处理CIA大鼠模型后,可以有效减轻炎症反应、减少趋化因子的分泌等[20]。自噬在类风湿炎症中有重要的作用,调控自噬可能成为治疗类风湿疾病的一个重要手段。
本研究结果显示,与空白组比较,模型组大鼠关节炎指数明显升高,大鼠滑膜组织中HMGB1、RAGE、Bcl-2、PI3K C3蛋白表达明显升高,Bcl-2、PI3K C3 mRNA表达升高,Beclin1 mRNA和蛋白表达降低,表明模型制备成功。经过不同剂量松萝提取物或HCQ的干预后,大鼠关节炎指数有所下降,IL-6炎性因子水平改善,滑膜组织Beclin1 mRNA和蛋白表达有不同程度升高,HMGB1、RAGE、Bcl-2、PI3K C3蛋白表达降低,Bcl-2、PI3K C3 mRNA表达降低。与HCQ组比较,松萝提取物中、高剂量组的关节指数评分,血清IL-6、HMGB1水平,滑膜组织HMGB1、RAGE、Bcl-2、PI3K C3、Beclin1蛋白表达及Beclin1、Bcl-2、PI3K C3 mRNA表达无明显变化(P>0.05)。透射电子显微镜显示,松萝提取物中、高剂量组及HCQ组自噬体数量增加,细胞凋亡程度加重,松萝提取物可能通过调控细胞自噬达到抑制滑膜细胞炎症反应的作用。药物的剂量是影响治疗效果的重要因素,本研究表明松萝提取物低剂量组与模型组,松萝提取物中、高剂量组与HCQ组上述指标未显示明显差异,为确保治疗效果最大化,对该药物的剂量需进行深入的研究,发现最佳剂量以便更好地评估药物的疗效和安全性。
综上所述,松萝提取物可能通过调控自噬水平降低炎症反应。

