高压热灭菌中乳化剂吐温80 的应用研究
张变飞,杨 杰,毕 可,刘 月,辛伟山,张攀峰,章中
(宁夏大学食品科学与工程学院 银川 750021)
食品乳状液中微生物的生长会导致生产企业的重大经济损失,其原因是食品在保质期内因细菌、酵母和霉菌的生长而引起食物中毒或变质[1]。食品中最常见的乳剂有两种形式:水包油(如牛奶、乳脂或蛋黄酱)和油包水(如黄油或低脂酱)[2]。乳剂是由两种不相溶的液体形成的亚稳态胶体体系。在食品加工或储存过程中,乳液是热力学不稳定的体系,经常会发生絮凝、聚结和相分离(如乳化)的现象[3]。由于食品中蛋白质、脂类和乳化剂等各种成分的作用,系统中相邻液滴之间存在排斥力,因此它们可以在动力学上保持平衡。在这种复杂的食品乳剂中,许多因素都可能对微生物产生影响。在乳液中,水相通常被认为是微生物生长的场所[4]。在食品灭菌中,芽孢是最难以被灭活的物体[5]。高压热杀菌(HPTS)可使芽孢失活,对食品品质影响不大,与传统的热灭菌相比,HPTS 实现商业灭菌所需时间短。高压热灭菌为静态超高压和热结合,通常压力为400~900 MPa,温度50~100℃,保持15~20 min。吐温80 作为一种表面活性剂和乳化剂,对芽孢萌发和生长有一定的抑制作用,并具有抗菌活性,对界面现象也有很大的影响[6]。本试验设置不同的压力和温度,探讨HPTS 结合不同质量分数的吐温80 处理对枯草杆菌芽孢的杀灭效果。
1 材料与方法
1.1 材料与试剂
枯草芽孢杆菌(Bacillus subtilis),中国普通微生物菌种保藏管理中心(CGMCC),编号As1.433[7]。
硫酸锰(分析纯),天津市大茂化学试剂厂;吐温80(分析纯),国药集团化学试剂有限公司;ATP 酶试剂盒、考马斯亮蓝蛋白测定试剂盒,北京索莱宝科技有限公司。营养琼脂,天津市大茂化学试剂厂;TSA-YE 培养基,北京索莱宝科技有限公司。
1.2 仪器与设备
AL204 型电子天平,梅特勒-托利多仪器(上海)有限公司;PL202-L 型电子天平,梅特勒-托利多仪器(上海)有限公司;DSX-280B 型高压灭菌锅,上海申安医疗器械厂;LRH 系列生化培养箱,上海一恒科学仪器公司;DZ-500/2G 型落地式真空包装机,西安星火包装机械有限公司;HPP-600 MPa/5L 超高压灭菌装置,包头科发高压科技有限公司;TG16-W 型台式高速离心机,湘仪离心机仪器有限公司;TGL-10B 型离心机,上海安亭科学仪器厂;UV-9000S 型紫外可见分光光度计,上海元析仪器有限公司;Milli-Q/Gradient 超纯水仪,美国MilliPore 公司;754PC 型紫外-可见分光光度仪,上海菁华仪器有限公司。
1.3 方法
1.3.1 枯草杆菌芽孢的培养及菌悬液制备 芽孢的制备参照章中等[7]的方法,将活化至少3 代以上的枯草芽孢杆菌在已灭菌的促芽孢生长锰盐营养琼脂(营养琼脂培养基33 g 加入硫酸锰0.1538 g,蒸馏水1 000 mL,pH=7,加热煮沸3 次,分装试管内,121 ℃灭菌15 min)试管斜面进行划线接种,于37 ℃恒温培养7 d 后,向每支试管斜面中加入2 mL 无菌蒸馏水洗涤并收集菌体,合并菌悬液,在4 ℃以9 000 r/min 的转速离心15 min,弃上清液,重复上述步骤再洗涤3 次后,于80 ℃水浴10 min,保证悬浮液中营养体被完全杀灭。离心浓缩并重悬无菌蒸馏水中的芽孢,测定菌液吸光度并调节芽孢浓度约为1.5×109CFU/mL,4 ℃保存,有效期为3 个月。使用时经无菌蒸馏水稀释芽孢浓度至5×107CFU/mL,1 个月内使用。
1.3.2 HPTS 结合吐温80 处理芽孢悬浮液 吸取30 mL 芽孢悬浮液至50 mL 无菌聚四氟乙烯离心管(经121 ℃高压灭菌)中,以9 000 r/min 离心15 min,弃上清液,分别加入50 mL 质量分数为0.5%,1%,2%的吐温80 溶液,充分涡旋混匀后,转移至无菌聚乙烯塑封袋(紫外照射杀菌30 min),使用真空包装机热封,放置于HPTS 处理仓内,待处理。设置保压时间为20 min,超高压处理压力为200,600 MPa,处理温度为75 ℃。在HPTS处理前,将样品分别预热到所需的初始温度75℃,由于处理过程中温度下降幅度较小,所示温度(75±2)℃近似为HPTS 处理期间计算出的样品温度的平均值[9]。此外,由于所有样品在处理过程中都浸在水中,水量远远超过吐温80 含量,所以吐温80 对压缩加热的影响可以忽略不计,处理结束后立即放入冰水冷却,进行各项指标测定。
1.3.3 枯草杆菌芽孢悬浮液的HPTS 动力学处理及灭活的动力学模型 取10 mL 芽孢悬浮液于无菌聚乙烯塑料袋中,菌悬液中的吐温80 质量分数调整为0.5%,1%。将菌悬液真空包装,热封口后置于超高压处理釜中,于200,600 MPa 结合75 ℃温度下处理0,5,10,15,20,25 min。处理后立即将一部分样品置于冰水中冷却,测定芽孢存活数。将另一部分样品在37 ℃培养3 h,测定菌落总数。本试验不考虑升压、泄压过程中样品的温度变化[10-12]。
1.3.3.1 一级动力学模型 这个模型假定热压处理下芽孢的存活符合线性关系,可用下式表示[13-14]:
N0——达到目标压力后芽孢的数量,CFU/mL;Nt——在压力处理时间t 后芽孢的存活数量,CFU/mL;D——使90%的芽孢失活所需的时间。
1.3.3.2 Weibull 模型 Weibull 模型是将微生物的杀灭作为Weibull 模型概率事件,这与微生物群体中种群的异质性有关[15]。这个模型假定营养体和芽孢具有不同的耐压性,b 和n 分别为比例因子和形状参数,它们与温度和压力的大小有关[16-17]。当存活曲线向下凹时(n<1),芽孢群体中对适温适压敏感芽孢以较快速度被杀灭,而一些超级深度休眠芽孢仍存活。而向上凸的曲线(n>1),表明深度休眠的芽孢在所处环境下减少[18]。其表达式为:
Nt——时间t 时芽孢菌落数量,CFU/mL;N0——初始芽孢菌落数量,CFU/mL;b——比例因子;n——形状系数;t——时间,min。
1.3.4 流式细胞法测定芽孢的膜通透性 取处理前后的枯草杆菌芽孢悬浮液1 mL,离心后弃去上清液,加入0.75 μL 的20 mmol 碘化吡啶(PI)染色,并在室温下暗处孵育15 min。用流式细胞仪检测前向散射光(FSC)、侧向散射光(SSC)、荧光通道FL2。每个样品检测约30 000 个细胞。采用488 nm 激发光,PI 标记细胞在615 nm 处发红色荧光(FL2通道),采集数据[19]。
1.3.5 枯草杆菌芽孢菌落平板计数 将处理前后的芽孢悬浮液分别进行梯度稀释,用移液枪吸取1 mL 稀释液,用TSA-YE 培养基进行倾注平板计数。每个平板中倒入1 mL 稀释菌液和15~20 mL TSA-YE 培养基,混合均匀后静置,每个样品倾倒两个平板,在37 ℃下培养48 h 后进行计数,结果处理参照GB 4789.2-2016 《食品安全国家标准食品微生物学检验 菌落总数测定》[20]执行。
1.3.6 芽孢悬浮液中DPA 的测定 芽孢在萌发、水解过程中会释放出DPA,试验采用比色法进行DPA 含量检测。测量步骤如下:
DPA 标准曲线制作:配制10,20,40,80,120,160 和200 μg/mL DPA 溶液5 mL,其中含1 mL DPA 色测反应剂。1~2 h 内,于440 nm 下测定吸光度值,绘制出DPA 含量对吸光度的标准曲线。
DPA 色测反应剂:0.5 mol/L 乙酸钠缓冲液100 mL,抗坏血酸、硫酸亚铁铵各1 g。
将处理后的枯草杆菌芽孢悬浮液离心(4 ℃、9 000 r/min、15 min),取4 mL 上清液加1 mL 的DPA 色测反应剂,在1~2 h 内于440 nm 下测定吸光度值。按照标准曲线算出DPA 的含量。
1.3.7 芽孢傅里叶变换红外光谱(FTIR)分析 取处理前后的枯草杆菌芽孢悬浮液5 mL,以9 000 r/min 离心10 min,弃去上清液,用去离子无菌水反复洗去残余的吐温80 溶液后,冷冻干燥,将粉末与样品质量50~100 倍的溴化钾(120 ℃干燥10 h)混合并进行研磨、压片,以空白溴化钾为对照。放置在傅里叶红外光谱仪样品槽中,在4 000~400 cm-1波数范围进行扫描,扫描次数为64 次,分辨率为2 cm-1。
1.3.8 吐温80 结合HPTS 处理后枯草杆菌芽孢ATP 酶活力的测定 取10 mL 处理前后的芽孢悬浮液,于4 ℃以8 000×g 离心10 min,取上清液,按照Na+/K+-ATP、Ca2+/Mg2+-ATP 酶活性测定试剂盒说明依次加入各试剂进行反应,定磷后于室温25℃静置30 min,使用酶标仪在660 nm 处比色测定。
1.3.9 统计分析 所有试验都至少重复3 次,数据通过SPSS 22.0 进行分析,以P<0.05 表示差异性显著。用Origin 2020.0 软件对试验结果进行统计分析和作图。
2 结果与分析
2.1 HPTS 结合不同质量分数的吐温80 处理后对枯草杆菌芽孢灭活效果的影响
如图1 所示,HPTS(处理条件:200,600 MPa结合75 ℃,保压时间:20 min)结合不同质量分数的吐温80(0.5%,1%,2%)处理下枯草杆菌芽孢的存活情况。结果表明200 MPa,75 ℃时结合不同质量分数的吐温80 处理后,芽孢存活量依次为3.2,5.3,4.76,4.77 lg(CFU/mL),与不添加吐温80 相比,0.5%,1%,2%吐温80 均对芽孢产生协同保护作用,其中,200 MPa,75 ℃,0.5%吐温80 处理对芽孢的保护效果最强,芽孢存活量增加了2.1 lg(CFU/mL);而当压力提升至600 MPa 时,HPTS 结合吐温80 处理对芽孢的灭活效果明显增强,说明高压、高温会增加对芽孢的破坏作用。Leonard-Akkari等[21]发现,吐温80 溶液会抑制芽孢的萌发和生长。Krsta等[22]研究发现吐温80 溶液可以降低抗生素对无乳链球菌和金黄色葡萄球菌的影响。Christina等[23]发现表面活性剂吐温80 通常用于食物的分散油中,阻碍异丁香酚的抗菌性能。由此可见,吐温80 溶液能够影响微生物的萌发生长并抑制灭菌效果。为了阐明它的这种保护机理,需要我们进一步研究。
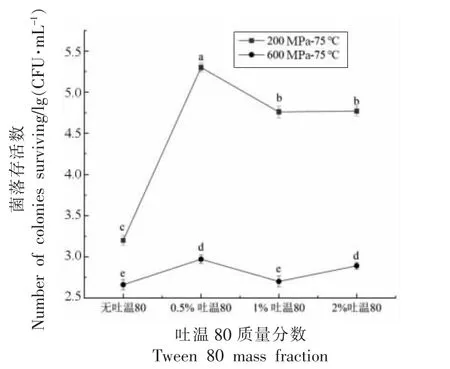
图1 HPTS 结合不同质量分数吐温80 处理对芽孢灭活效果的影响Fig.1 Spore-inactivation effects of different mass fraction of tween 80 combined with HPTS
2.2 HPTS 结合吐温80 处理对枯草杆菌芽孢动力学杀菌效果动力学模型拟合
在600 MPa,75 ℃条件下结合吐温80 质量分数为0.5%,1%,处理时间0,5,10,15,20,25 min,分析处理前后对枯草杆菌芽孢的动力学失活效果的影响情况。如图2 所示。HPTS 结合吐温80 处理后,芽孢存活数明显高于单独HPTS 处理,说明吐温80 溶液对芽孢具有一定的保护效果。而芽孢的灭菌效果与处理时间呈正比例相关,处理时间越长,芽孢的杀灭效果越强。
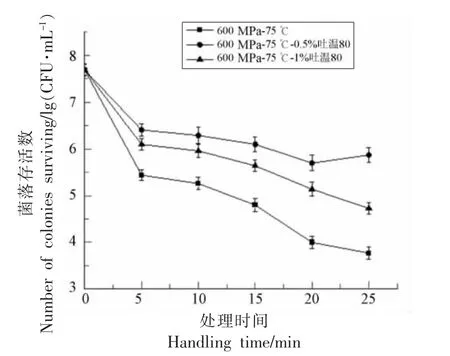
图2 HPTS 结合吐温80 处理对枯草杆菌芽孢动力学杀灭效果的影响Fig.2 Effects of HPTS combined with tween 80 treatment on the kinetic inactivating effect of Bacillus subtilis
为了进一步阐明芽孢的动力学灭菌效果,采用线型、Weibull 模型对芽孢的杀灭效果进行动力学分析,并选择合适的动力学模型,主要从一级动力学角度分析HPTS 结合吐温80 处理对芽孢杀菌效果的影响。如图3 所示:600 MPa,75 ℃结合质量分数0%,0.5%,1%吐温80 处理下枯草杆菌芽孢线性与Weibull 模型拟合图,由表1 可知,Weibull 模型的R2均大于0.92,线性模型的R2为0.738,0.526 和0.616,说明HPTS 结合吐温80 的杀菌过程符合Weibull 模型。与单独HPTS 相比,添加吐温80 后Weibull 模型的参数b 值、n 值均减小(n<1),且随着处理时间的延长,芽孢群体对温度与压力敏感的芽孢很快被杀灭,而一些超级深度休眠芽孢仍存活。
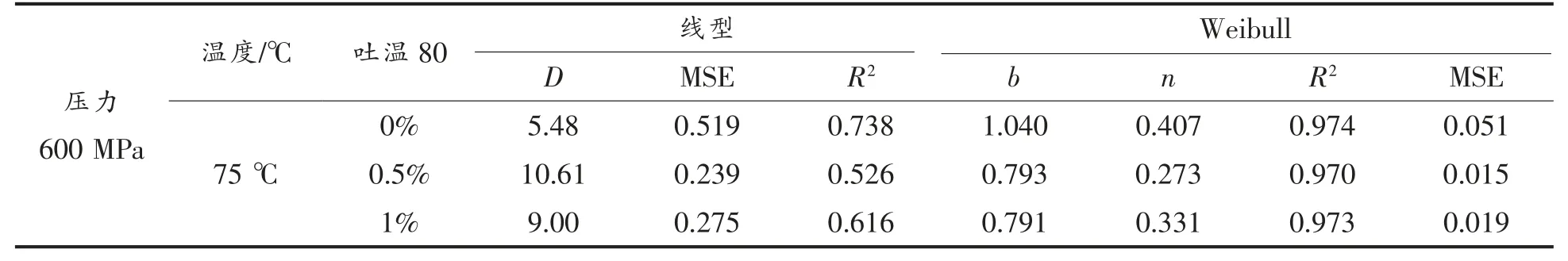
表1 模型参数Table 1 Model parameters of linear,Weibull
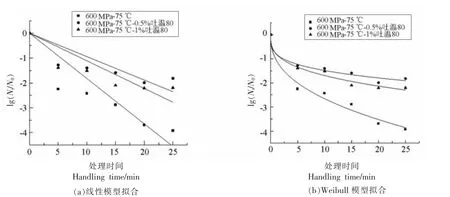
图3 600 MPa,75 ℃结合不同质量分数的吐温80 处理下枯草杆菌芽孢的致死曲线Fig.3 Death curve of Bacillus subtilis under different mass fraction of tween 80 combined with 600 MPa,75 ℃treatment
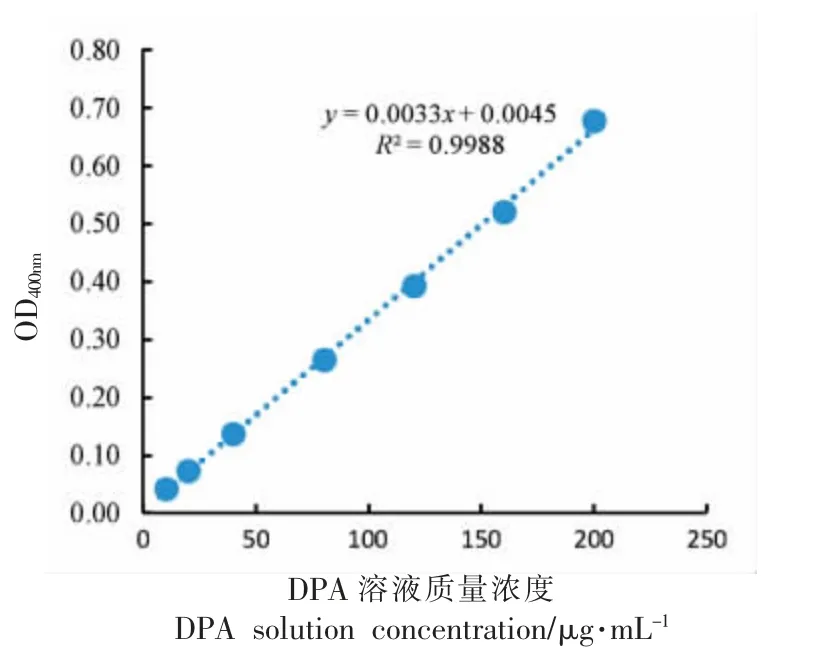
图4 DPA 标准曲线Fig.4 Standard curve of DPA
2.3 HPTS 结合吐温80 处理对芽孢的DPA 泄漏影响
DPA(2,6-吡啶二羧酸)是细菌芽孢的重要物质,在芽孢核内,DPA 与无水二价阳离子(如Ca2+)形成复合物,提升了芽孢的热抗性。当芽孢萌发或结构完整性受到化学物质、热或高压的破坏时,DPA 就会被释放出来[24-26]。DPA 释放是孢子萌发的早期过程,会刺激孢子萌发,成为孢子萌发的重要评价指标。而HPTS 可增加DPA 的释放,刺激芽孢萌发,芽孢萌发后就丧失了对外界胁迫的抵抗力[27],进一步对芽孢内膜造成不可逆的损伤。因此,利用DPA 的释放来评价芽孢内膜的受损情况。
如表2 所示,随着温度压力的增加,DPA 释放显著增加(P<0.5),表明高温、高压会使芽孢DPA迅速释放,促进芽孢萌发,对芽孢内膜具有很强的破坏作用。但加入吐温80 处理后,与单独HPTS处理相比,DPA 释放显著降低(P<0.05),说明吐温80 溶液可降低DPA 的释放。在HPTS 结合吐温80 处理过程中,芽孢的萌发机制不同,压力在200 MPa 时,吐温80 溶液首先抑制营养受体的激活,减少DPA 释放,抑制芽孢萌发,削弱了HPTS 对芽孢的灭活效应。当压力上升到600 MPa 时,高温压力直接导致了DPA 的释放,促进了芽孢的萌发,增加了HPTS 对芽孢的灭活效果,但整体而言,吐温80 溶液降低了DPA 的释放,对芽孢内膜产生保护作用。
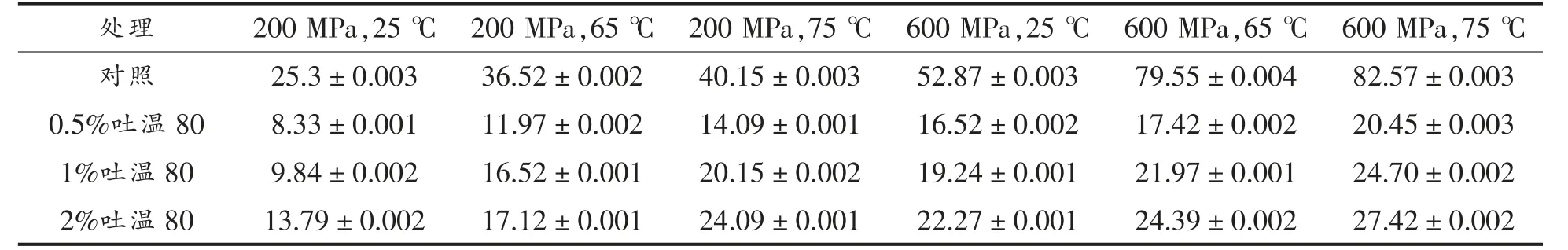
表2 HPTS 结合不同质量分数的吐温80 处理中芽孢DPA 的释放量(μg/mL)Table 2 DPA release of spores treated with different mass fraction of tween 80 and HPTS(μg/mL)
2.4 HPTS 结合吐温80 处理对芽孢内膜通透性的影响
流式细胞技术以激光技术为基础,能够分析光源通过的细胞或颗粒的物理、化学特性。使用荧光染料标记微生物后,根据染料被激光照射后激发的荧光强度可计算特定细胞成分的含量和不同处理的变化,可用于测定芽孢的大小、折光性等形态学指标和膜渗透性、代谢活动等生理指标[28-30]。PI 是一种核酸荧光染色剂,能够渗透失去完整性细胞的膜结构并与DNA 结合[31]。经PI 染料标记,采用流式细胞技术研究微生物内膜通透性的变化已较为成熟[32-33]。HPTS 结合吐温80 处理后的芽孢内膜通透性变化见图5。
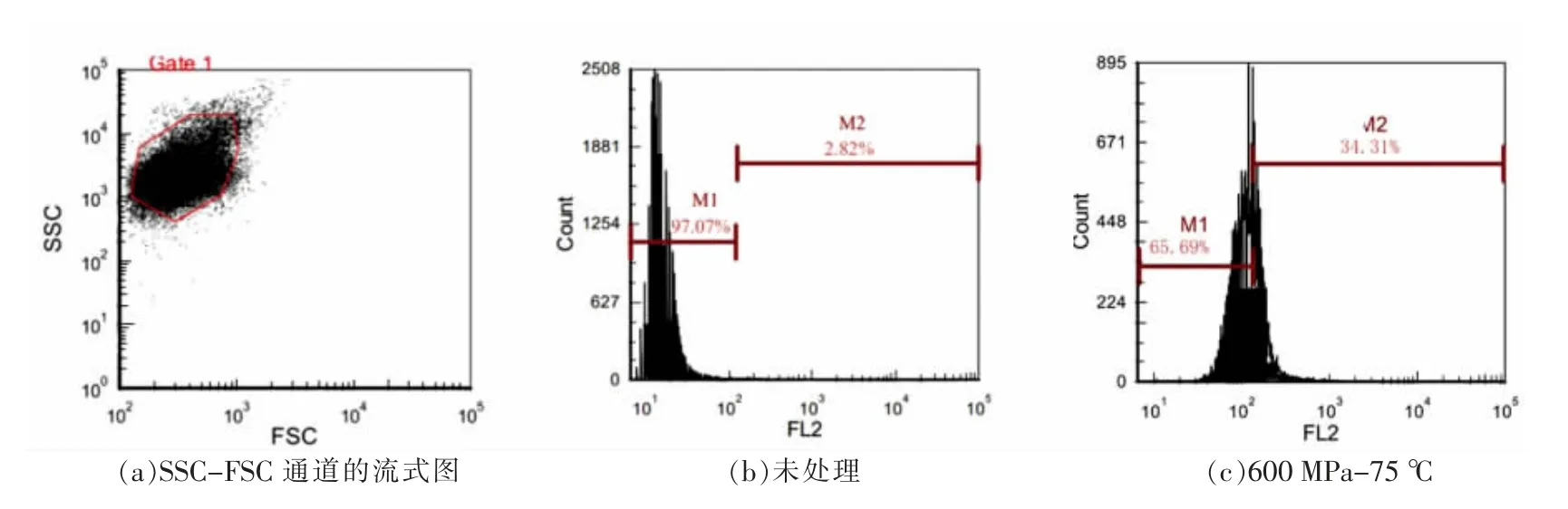
图5 600 MPa-75 ℃时不同质量分数吐温80 处理对枯草杆菌芽孢内膜通透性的影响Fig.5 Effect of different mass fraction tween 80 treatment at 600 MPa-75 ℃on inner membrane permeability of Bacillus subtilis
如图5 所示,在SSC-FSC 通道的流式图中圈选PI 染料的荧光阳性区,并根据门的偏移情况分析处理后芽孢内膜的通透性变化。在600 MPa-75℃时,不添加吐温80 使阳性区域偏移值为34.31%,随着吐温80 质量分数的增加,依次减小至20.08%,28.70%和30.11%,表明本试验中加入吐温80 质量分数后均能降低对芽孢内膜通透性的改变,其中,0.5%吐温80 对芽孢内膜通透性保护效果最好。
2.5 枯草芽孢杆菌细胞膜酶活性的变化
如图6 所示,HPTS 结合不同质量分数的吐温80 处理后,单独HPTS 处理,Na+/K+-ATP、Ca2+/Mg2+-ATP 酶活性呈下降趋势,表明HPTS 处理会使得枯草杆菌芽孢孢内的ATP 酶失活,导致孢内外离子运输及能量供应失衡,进而使得孢内生理代谢紊乱。当加入吐温80 处理后,随着吐温80 质量分数的提升,Na+/K+-ATP、Ca2+/Mg2+-ATP 酶活显著增加(P>0.05),说明吐温80 会在一定程度上保护ATP 酶活,使得部分Na+/K+-ATP、Ca2+/Mg2+-ATP 酶能够正常工作,维持芽孢酶活性的平衡和稳定。
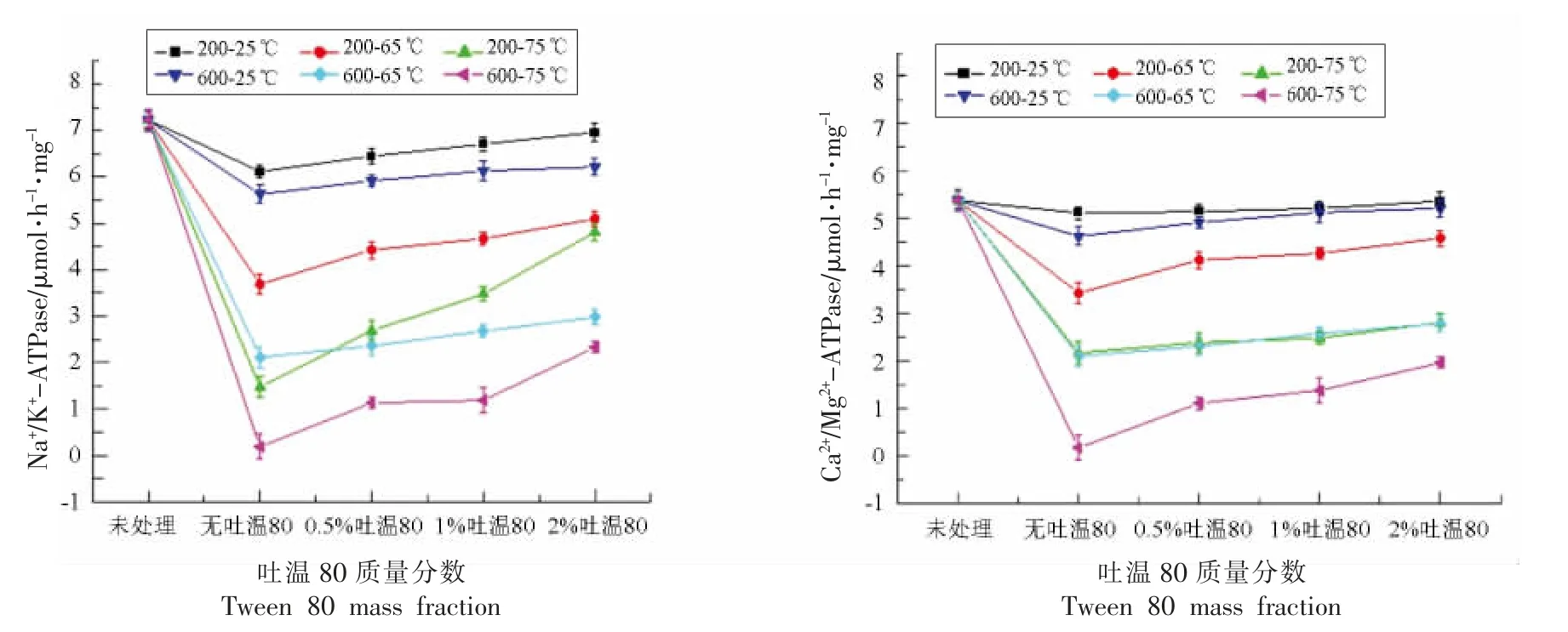
图6 不同质量分数的吐温80 结合HPTS 处理后芽孢内膜Na+/K+-ATP、Ca2+/Mg2+-ATP 酶活的变化Fig.6 Changes in Na+/K+-ATP,Ca2+/Mg2+-ATPase of spore inner membrane treated with different mass fraction of tween 80 combined with HPTS
一般认为,温度和压力的胁迫均能导致ATP酶的活性降低,且温度为主导因素[34]。即使在很高压力下,一些酶仍能具有较高的构象稳定性,并保留固有活性,这与酶对压力的敏感性有关[34-35],孙国龙等[36]研究发现非离子表面活性剂对酶活性影响较小,甚至有激活作用;阴离子表面活性剂对酶活性影响大,主要起抑制作用。而吐温80 是非离子表面活性剂,对酶具有激活效果,与该研究结论相一致[36-37]。
2.6 枯草杆菌芽孢酰胺I 带(1 600~1 700 cm-1)红外光谱拟合蛋白二级结构结果分析
位于1 600~1 700 cm-1范围的酰胺I 带与蛋白质骨架构象类型相关,其主要涉及肽链C=O 伸缩振动和N-H 平面弯曲振动等。α 螺旋集中于1 650~1 660 cm-1,β 折叠集中于1 610~1 640 cm-1,β 转角集中于1 660~1 670 cm-1,无规卷曲集中于1 640~1 650 cm-1[38]。
由图7 可以看出,未处理的枯草杆菌芽孢酰胺Ⅰ带有大量的有序二级结构α-螺旋与β-折叠。相比未处理的枯草杆菌芽孢,单独HPTS 处理后,α-螺旋和β-折叠均减少,β-转角和无规卷曲含量均增加,说明超高压处理后枯草杆菌芽孢从有序状态向无序状态转变。而加入吐温80 处理后,与未处理样品相比,枯草杆菌芽孢α-螺旋结构均增加,β-折叠减少、β-转角增加、无规卷曲含量减少,说明吐温80 对蛋白α-螺旋结构的稳定性具有一定的保护作用;同时,有效地降低了蛋白无规卷曲结构的含量,说明经过吐温80 处理后能有效地维持蛋白二级结构的有序状态,使蛋白质稳定性增加,降低了HPTS 对芽孢蛋白二级结构的影响。
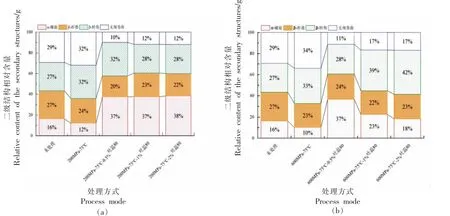
图7 枯草杆菌芽孢蛋白质二级结构含量Fig.7 Protein secondary structure content Bacillus subtilis spores
3 结论
本文研究发现吐温80 能够削弱HPTS 对枯草芽孢杆菌的灭活效果,低压热(200 MPa,75 ℃)结合0.5%吐温80 对芽孢产生很好的保护作用。同时吐温80 溶液能够有效地保护芽孢的内膜通透性,减少芽孢内容物DPA 的释放,有助于激活芽孢ATP 酶的活性,另外吐温80 还可以有效地维持芽孢蛋白质二级结构的稳定性,对芽孢产生保护作用,因此,乳化剂吐温80 不利于高压灭菌技术,说明高压热灭菌技术对乳化食品的灭菌依旧需要进一步探索。

