hsa_circ_0007460通过调节巨噬细胞的自噬和凋亡影响细胞内结核分枝杆菌的存活
章金怡,何禹墨,周晶雨,翁术锋,马慧霞,林太玥,徐颖
研究报告
hsa_circ_0007460通过调节巨噬细胞的自噬和凋亡影响细胞内结核分枝杆菌的存活
章金怡1,何禹墨1,周晶雨2,翁术锋1,马慧霞1,林太玥1,徐颖1
1. 复旦大学生命科学学院,上海 200433 2. 复旦大学附属华山医院感染科,上海 200040
环状RNA (circular RNA, circRNA)是一类缺乏5′-帽子和3′-poly(A)尾巴的非编码RNA,可以参与多种人类疾病的生物学过程。然而,对其在活动性肺结核(active pulmonary tuberculosis,ATB)中的诊断和功能价值却知之甚少。本研究旨在研究hsa_circ_0007460是否能作为ATB患者的潜在诊断生物标志物,并对其功能进行初探。通过实时荧光定量PCR (real-time quantitative fluorescent PCR,RT-qPCR)发现hsa_circ_0007460在32例ATB患者的外周血以及牛结核分枝杆菌的减毒株——BCG (bacillus Calmette-Guerin)感染的THP-1人源巨噬细胞中显著上调。受试者工作特征曲线(receiver operating curve, ROC)显示曲线下面积(the area under ROC curve, AUC)为0.7474,灵敏度76.67%,特异度78.13%。通过RNase R消化和放线菌素D抑制实验证实hsa_circ_0007460相较于其线性mRNA更加稳定,提示其有作为ATB的诊断生物标志物的潜力。通过蛋白质印迹(Western blot)、CCK-8 (cell counting kit-8)、平板计数、免疫荧光等实验表明hsa_circ_0007460能调控巨噬细胞凋亡和自噬。最后,通过生物信息学分析预测下游的miRNA和mRNA,构建了hsa_circ_0007460/hsa-miR-3127-5p/PATZ1轴。上述研究结果表明,hsa_circ_0007460在ATB患者外周血中显著上调,可以作为潜在的诊断生物标志物,且hsa_circ_0007460能促进巨噬细胞凋亡、抑制巨噬细胞自噬从而促进胞内BCG的存活。
hsa_circ_0007460;自噬;凋亡;TB;巨噬细胞
结核病(tuberculosis,TB)是由结核分枝杆菌(,)引起的严重呼吸道传染病。据世界卫生组织《2022年全球结核病报告》统计,2021年全球新发结核病患者1060万例,死亡数160万[1]。结核感染的早期诊断对于控制该疾病的传播至关重要。目前,细菌培养和涂片镜检仍是结核病临床诊断中最广泛使用的工具,但过程耗时、灵敏度差[2]。因此,迫切需要寻找结核病特异性的生物标志物,建立一种快速、灵敏、高效的肺结核诊断方法,以防止结核病的广泛传播。
环状RNA(circular RNA,circRNA)是真核生物中共价闭合的内源性分子,缺乏5′-帽子和3′-poly(A)尾巴,大多数由已知的蛋白质编码基因表达,具有组织特异性和细胞特异性[3]。由于具有共价闭合环状的特性,且能耐受RNase R的降解,circRNA可以作为肿瘤、心血管疾病和其他疾病的潜在生物标志物,并且参与许多疾病的发生和发展[4]。
很多研究发现circRNA的失调和感染有关,也可以作为TB诊断的新型生物标志物。Zhuang等[5]研究表明,hsa_circ_0005836可作为结核病诊断新的潜在生物标志物。Huang等[6]发现hsa_circ_ 0043497和hsa_circ_0001204在TB患者的单核细胞衍生巨噬细胞中的表达显着增加,其潜在的靶miRNA可能是miR-377-3p和miR-186-5p。Zhang等[7]研究表明hsa_circ_0028883对结核病诊断具有潜在价值,是一种潜在可靠的生物标志物,并且通过生物信息学析,预测了其下游miRNA为hsa-miR-409-5p,但仍需要进行进一步实验验证。上述研究表明,circRNA可能在TB中发挥重要作用,并具有作为结核病诊断新型生物标志物的巨大潜力。
在本课题组前期研究中,通过测序发现hsa_circ_ 0007460在活动性肺结核(active pulmonary tuberculosis,ATB)患者的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中表达显著上调(上调36倍) (数据尚未发表)。故本研究进一步在病人和细胞层面验证了hsa_circ_0007460的差异表达,并构建受试者工作特征曲线(receiver operating curve,ROC),评价hsa_circ_0007460对ATB的诊断价值。此外,本文还探究了hsa_circ_0007460在结核分枝杆菌的减毒株(bacillus Calmette-Guerin,BCG)感染的THP-1人源巨噬细胞中的功能,并评估了hsa_circ_0007460、miRNA和mRNA之间可能的相互作用,以确定circRNA-miRNA-mRNA网络。本研究表明,hsa_ circ_0007460可能是结核病的有效诊断生物标志物,其可能通过和PATZ1竞争性结合hsa-miR-3127-5p来影响巨噬细胞凋亡和自噬,促进BCG的胞内存活。本研究为ATB的临床诊断和治疗提供了新的分子靶点,并为结核病的发病机制提供了新的认识。
1 材料与方法
1.1 临床样本中PBMC的提取
本研究共有30例ATB患者(16男,16女),年龄16~70岁,于2021年2月~8月从复旦大学附属华山医院招募。ATB诊断依据《中华人民共和国卫生标准—结核病诊断》(WS 288-2017)。2021年2月~8月,共招募32名年龄在20~65岁之间、无ATB细菌学以及ELISPOT诊断为阴性的HC志愿者(16名男性,14名女性)作为对照组。采集每位受试者外周血约5 mL。本研究经复旦大学附属华山医院伦理委员会批准。所有受试者均签署了知情同意书。
将人淋巴细胞分离液(深圳市达科为生物技术股份有限公司)加入到全外周血中,进行密度梯度离心,800×室温离心20 min。在分离得到的PBMC中加TRIzol(美国Invitrogen公司)进行裂解,–80℃储存用于后续的实验。研究对象的特征显示在表1中。
1.2 RNase R消化
使用核酸外切酶RNase R (美国Epicenter Biotechnologies公司)来评估circRNA的稳定性。将2 μg的总RNA用含或者不含2 U的RNase R在37℃下消化10 min,然后进行反转录和RT-qPCR。
1.3 放线菌素D实验
使用放线菌素D (美国MedChemExpress公司)来评估circRNA的稳定性。用3 μg/mL的放线菌素D处理THP-1人源巨噬细胞不同时间后,用TRIzol裂解,通过RT-qPCR分析hsa_circ_0007460和GOSR1 mRNA相较于处理前(0 h)的稳定性。

表1 研究对象的特征
ATB:活动性肺结核患者;HC:健康人对照;ELISPOT:酶联免疫斑点法。
1.4 实时荧光定量PCR (real-time quantitative fluorescent PCR,RT-qPCR)实验
按照HiScript III All-in-one RT SuperMix Perfect for qPCR (南京诺唯赞生物科技股份有限公司)说明书逆转录合成cDNA。反转录程序:50℃反转录15 min,然后85℃灭活5 s。得到cDNA后,使用ChamQ Universal SYBR qPCR Master Mix (南京诺唯赞生物科技股份有限公司)进行RT-qPCR,RT-qPCR程序:95℃ 30 s;95℃ 10 s,60℃ 30 s,40个循环;95℃ 15 s,60℃ 60 s,95℃ 15 s。通过RT-qPCR的溶解曲线来评估扩增的特异性。circRNA表达量以GAPDH为基准。数据处理采用2–ΔΔCt方法,引物序列见表2。
1.5 细胞感染
将BCG的保种液按1%接种于10 mL的7H9+ OADC培养液中,37℃培养箱静置培养至OD600=0.6~0.8,1000×室温离心5 min收菌。用无菌PBS将菌液调至OD600=0.6 (~2.5×107CFU/mL),稀释到感染所需浓度用于后续细胞感染。确定感染复数MOI (MOI=10∶1)。按计算加入上述相应已调好OD的菌悬液,置于37℃ CO2细胞培养箱中感染4 h。吸去菌悬液,加入已平衡至室温的PBS洗3次。
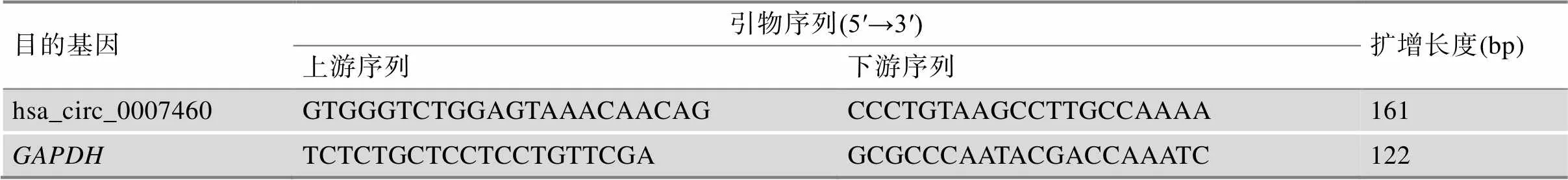
表2 RT-qPCR中使用的引物
1.6 抑制circRNA
采用siRNA抑制hsa_circ_0007460,siRNA针对hsa_circ_0007460序列的反向剪接位点设计,由上海生工生物工程有限公司合成。用siRNA转染THP-1人源巨噬细胞48 h后,用RT-qPCR方法检测抑制效率,siRNA序列见表3。
1.7 Western blot免疫印迹法检测蛋白的表达
使用全细胞裂解液(上海碧云天生物技术有限公司)制备蛋白样品。用双硫键还原检测法(Bicinchoninic Acid Assay,BCA)(北京艾德莱生物科技有限公司)测定蛋白浓度。根据蛋白分子量配制相应浓度的SDS-PAGE胶(上海雅酶生物医药科技有限公司),取相同量总蛋白进行电泳。电泳完成后将蛋白转移到0.22 μm PVDF膜(美国密理博公司)上。用含5%脱脂奶粉的1×TBST室温封闭1 h。加入目的蛋白抗体4℃孵育过夜。目的蛋白抗体包括抗-LC3 (美国Cell Signaling Technology公司,1∶500稀释),抗-GAPDH (美国Proteintech公司,1∶20000稀释)、抗-Bcl-2 (上海碧云天生物技术有限公司,1∶5000稀释)。加入HRP标记的二抗室温孵育1 h。采用增强型化学发光试剂(enhanced chemiluminescence,ECL) (上海碧云天生物技术有限公司)显影。蛋白条带深浅采用Image J (美国National Institutes of Health公司)分析。

表3 hsa_circ_0007460-siRNA序列
1.8 免疫荧光细胞化学染色检测LC3的表达
将THP-1培养于共聚焦小皿中,用PBS清洗3次后加4%多聚甲醛固定10 min,然后加0.25% TritonX-100通透10 min。通透结束后加入抗-LC3抗体(美国Cell Signaling Technology公司,1∶500稀释),4℃过夜孵育。之后加荧光二抗(上海碧云天生物技术有限公司,1∶500稀释),室温避光孵育1 h。加0.1%的4′,6-二脒基-2-苯基吲哚(4′,6-diamidino- 2-phenylindole,DAPI)进行复染,复染5 min。复染结束后加防荧光淬灭剂。最后在共聚焦显微镜下观察,记录细胞中LC3 puncta数目,共计数100个细胞。
1.9 流式检测细胞凋亡
可以通过异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-碘化丙啶(propidium iodide,PI)染色(日本同仁化学研究所)区分凋亡细胞和活细胞。将THP-1人源巨噬细胞用不含EDTA的胰蛋白酶进行消化,用枪头将贴壁细胞吹下,转移到离心管中,用1×Annexin V Binding Buffer洗涤细胞。向洗涤过的细胞悬液中加入5 μL Annexin V-FITC结合物,再加入5 μL PI Solution,室温下避光培养15 min,加样到流式细胞仪(美国BD公司)检测,激发波长Ex=488 nm,发射波长Em=530 nm。凋亡率使用FlowJo软件(美国BD公司)进行分析。
1.10 CCK-8检测细胞存活率
吸去接种于96孔板中的THP-1人源巨噬细胞培养上清,每孔加入含有10 μL的CCK-8 (翌圣生物科技股份有限公司)试剂的培养液,37℃孵育4 h,用多功能酶标仪(美国伯腾仪器有限公司)测定在450 nm及650 nm参比波长处的吸光度。
1.11 Hsa_circ_0007460对BCG感染的THP-1人源巨噬细胞的杀菌活性影响
用上述1.6方法过表达或抑制hsa_circ_0007460 24 h后,用BCG (MOI = 10)感染,感染4 h后,吸去培养液,用1×PBS清洗3次,洗去胞外BCG。每孔加入100 μL 0.025%的SDS裂解细胞,按照合适的比例稀释后,取50 μL稀释液涂布于7H10平板,去除胞外菌的时刻记为0 h。继续培养24 h和48 h后,按照上述同样的操作进行稀释涂板。37℃培养3周后计数CFU。
1.12 生物信息学预测
利用circMine (http://hpcc.siat.ac.cn/circmine/)、TargetScan (http://www.targetscan.org)、miRanda (http:// www.microrna.org/microrna/home.do)和Lianchuan生物学数据库预测hsa_circ_0007460的潜在miRNA靶点。使用TargetScan、Tarbase (http://www.microrna. gr/tarbase)和miRDB (https://mirdb.org)数据库预测hsa-miR-3127-5p的潜在靶点。
1.13 统计分析
两组间比较采用Welch’s检验。多组之间表达比较采用One-way ANOVA检验,数据处理采用Excle,作图采用GraphPad Prism 9软件。数据均以平均值±标准差(SD)展示。Western blot结果采用Image J软件分析。流式分析采用FlowJo软件。<0.05被认为具有统计学差异。
2 结果与分析
2.1 hsa-circ-0007460在TB病人及BCG感染的THP-1人源巨噬细胞中显著上调
在课题组前期研究发现hsa_circ_0007460在ATB患者的PBMC中表达显著上调36倍(数据尚未发表)的基础上,本研究进一步在病人和细胞层面验证hsa_circ_0007460的差异表达。结果表明hsa_circ_0007460在30名ATB患者中的表达显著高于健康人志愿者(图1A)。此外,通过构建受试者工作特征曲线(ROC),对hsa_circ_0007460对ATB的诊断价值进行了评估,结果发现曲线下面积(AUC)为0.7474 (95%置信区间:0.6157~0.8790,<0.001),灵敏度76.67%,特异度78.13% (图1B)。
由于巨噬细胞是对抗感染的第一道防线,通过BCG感染THP-1人源巨噬细胞,建立感染巨噬细胞的模型,并检测hsa_circ_0007460的表达情况[8]。结果显示hsa_circ_0007460在BCG感染THP-1人源巨噬细胞中均显著上调,且随着感染时间的延长,hsa_circ_0007460上调显著增加,这些变化和组学结果相一致(图1C)。
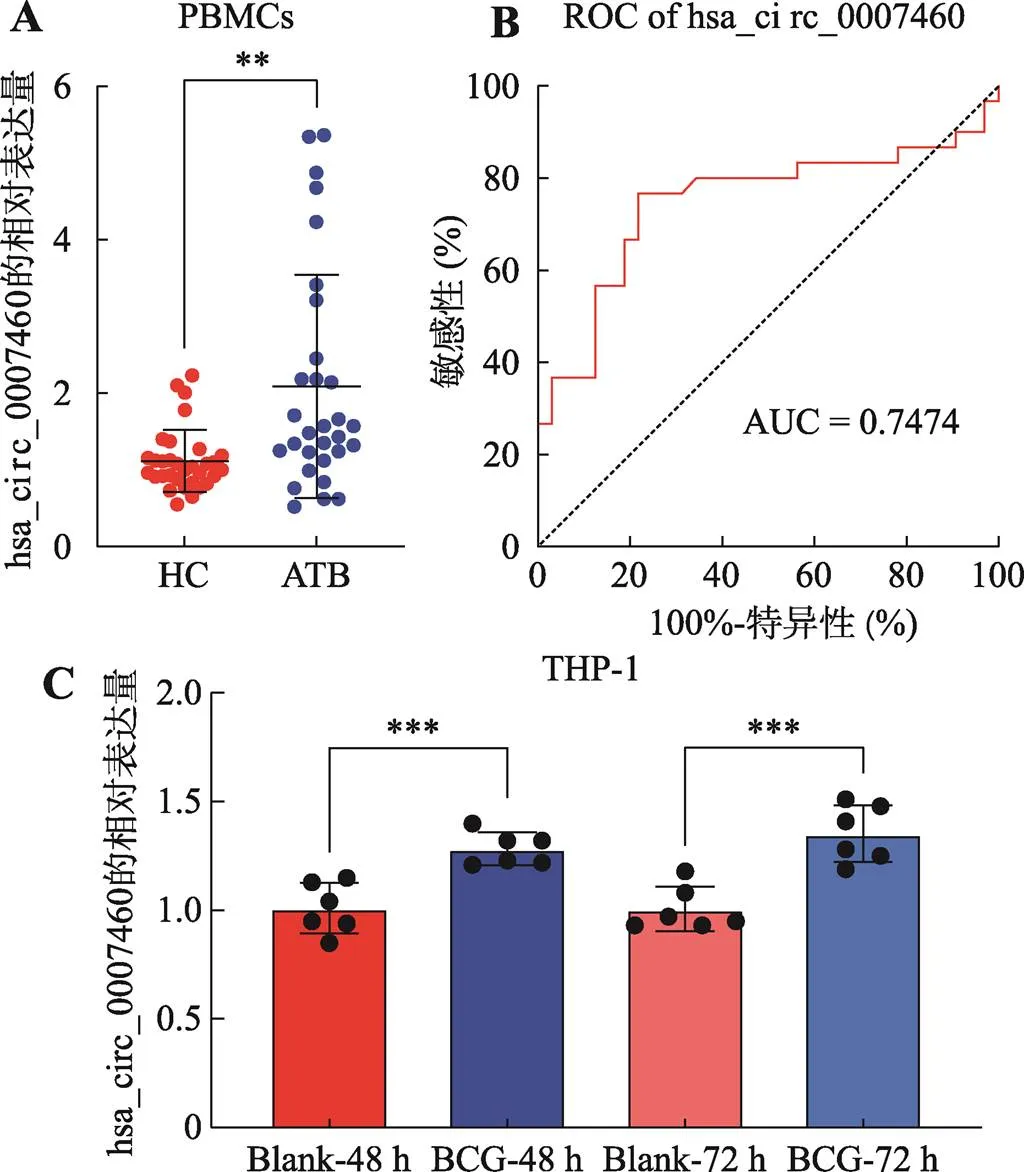
图1 Hsa_circ_0007460在结核患者中和结核感染模型中显著上调
A:在健康人(=32)和活动性肺结核患者(=30)的PBMC中hsa_circ_0007460的相对含量。B:hsa_circ_0007460在活动性肺结核诊断中的受试者工作特征曲线。AUC:曲线下面积。C:BCG感染THP-1人源巨噬细胞(MOI=10)48 h和72 h时,hsa_circ_ 0007460的相对含量。**<0.01, ***<0.001,****<0.0001。
circRNA不同于线性RNA,它是由反向剪接而成的环状RNA,缺乏5′-帽子和3′-poly(A)尾巴。本研究的hsa_circ_0007460来自基因的外显子3~6的反向剪接(图2A)。测序结果表明,RT-qPCR扩增序列和目的序列完全匹配(图2B)。为了排除RT-qPCR引物扩增出线性产物的可能,用RNase R(Ribonuclease R)处理RNA。RNase R是核糖核酸外切酶,几乎可消化所有线性RNA,但不能消化环状RNA[9]。经过处理后,可以观察到线性的GAPDH的含量显著下降,hsa_circ_0007460的含量上升,这表明在一定程度上hsa_circ_0007460能耐受RNase R的消化(图2C)。hsa_circ_0007460在经过RNase R消化之后升高,由此猜测可能是由于其中的线性RNA被降解后,转录竞争者降低使得环状RNA得到了富集。转录抑制剂放线菌素D能抑制RNA的合成,THP-1人源巨噬细胞经放线菌素D处理不同时间后,对hsa_circ_0007460及其线性转录本mRNA的分析表明,hsa_circ_0007460亚型非常稳定,相对于它的线性转录本,有更长的半衰期(图2D)。

图2 Hsa-circ-0007460的基本性质验证
A:hsa_circ_0007460的示意图。B:上半部分是hsa_circ_0007460剪接位点处的基本序列,下半部分是使用反向引物扩增的剪接位点处Sanger测序的结果,黑色的虚线代表剪接位点。C:THP-1人源巨噬细胞用或者不用RNase R消化之后,hsa_circ_0007460和线性的GAPDH的相对含量。D:THP-1人源巨噬细胞用放线菌素D处理不同时间后,hsa_circ_0007460和其对应的线性转录本GOSR1的含量。**<0.01,****<0.0001,ns代表无统计学差异。
综上所述,hsa_circ_0007460是由于感染而上调,能耐受RNase R的消化和放线菌素D的处理,具有较好的稳定性,可以作为ATB的潜在诊断生物标志物。
2.2 hsa_circ_0007460的抑制
为了探索hsa_circ_0007460在TB感染中的作用,本研究针对hsa_circ_0007460的反向剪接位点设计了3条小干扰RNA (small interfering RNA,siRNA)用于抑制hsa_circ_0007460 (图3A)。RT-qPCR结果显示,hsa_circ_0007460-siRNA-1和siRNA-2和对照相比,均有抑制效率,因为siRNA-1的抑制效率更高,故选择siRNA-1进行后续实验(图3B)。实验发现,hsa_circ_0007460-siRNA-1能成功抑制hsa_circ_0007460 (图3C),且对其线性转录本GOSR1的含量没有影响(图3D)。
2.3 hsa_circ_0007460促进凋亡
前期结果显示,hsa_circ_0007460在TB和BCG感染的巨噬细胞中上升趋势一致,故使用BCG为模式菌进一步研究hsa_circ_0007460的功能。考虑到凋亡和自噬在清除胞内中的关键作用[10,11],对hsa_circ_0007460是否影响BCG感染的THP-1人源巨噬细胞的凋亡和自噬进行了探究。通过RT-qPCR发现,将hsa_circ_0007460抑制后,凋亡相关基因Bcl-2和BAX含量显著上调(图4A)。进一步通过Western blot,检测凋亡相关蛋白的表达量。结果显示,hsa_circ_0007460的抑制会导致抗凋亡蛋白Bcl-2表达量显著上升,且能显著逆转BCG感染导致的Bcl-2下降(图4B)。由此推测,hsa_circ_0007460可能会影响BCG感染的THP-1人源巨噬细胞凋亡。
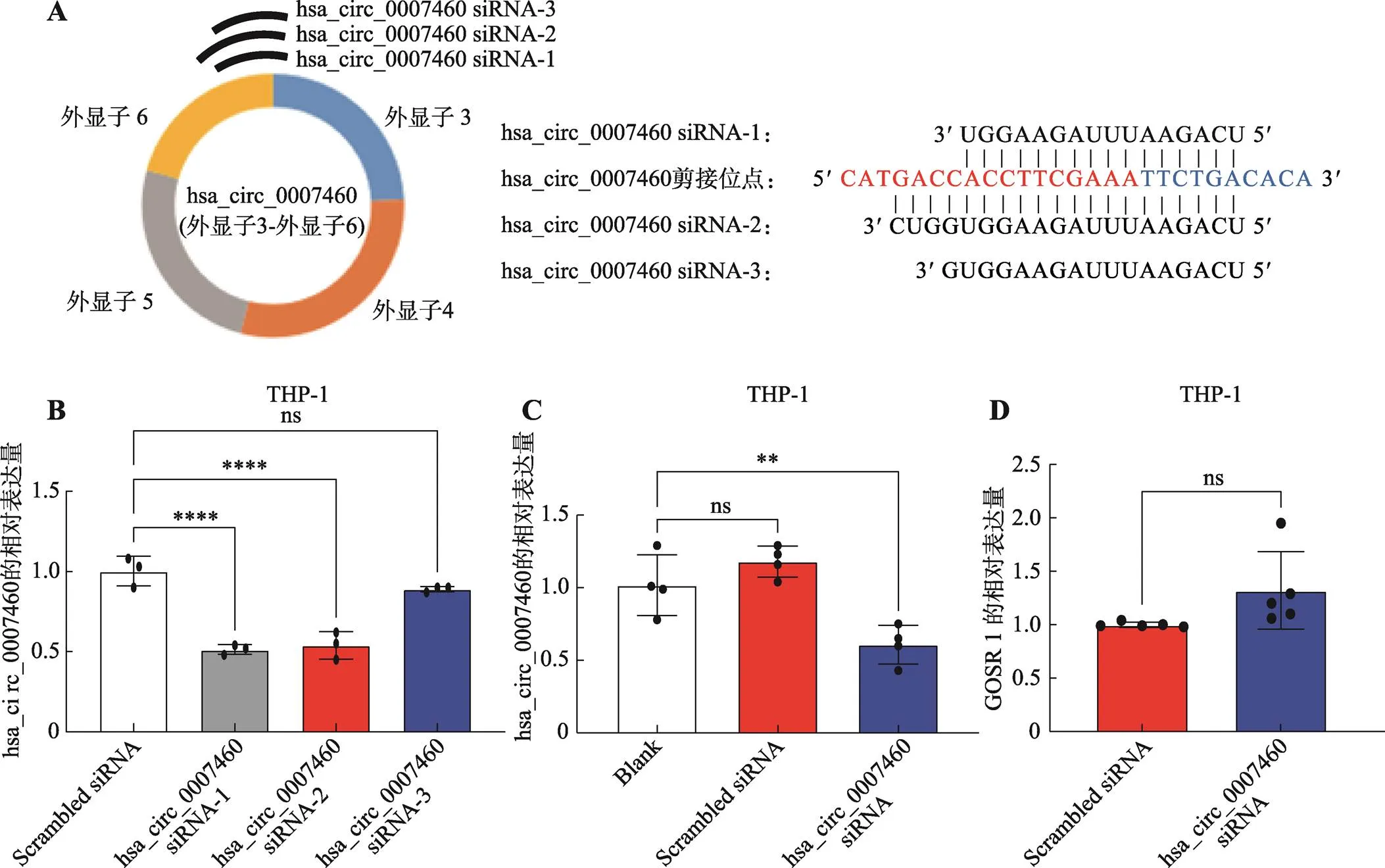
图3 hsa_circ_0007460的抑制
A:hsa_circ_0007460的siRNA抑制示意图。B:不同siRNA抑制效率的比较。C~D:用hsa_circ_0007460-siRNA转染THP-1人源巨噬细胞48 h后,通过RT-qPCR检测hsa_circ_0002371(C)及其线性转录本GOSR1(D)的含量。**<0.01,****<0.0001,ns代表无统计学差异。
后续通过流式检测了THP-1人源巨噬细胞的凋亡,结果显示,hsa_circ_0007460的抑制能显著逆转BCG感染导致的THP-1人源巨噬细胞晚期凋亡和总凋亡的上升(图4C)。CCK-8也表明,hsa_circ_ 0007460的抑制有导致BCG感染的THP-1人源巨噬细胞活力增加的趋势,即细胞死亡减少,且作用效果随着时间的增加而增加(图4D)。以上结果表明,hsa_circ_0007460促进了BCG感染的THP-1人源巨噬细胞的凋亡。
上述结果表明,BCG感染THP-1人源巨噬细胞后,上调的hsa_circ_0007460能降低细胞活力,促进细胞凋亡。
2.4 hsa_circ_0007460通过抑制自噬,来提高BCG的胞内存活率
本研究又进一步探究了hsa_circ_0007460对BCG感染的THP-1人源巨噬细胞的自噬的影响。首先通过RT-qPCR检测自噬相关基因的mRNA水平,结果显示将hsa_circ_0007460抑制后,自噬相关基因p62含量显著下调(图5A)。后续通过Western blot,检测自噬相关蛋白的表达量,结果显示hsa_circ_0007460的抑制会导致BCG感染的THP-1人源巨噬细胞LC3-Ⅱ蛋白表达量显著上升,且能进一步促进BCG感染导致的LC3-Ⅱ上升(图5B)。这表明,hsa_circ_0007460在调节BCG感染的THP-1人源巨噬细胞的自噬中具有潜在作用。为了进一步确定hsa_circ_0007460和自噬的关系,用免疫荧光检测自噬体形成情况。结果发现,抑制hsa_circ_ 0007460后,BCG感染的THP-1人源巨噬细胞细胞中的LC3 puncta (绿色)显著增多(图5C)。以上结果表明,hsa_circ_0007460抑制了BCG感染的THP-1人源巨噬细胞的自噬。
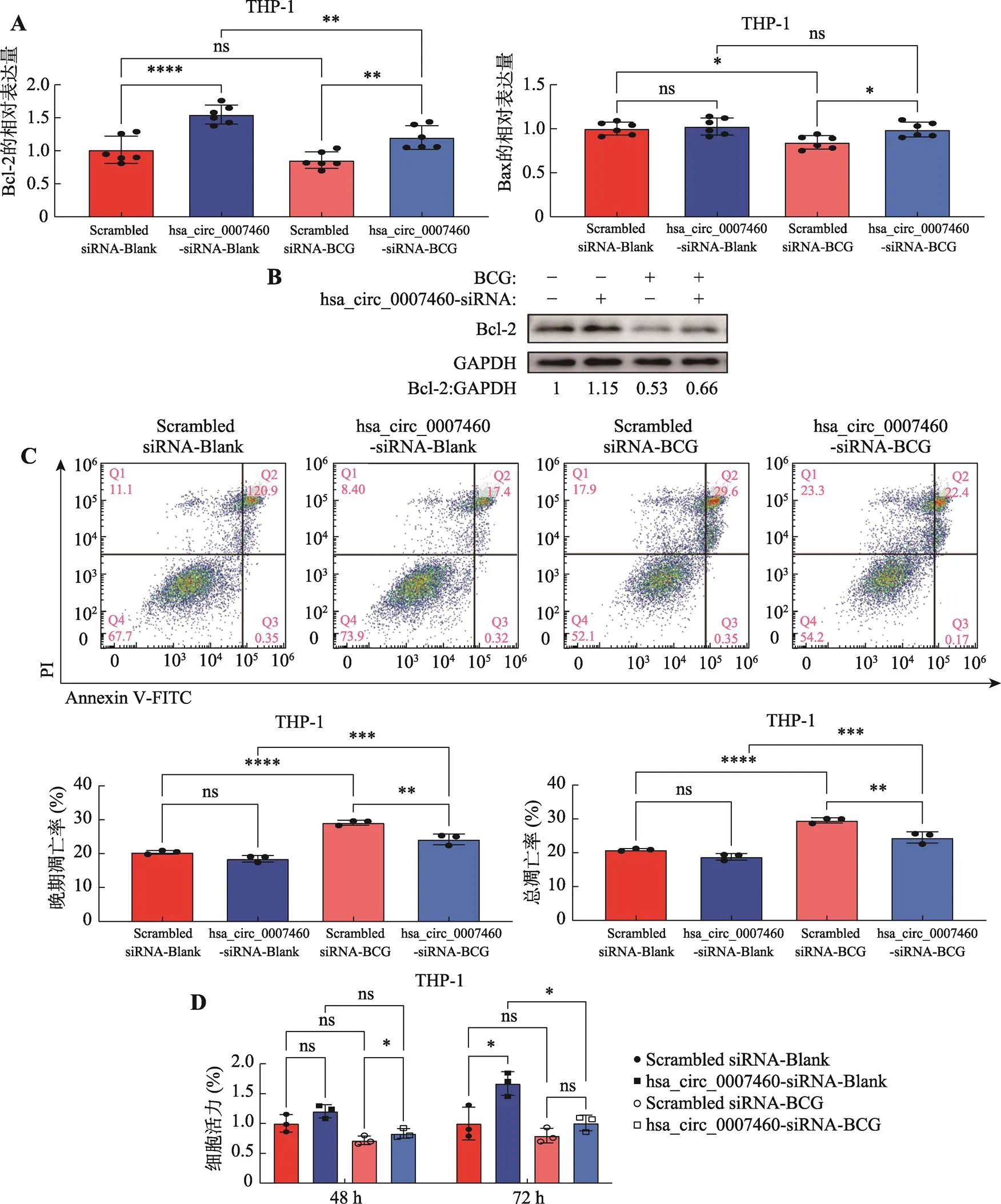
图4 hsa_circ_0007460影响巨噬细胞凋亡
A:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG(MOI=10)感染48 h,通过qPCR检测凋亡相关基因的表达。B:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG(MOI=10)感染48 h,通过WB检测Bcl-2的表达。C:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG(MOI=10)感染48 h,通过流式细胞术检测细胞凋亡。D:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG(MOI=10)感染48 h和72 h,通过CCK-8检测细胞活力。*<0.05,**<0.01, ***<0.001,****<0.0001,ns代表无统计学差异。

图5 hsa_circ_0007460影响巨噬细胞自噬
A:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG (MOI=10)感染48 h,通过qPCR检测自噬相关基因的表达。B:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG (MOI=10)感染48 h,通过WB检测LC3-II的表达。C:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG (MOI=10)感染48 h,通过共聚焦检测LC3 puncta数量。D:用hsa_circ_0007460-siRNA或者Scrambled siRNA转染THP-1人源巨噬细胞24 h后,用BCG (MOI=10)感染,在0 h、24 h、48 h进行CFU涂板计数。*<0.05,**<0.01,***<0.001,****<0.0001,ns代表无统计学差异。
大量研究表明巨噬细胞自噬对胞内具有杀伤作用[12]。前期发现hsa_circ_0007460可以影响BCG感染的巨噬细胞自噬,因此进一步探究了hsa_circ_0007460对BCG胞内存活的影响。CFU结果表明,转染hsa_circ_0007460-siRNA能显著抑制胞内BCG的生长(图5D)。
综上所述,BCG感染THP-1人源巨噬细胞后,上调的hsa_circ_0007460能抑制细胞自噬,有利于BCG的胞内存活。
2.5 hsa_circ_0007460靶miRNA分析
研究表明,细胞质中的circRNA主要通过作为miRNA的“海绵”来发挥其生物学功能[13]。本研究用核质RNA分离试剂盒,探究hsa_circ_0007460在细胞质和细胞核中的比例,结果表明hsa_circ_ 0007460大部分分布于细胞质(图6A)。于是通过circMine、TargetScan、miRanda和联川生物的数据库,对下游的miRNA进行预测。预测结果表明,共有19个miRNA是三个数据库都预测到的(图6B)。图6C构建了这19个miRNA和hsa_circ_0007460的网络图。进一步,通过RNA Hybrid预测了这19个miRNA和hsa_circ_0007460的结合位点,因为miRNA的种子序列(miRNA 5′端的第2~8个核苷酸)是进化上最为保守的片段,发现其中有12个miRNA的种子序列和hsa_circ_0007460能成功配对。后续通过文献查找,探究这12个miRNA是否有和凋亡、自噬相关的文献报道。经过文献调研后,发现只有hsa-miR-3127-5p符合要求,图6D显示了预测得到的两者结合位点。研究表明,长非编码RNA LINC00689可以通过miR-3127-5p/ATG7轴介导自噬抑制人核髓细胞的凋亡[14];CircPAPPA可以通过 miR-3127-5p/HOXA7轴调控滋养层细胞的增殖、迁移、侵袭、凋亡以及细胞周期[15]。PVT1作为miR-3127-5p的海绵可以调节NCCAP1L的表达,导致抑制血管平滑肌细胞增殖,诱导凋亡和激活炎症[16]。二甲双胍可以通过长链非编码RNASNHG7/ miR-3127-5p轴介导自噬从而影响卵巢癌细胞对紫杉醇敏感性[17]。因此推测,hsa-miR-3127-5p可能也影响BCG感染的THP-1人源巨噬细胞的凋亡和自噬。
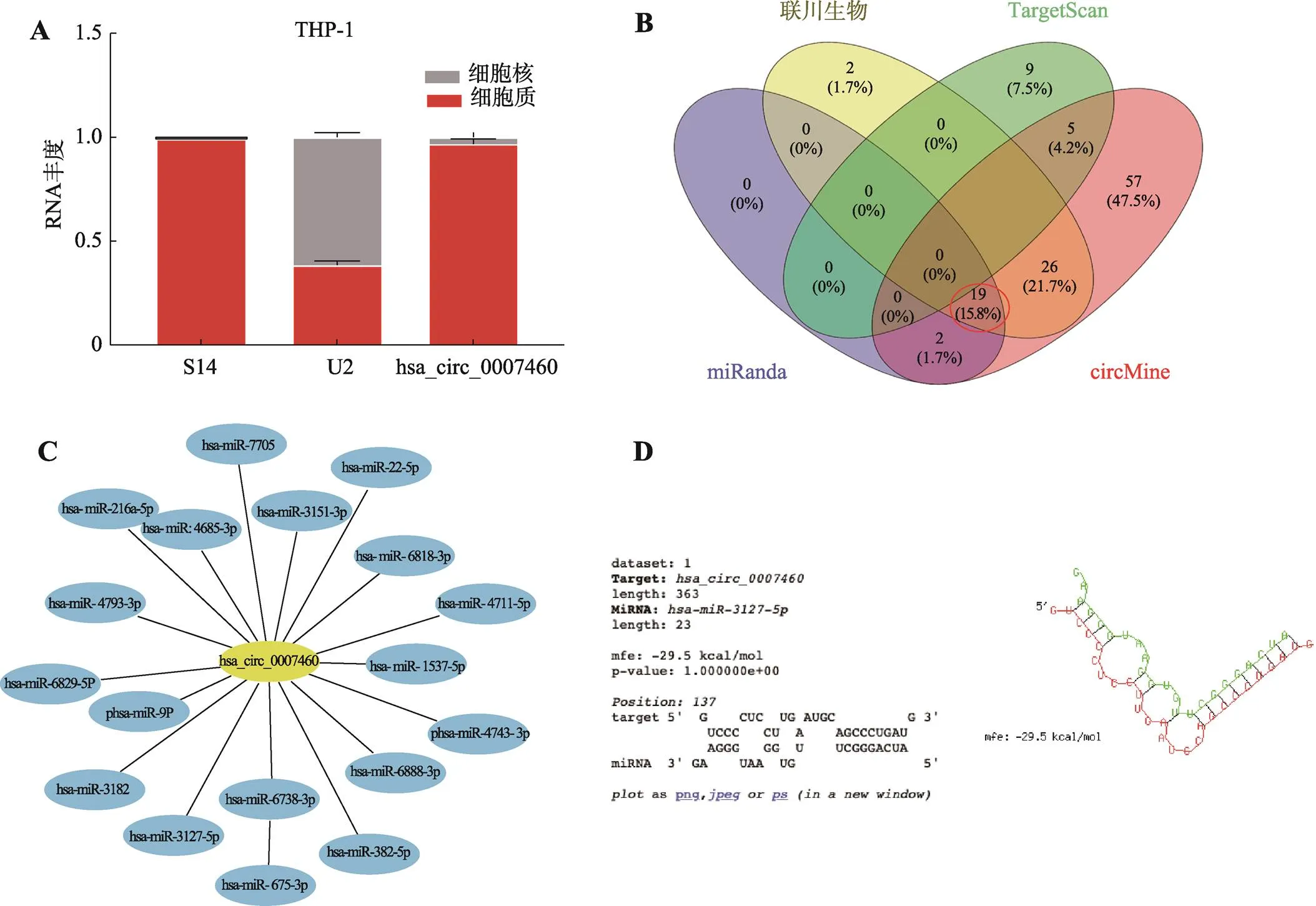
图6 hsa_circ_0007460靶miRNA分析
A:用核质RNA分离试剂盒分离RNA后用qPCR检测hsa_circ_0007460在核和质里面的丰度。B:使用不同的算法预测hsa_circ_0007460的下游miRNA。C:hsa_circ_0007460和下游miRNA网络图。D:使用RNAhybrid预测hsa_circ_0007460和hsa-miR-502-5p的结合位点。
2.6 hsa-miR-3127-5p靶mRNA分析
miRNA是一类非编码的小RNA,一般通过调控下游靶mRNA或蛋白从而发挥生物学作用[18]。于是通过不同的数据库,包括miRDB、TargetScan和TarBase,对下游的mRNA进行预测(图7A)。三个数据库预测出来的公共mRNA有两个,即PATZ1和SH3PXD2A。hsa-miR-3127-5p和PATZ1结合的二级结构图如图7B所示,根据TargetScan的预测,PATZ1的3′端非编码区(3′-untranslated region, 3′-UTR)会和hsa-miR-3127-5p的种子序列结合(图7B)。PATZ1基因编码一种转录因子,是一种转录抑制剂,能起到抗凋亡的作用[19~22]。然而,也有文章提出了相反的结论,发现PATZ1能与p53相互作用,根据细胞环境调节p53靶基因的表达,增强细胞凋亡或存活,这表明PATZ1似乎具有双致癌/抗致癌活性[23]。hsa-miR-3127-5p和SH3PXD2A结合的二级结构图如图 7C所示。关于SH3PXD2A基因的研究不多,大部分研究的都是长链非编码RNA SH3PXD2A-AS1,其可以通过海绵miR-330-5p抑制下调UBA2表达,使Wnt/β-catenin信号通路失活,从而抑制细胞生长并促进凋亡[24]。根据现有文献报道,推测PATZ1更有可能和hsa-miR-3127-5p结合,参与对感染的调控。
综上所述,通过生物信息学分析,本研究构建了hsa_circ_0007460/hsa-miR-3127-5p/PATZ1调节网络,以揭示结核病中circRNA、miRNA和mRNA的相互作用。据此推测,hsa_circ_0007460可能通过和PATZ1竞争性结合hsa-miR-3127-5p,从而减少hsa-miR-3127-5p对PATZ1的抑制作用,最终促进凋亡,抑制自噬,提高BCG的胞内存活率。
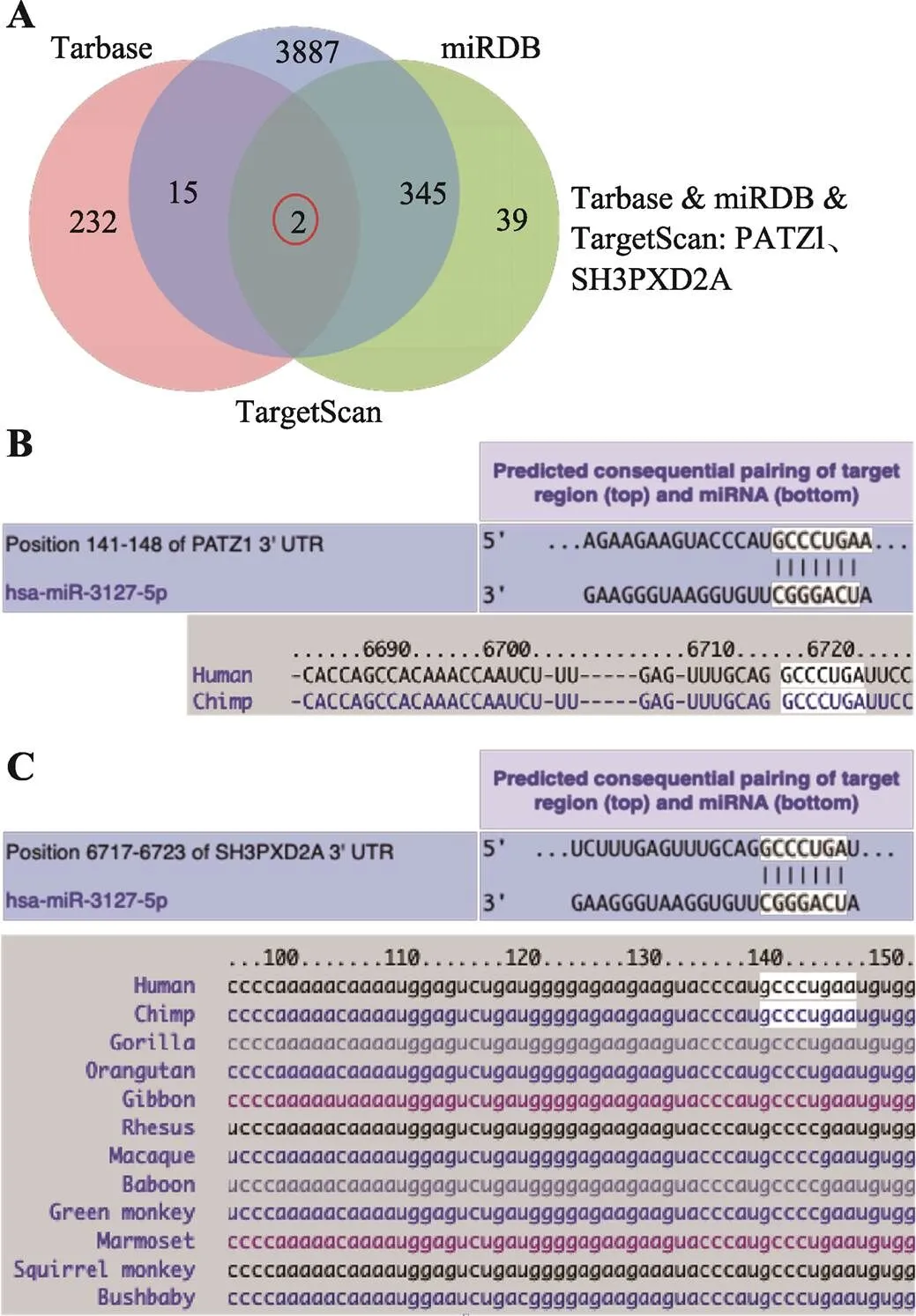
图7 hsa-miR-3127-5p靶mRNA分析
A:使用不同的算法预测hsa-miR-3127-5p的下游mRNA。B:使用TargetScan预测hsa-miR-3127-5p和PATZ1的结合位点。C:使用TargetScan预测hsa-miR-3127-5p和SH3PXD2A的结合位点。
3 讨论
研究表明circRNA可能在TB中发挥重要作用,并具有作为结核病诊断的新型生物标志物的巨大潜力。据文献报道hsa_circ_0005836[25],circRNA_ 051239、circRNA_029965和circRNA_404022[5],hsa_ circ_0043497和hsa_circ_0001204[6],hsa_circ_ 0028883[7]等circRNA在ATB中存在差异性表达。同时Huang等[26]研究表明,在感染的巨噬细胞中,过表达的circRNA-0003528通过下调miR-224-5p、miR-324-5p和miR-488-5p来上调CTLA4,从而促进巨噬细胞极化。Luo等[27]研究表明,circTRAPPC6B作为一种新型ceRNA,可拮抗miR-874-3p抑制ATG16L1表达的能力,从而激活并增加自噬以抑制巨噬细胞中的生长。
本文选择了hsa_circ_0007460进行研究,发现其在TB病人和BCG感染的THP-1人源巨噬细胞中都显著上调,和本课题的前期的组学结果一致。通过构建受试者工作特征曲线(ROC),评价hsa_circ_ 0007460对ATB的诊断价值,可以发现曲线下面积(AUC)为0.7474 (95%置信区间:0.6157~0.8790,<0.001),灵敏度76.67%,特异度78.13%。生物信息学分析表明,hsa_circ_0007460来自基因的外显子3~6的反向剪接,circRNA独特的环状结构使它们相对于线性转录本,能更耐受RNase R的消化以及转录抑制剂放线菌素D的抑制[28]。以上结果表明hsa_circ_0007460可以作为ATB的潜在诊断生物标志物。
由于凋亡、自噬在清除胞内菌方面都发挥着至关重要的作用[10, 29],推测hsa_circ_0007460可能会通过上述两种途径影响胞内BCG的存活。实验结果显示,hsa_circ_0007460的抑制会导致抗凋亡蛋白Bcl-2表达量显著上升,且能显著逆转BCG感染导致的Bcl-2下降。流式、CCK-8实验也表明抑制hsa_circ_0007460会导致凋亡率下降,细胞活力增加。hsa_circ_0007460的抑制显著促进THP-1人源巨噬细胞中的LC3-Ⅱ的表达,这表明hsa_circ_0007460的敲低会激活巨噬细胞中的自噬。自噬作用作为先天免疫,在消除细胞内中具有重要作用,巨噬细胞自噬的生理激活促进含有的吞噬体成熟为吞噬溶酶体,抑制的细胞内存活,而自噬的抑制会提高存活率[30]。BCG在巨噬细胞中的CFU计数结果显示,抑制hsa_circ_0007460能降低THP-1人源巨噬细胞中BCG的存活率。综上表明,hsa_circ_0007460可以促进凋亡同时抑制自噬,来提高BCG的胞内存活率。
本文进一步通过生信分析探究了hsa_circ_ 0007460具体是通过何种途径对BCG感染的巨噬细胞产生影响。前期结果表明,hsa_circ_0007460大部分定位于细胞质,研究表明,细胞质中的circRNA主要通过作为miRNA的“海绵”来发挥其生物学功能[13]。于是通过不同的数据库,对其下游的miRNA进行预测,一共预测到下游miRNA 120个。其中hsa-miR-3127-5p最有可能和hsa_circ_0007460结合从而在BCG感染THP-1人源巨噬细胞中发挥作用。miRNA是一类非编码小RNA,一般通过调控下游靶mRNA或蛋白从而发挥生物学作用[31]。数据库预测了hsa-miR-3127-5p下游的mRNA,三个数据库共同预测到的mRNA有两个,即PATZ1和SH3PXD2A。其中,有文献报道PATZ1能影响细胞凋亡[19~23]。所以最终通过生物信息学分析,初步构建了hsa_circ_ 0007460/hsa-miR-3127-5p/PATZ1轴,并推测hsa_ circ_0007460可能和PATZ1竞争性结合hsa-miR- 3127-5p,从而减少hsa-miR-3127-5p对PATZ1的抑制。
综上所述,本研究发现hsa_circ_0007460在TB病人的PBMC中高表达,可以作为TB诊断的潜在生物标志物,阐明了hsa_circ_0007460在BCG感染的巨噬细胞中的作用,其可以促进凋亡并抑制自噬,从而提高BCG的胞内存活率,可能为抗结核药物的开发提供有效的作用靶点。
[1] World Health Organization. Global tuberculosis report 2022. 2022.
[2] Dookie N, Rambaran S, Padayatchi N, Mahomed S, Naidoo K. Evolution of drug resistance in: a review on the molecular determinants of resistance and implications for personalized care., 2018, 73(5): 1138–1151.
[3] Kaushik AC, Wu QQ, Lin L, Li HB, Zhao LQ, Wen ZL, Song YZ, Wu QH, Wang J, Guo XK, Wang HL, Yu XL, Wei DQ, Zhang SL. Exosomal ncRNAs profiling of mycobacterial infection identified miRNA-185-5p as a novel biomarker for tuberculosis., 2021, 22(6): bbab210.
[4] Memczak S, Jens M, Elefsinioti A, Torti F, Krueger J, Rybak A, Maier L, Mackowiak SD, Gregersen LH, Munschauer M, Loewer A, Ziebold U, Landthaler M, Kocks C, Le Noble F, Rajewsky N. Circular RNAs are a large class of animal RNAs with regulatory potency., 2013, 495(7441): 333–338.
[5] Liu HJ, Lu G, Wang WX, Jiang XR, Gu SS, Wang J, Yan X, He F, Wang J. A panel of circRNAs in the serum serves as biomarkers forinfection., 2020, 11: 1215.
[6] Huang ZK, Su RG, Deng Z, Xu JQ, Peng YP, Luo Q, Li JM. Identification of differentially expressed circular RNAs in human monocyte derived macrophages response toinfection., 2017, 7(1): 13673.
[7] Zhang XL, Zhang Q, Wu QG, Tang HC, Ye LX, Zhang QL, Hua DM, Zhang YB, Li F. Integrated analyses reveal hsa_circ_0028883 as a diagnostic biomarker in active tuberculosis., 2020, 83: 104323.
[8] Yuk JM, Yoshimori T, Jo EK. Autophagy and bacterial infectious diseases., 2012, 44(2): 99–108.
[9] Shi HJ, Zhou Y, Jia ET, Liu ZY, Pan M, Bai YF, Zhao XW, Ge QY. Comparative analysis of circular RNA enrichment methods., 2022, 19(1): 55–67.
[10] Zhai WJ, Wu FJ, Zhang YY, Fu YR, Liu ZJ. The immune escape mechanisms of., 2019, 20(2): 340.
[11] Deretic V. Multiple regulatory and effector roles of autophagy in immunity., 2009, 21(1): 53–62.
[12] Jayachandran R, Bosedasgupta S, Pieters J. Surviving the Macrophage: Tools and Tricks Employed by., 2013, 374: 189–209.
[13] Wang Y, Wang SC, Jing HY, Zhang TY, Song N, Xu SW. CircRNA-IGLL1/miR-15a/RNF43 axis mediates ammonia- induced autophagy in broilers jejunum via Wnt/β-catenin pathway., 2022, 292(Pt A): 118332.
[14] Wang CS, Chen RS, Zhu XT, Zhang XB. Long non-coding RNAs LINC00689 inhibits the apoptosis of human nucleus pulposus cells via miR-3127-5p/ATG7 axis- mediated autophagy., 2022, 17(1): 1821–1832.
[15] Li J, Han JY, Zhao AM, Zhang GX. CircPAPPA regulates the proliferation, migration, invasion, apoptosis, and cell cycle of trophoblast cells through the miR-3127-5p/ HOXA7 Axis., 2022, 29(4): 1215–1225.
[16] Huang YJ, Ren L, Li JJ, Zou HB. Long non-coding RNA PVT1/microRNA miR-3127-5p/NCK-associated protein 1-like axis participates in the pathogenesis of abdominal aortic aneurysm by regulating vascular smooth muscle cells., 2021, 12(2): 12583–12596.
[17] Yu Z, Wang YZ, Wang B, Zhai JW. Metformin affects paclitaxel sensitivity of ovarian cancer cells through autophagy mediated by long noncoding RNASNHG7/ miR-3127-5p axis., 2022, 37(9): 792–801.
[18] Friedman RC, Farh KKH, Burge CB, Bartel DP. Most mammalian mRNAs are conserved targets of microRNAs., 2009, 19(1): 92–105.
[19] Tritz R, Mueller BM, Hickey MJ, Lin AH, Gomez GG, Hadwiger P, Sah DWY, Muldoon L, Neuwelt EA, Kruse CA. siRNA down-regulation of the PATZ1 gene in human glioma cells increases their sensitivity to apoptotic stimuli., 2008, 6(B): 865–876.
[20] Fedele M, Crescenzi E, Cerchia L. The POZ/BTB and AT-Hook containing zinc finger 1 (PATZ1) transcription regulator: physiological functions and disease involvement., 2017, 18(12): 2524.
[21] Ow JR, Ma H, Jean A, Goh Z, Lee YH, Chong YM, Soong R, Fu XY, Yang H, Wu Q. Patz1 regulates embryonic stem cell identity., 2014, 23(10): 1062–1073.
[22] Fedele M, Franco R, Salvatore G, Paronetto MP, Barbagal F, Pero R, Chiariotti L, Sette C, Tramontano D, Chieffi G, Fusco A, Chieffi P. PATZ1 gene has a critical role in the spermatogenesis and testicular tumours., 2008, 215(1): 39–47.
[23] Valentino T, Palmieri D, Vitiello M, Pierantoni GM, Fusco A, Fedele M. PATZ1 interacts with p53 and regulates expression of p53-target genes enhancing apoptosis or cell survival based on the cellular context., 2013, 4(12): e963.
[24] Guo S, Zhu KX, Yu WH, Wang T, Li S, Wang YX, Zhang CC, Guo JQ. SH3PXD2A-AS1/miR-330-5p/UBA2 ceRNA network mediates the progression of colorectal cancer through regulating the activity of the Wnt/β-catenin signaling pathway., 2021, 36(10): 1969–1980.
[25] Zhuang ZG, Zhang JA, Luo HL, Liu GB, Lu YB, Ge NH, Zheng BY, Li RX, Chen C, Wang X, Liu YQ, Liu FH, Zhou Y, Cai XZ, Chen ZW, Xu JF. The circular RNA of peripheral blood mononuclear cells: hsa_circ_0005836 as a new diagnostic biomarker and therapeutic target of active pulmonary tuberculosis., 2017, 90: 264–272.
[26] Huang ZK, Yao FY, Liu J, Xu JQ, Guo Y, Su RG, Luo Q, Li JM. Up-regulation of circRNA-0003528 promotesassociated macrophage polarization via down-regulating miR-224-5p, miR-324-5p and miR-488-5p and up-regulating CTLA4., 2020, 12(24): 25658–25672.
[27] Luo HL, Pi J, Zhang JA, Yang EZ, Xu H, Luo H, Shen L, Peng Y, Liu GB, Song CM, Li KY, Wu XJ, Zheng BY, Shen HB, Chen ZW, Xu JF. Circular RNA TRAPPC6B inhibits intracellulargrowth while inducing autophagy in macrophages by targeting microRNA-874-3p., 2021, 10(2): e1254.
[28] Szabo L, Salzman J. Detecting circular RNAs: bioinformatic and experimental challenges., 2016, 17(11): 679–692.
[29] Deretic V. Autophagy in immunity and cell-autonomous defense against intracellular microbes., 2011, 240(1): 92–104.
[30] Gutierrez MG, Master SS, Singh SB, Taylor GA, Colombo MI, Deretic V. Autophagy is a defense mechanism inhibiting BCG andsurvival in infected macrophages., 2004, 119(6): 753–766.
[31] Gajer P, Brotman RM, Bai GY, Sakamoto J, Schütte UME, Zhong X, Koenig SSK, Fu L, Ma ZS, Zhou X, Abdo Z, Forney LJ, Ravel J. Temporal dynamics of the human vaginal microbiota., 2012, 4(132): 132ra52.
Hsa_circ_0007460 affects the survival of intracellularby regulating autophagy and apoptosis of macrophages
Jinyi Zhang1, Yumo He1, Jingyu Zhou2, Shufeng Weng1, Huixia Ma1, Taiyue Lin1, Ying Xu1
Circular RNA (circRNA) is a category of non-coding RNAs characterized by the absence of a 5'-cap and 3′-poly(A) tail, and participates in the physiological processes of various human diseases. Nonetheless, the diagnostic and functional significance of circRNAs in active pulmonary tuberculosis (ATB) remains uncertain. Consequently, the purpose of this study is to investigate whether hsa_circ_0007460 can be employed as a potential diagnostic biomarker in ATB patients and explore its function. The result of real-time quantitative fluorescent PCR (RT-qPCR) validated a notable increase in the expression of hsa_circ_0007460 in the peripheral blood of 32 ATB patients, as well as in THP-1 human macrophages infected with Bacillus Calmette Guerin (BCG) which is an attenuated strain of Mycobacterium bovis. Additionally, the receiver operating curve (ROC) illustrated that the area under the ROC curve (AUC) , sensitivity and specificity were 0.7474, 76.67%, and 78.13% respectively. RNase R, Actinomycin D and other experiments confirmed that hsa_circ_0007460 was stabler than its linear mRNA, indicating that hsa_circ_0007460 has potential as a diagnostic biomarker of ATB. Furthermore, Western blot (WB), Cell Counting Kit-8 (CCK-8), plate counting, and immunofluorescence experiments revealed that hsa_circ_0007460 could regulate apoptosis and autophagy of macrophages. The downstream miRNAs and mRNAs were subsequently predicted using bioinformatics, and the hsa circ 0007460/hsa-miR-3127-5p/PATZ1 axis was built. These above results suggest that hsa_circ_0007460 is substantially up-regulated in the peripheral blood of patients with ATB and can be utilized as a potential diagnostic biomarker. In addition, hsa_circ_0007460 can promote apoptosis of macrophages and inhibit autophagy of macrophages, thereby promoting the survival of BCG.
hsa_circ_0007460; autophagy; apoptosis; TB; macrophage
2023-06-30;
2023-08-31;
2023-09-18
国家自然科学基金(编号:81971900) [Supported by the National Natural Science Foundation of China (No.81971900)]
章金怡,硕士研究生,专业方向:微生物学。E-mail: 20210700011@fudan.edu.cn
徐颖,博士,副教授,研究方向:结核分枝杆菌的感染与免疫、新型结核病疫苗的研制。E-mail: yingxu2520@fudan.edu.cn
10.16288/j.yczz.23-160
(责任编委: 谢建平)