神经肌肉电刺激仪联合赋能理论下的强化康复护理对急性脑梗死患者认知水平及行为能力的影响
潘丹阳,张红
浙江省台州医院 (浙江台州 318050)
收稿日期:2023-07-05
急性脑梗死(acute cerebral infarction,ACI)是临床常见的脑血管疾病,占脑血管疾病的60%~80%[1]。全球脑梗死的发病率及复发率均较高,且随着老龄化的发展发病率逐渐升高,危害患者的生命安全,同时显著增加社会负担。ACI 发生发展过程中会引发脑组织供血障碍,导致缺氧、缺血,进而诱发脑组织坏死,影响神经功能[2]。研究认为,20%~25%的脑梗死患者发病后会出现一定程度的认知功能障碍,短时间内会出现记忆力降低,随着疾病的进展可能严重影响患者生命质量[3]。同时,ACI 患者的行为能力会受到一定影响,例如运动功能障碍、认知功能障碍及口齿不清等,导致患者发生焦虑及抑郁。因此,早期对患者进行全面的康复护理对改善患者预后意义重大。神经肌肉电刺激(neuromuscular electrical stimulation,NMES)是一种利用电能刺激神经及肌肉促进康复的治疗方法,可将电极贴片粘附在肌肉或神经,通过传入电流刺激神经及肌肉,发挥恢复神经功能的作用[4]。现阶段NMES 已广泛应用于ACI 的治疗,以增强肌肉力量[5]。护理是脑梗死治疗过程中不可或缺的环节,对于促进患者康复至关重要。强化康复护理是在传统康复护理中加入新的措施及方法,帮助患者尽快康复。研究表明,强化康复护理是一种更全面、更人性化及高效的康复方法,强调不仅要关注患者身体健康,也要关注心理及社交[6]。赋能理论是指通过增加个人、组织及社会能力实现自我价值感,该理论认为,每个人均有独特的潜力和价值,只要给予足够的支持,就能发挥固有的能力[7]。因此,本研究旨在探讨神经肌肉电刺激仪联合赋能理论下的强化康复护理对急性脑梗死患者认知水平及行为能力的的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2021年8月至2022年8月我院收治的110例急性脑梗死患者为研究对象,按照随机数字表法分为对照组与观察组,各55 例,两组一般资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
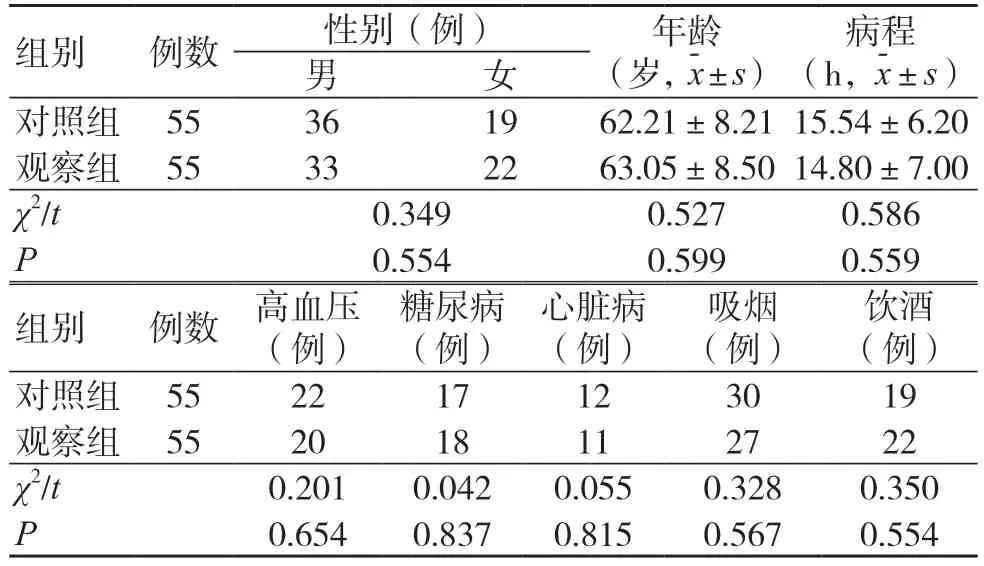
表1 两组一般资料比较
纳入标准:符合《中国急性缺血性脑卒中诊治指南2018》[8]中的相关诊断标准;入院后经颅脑CT 及脑磁共振确诊;年龄>18 岁;首次发病;发病时间<24 h;生命体征稳定且无限制活动合并症。排除标准:合并精神系统或严重器质性疾病;脑梗死复发;入院前存在认知功能障碍或其他引发认知功能障碍的疾病;脑外伤、蛛网膜下腔出血、硬膜下出血等;严重心、肝、肾等器官疾病;植入脑深部刺激电极、颅内动脉瘤夹及人工耳蜗。
1.2 方法
对照组给予基于赋能理论的强化康复护理。通过肯定患者,将消极的抵抗训练转化为积极的主动训练。为患者设立具体目标,如短期目标是实现肢体的摆位,中期目标是实现从坐位到行走,远期目标是能够独立行走,生活可自理。(1)制订方案:护士和康复医师根据患者的神经功能、肌肉状况、生活能力和心理状态共同制订康复方案。(2)体位摆放及变换:护理人员帮助患者保持仰卧位,并在关键部位(如膝关节、肩部和骨盆等)放置软枕支撑。(3)按摩:康复医师按摩患者肌肉及穴位,对患侧功能障碍局部进行松弛按摩,良侧关节则进行被动活动及按摩,20 min/次,2 次/d;(4)被动训练:责任护士指导患者进行被动训练,训练顺序由大关节到小关节,活动幅度由小到大;(5)坐起、站立训练:当患者可以自主训练时,指导其进行起坐训练,并逐渐增强腰部承重能力;(6)认知功能训练:护理人员可采用视觉、听觉及触觉等方法指导患者进行认知功能训练,如让患者多次观看图片集视频,以提高语言能力;(7)饮食训练:仰卧位,床头抬高30°,后颈部前倾,缓慢进食,食量逐渐增加,以质地柔软的食物为主。
观察组在对照组基础上给予神经肌肉电刺激仪干预:选择CS-200E 型神经肌肉电刺激仪(浙江帝诺医疗科技有限公司),强度28 mA,波长800 ms,间隔3 s;将电极贴片分别置于股四头肌、臀中肌及左右颈部颈动脉前与颈动脉后等肌肤部位,进行电刺激,肉眼可观察到肌肉颤动收缩即为开始治疗,30 min/次,1 次/d。
两组均持续干预6 周。
1.3 观察指标
(1)认知功能:采用简易智力状态检查量表(mini-mental state examination,MMSE)及蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)评估患者认知功能。MMSE量表评分0~30分,包括时间定向力、记忆力、语言等维度,评分越高表明认知功能越强。MoCA 量表总分30 分,包括注意力、记忆力、语言功能及定向力等维度,评分越高表明患者认知功能越强。(2)行为能力:采用Fugl-Meyer 运动功能量表(Fugl-Meyer assessment,FMA)评分评估肢体功能,主要包括上肢及下肢运动,上肢运动总分66 分,包括33 项任务,下肢运动总分34 分,包括17 项任务,评分越高表明运动功能恢复程度越好;采用日常生活能力量表(activity of daily living scale,ADL)评分评估患者洗澡、穿衣、如厕等情况,评分越高表明生活能力越强。(3)神经功能水平及认知功能:抽取患者空腹静脉血5 ml,以3 500 r/min 转速离心10~15 min,保留血清,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒检测脑源性神经营养因子(brain-derived neuro-trophic factor,BDNF)、类胰岛素生长因子1(insulin-like growth factor-1,IGF-1)、泛素竣基末端水解酶-1(ubiquitin C-terminal hydrolase-L1,UCH-L 1)、紧密连接蛋白(occludin)及缝隙连接蛋白1(zonula occludens-1,ZO-1)水平,严格按照试剂盒说明书操作。(4)生活质量:采用世界卫生组织生活质量100(WHO Quality of Life 100,WHO-QOL100)量表评估患者生理领域、心理领域、社会关系、环境领域、自身生活质量总主管感受、自身健康状况总主观感受情况,其中生理领域、心理领域、环境领域、自身生活质量总主观感受各24 分,社会关系领域、自身健康状况总主观感受各12 分,总分120 分;评分越高表明生活质量越高。
1.4 统计学处理
采用SPSS 26.0 统计软件进行数据分析。计量资料以±s表示,采用t检验。计数资料以率表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组认知功能比较
治疗前两组MMSE 及MoCA 评分比较,差异无统计学意义(P>0.05);治疗后两组MMSE及MoCA 评分均高于治疗前,差异有统计学意义(P<0.05),见表2。
表2 治疗前后两组MMSE 及MoCA 评分比较(分,±s)
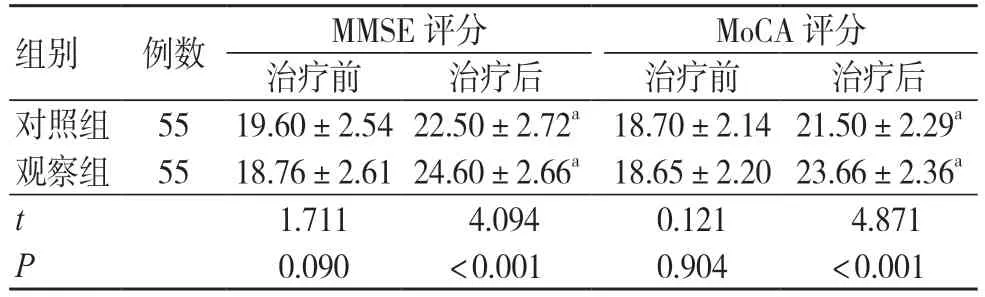
表2 治疗前后两组MMSE 及MoCA 评分比较(分,±s)
注:与同组治疗前比较,aP<0.05;MMSE 为简易智力状态检查量表,MoCA 为蒙特利尔认知评估量表
组别 例数 MMSE 评分 MoCA 评分治疗前 治疗后 治疗前 治疗后对照组 55 19.60±2.54 22.50±2.72a 18.70±2.14 21.50±2.29a观察组 55 18.76±2.61 24.60±2.66a 18.65±2.20 23.66±2.36a t 1.711 4.094 0.121 4.871 P 0.090 <0.001 0.904 <0.001
2.2 两组行为能力比较
治疗前两组上肢FMA 评分、下肢FMA 评分及ADL 评分比较,差异无统计学意义(P>0.05);治疗后两组上肢FMA 评分、下肢FMA 评分及ADL评分均高于治疗前,差异有统计学意义(P<0.05),见表3。
表3 治疗前后两组行为能力评分比较(分,±s)
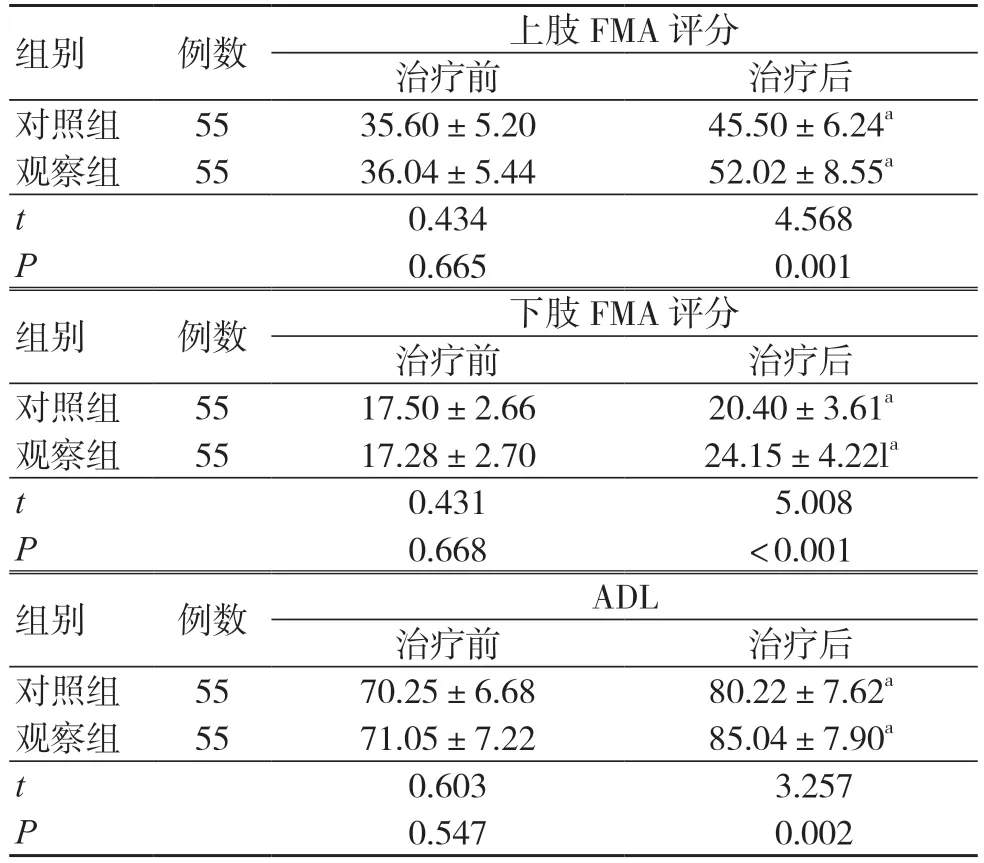
表3 治疗前后两组行为能力评分比较(分,±s)
注:与同组治疗前比较,aP<0.05;FMA 为Fugl-Meyer 运动功能量表,ADL 为日常生活能力量表
组别 例数 上肢FMA 评分治疗前 治疗后对照组 55 35.60±5.20 45.50±6.24a观察组 55 36.04±5.44 52.02±8.55a t 0.434 4.568 P 0.665 0.001组别 例数 下肢FMA 评分治疗前 治疗后对照组 55 17.50±2.66 20.40±3.61a观察组 55 17.28±2.70 24.15±4.22la t 0.431 5.008 P 0.668 <0.001组别 例数 ADL治疗前 治疗后对照组 55 70.25±6.68 80.22±7.62a观察组 55 71.05±7.22 85.04±7.90a t 0.603 3.257 P 0.547 0.002
2.3 两组神经功能水平比较
治疗前两组BDNF、IGF-1 及UCH-L1 比较,差异无统计学意义(P>0.05);治疗后两组BDNF、IGF-1 水平升高,UCH-L1 降低,差异有统计学意义(P<0.05);治疗后观察组BDNF、IGF-1 水平高于对照组,UCH-L1 水平低于对照组,差异有统计学意义(P<0.05),见表4。
表4 治疗前后两组血清神经功能水平比较(±s)
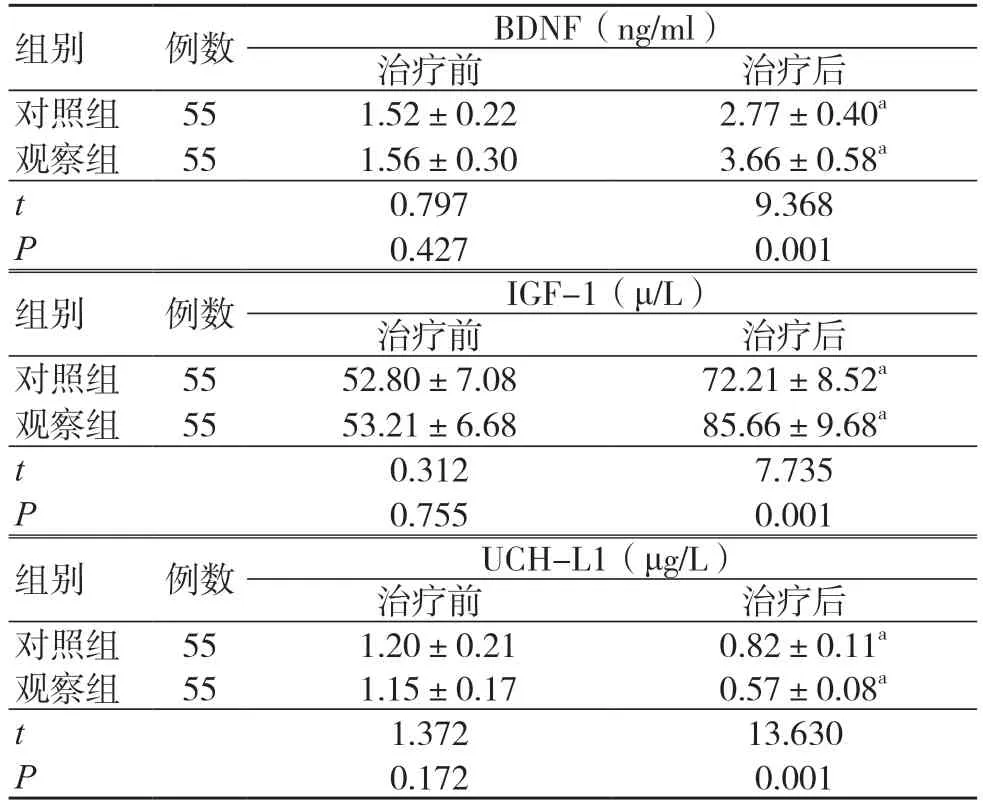
表4 治疗前后两组血清神经功能水平比较(±s)
注:与同组治疗前比较,aP<0.05;BDNF 为脑源性神经营养因子,IGF-1 为类胰岛素生长因子1,UCH-L1 为泛素竣基末端水解酶-1
组别 例数 BDNF(ng/ml)治疗前 治疗后对照组 55 1.52±0.22 2.77±0.40a观察组 55 1.56±0.30 3.66±0.58a t 0.797 9.368 P 0.427 0.001组别 例数 IGF-1(μ/L)治疗前 治疗后对照组 55 52.80±7.08 72.21±8.52a观察组 55 53.21±6.68 85.66±9.68a t 0.312 7.735 P 0.755 0.001组别 例数 UCH-L1(μg/L)治疗前 治疗后对照组 55 1.20±0.21 0.82±0.11a观察组 55 1.15±0.17 0.57±0.08a t 1.372 13.630 P 0.172 0.001
2.4 两组认知功能比较
治疗前两组occludin 及ZO-1 水平比较,差异无统计学意义(P>0.05);治疗后两组occludin 及ZO-1 升高,差异有统计学意义(P<0.05);治疗后观察组occludin 及ZO-1 水平高于对照组,差异有统计学意义(P<0.05),见表5。
表5 治疗前后两组occludin 及ZO-1 水平比较(±s)
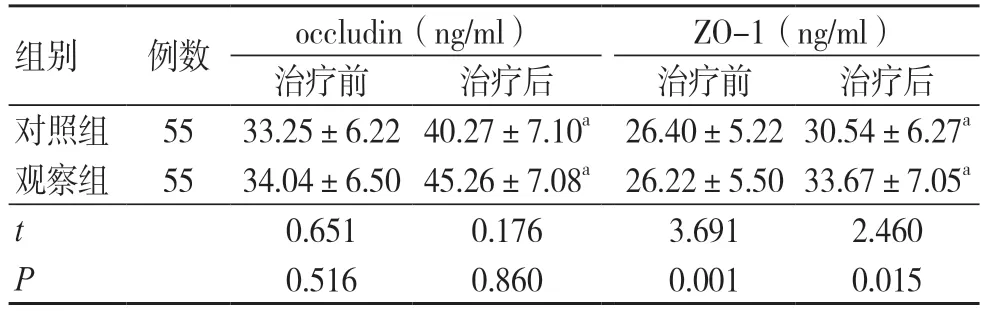
表5 治疗前后两组occludin 及ZO-1 水平比较(±s)
注:与同组治疗前比较,aP <0.05;occludin 为紧密连接蛋白,ZO-1 为缝隙连接蛋白1
组别 例数 occludin(ng/ml) ZO-1(ng/ml)治疗前 治疗后 治疗前 治疗后对照组 55 33.25±6.22 40.27±7.10a 26.40±5.22 30.54±6.27a观察组 55 34.04±6.50 45.26±7.08a 26.22±5.50 33.67±7.05a t 0.651 0.176 3.691 2.460 P 0.516 0.860 0.001 0.015
2.5 两组生活质量比较
治疗前两组生理领域、心理领域、社会关系、环境领域、自身生活质量总主观感受、自身健康状况总主观感受及总分比较,差异无统计学意义(P>0.05);治疗后两组生理领域、心理领域、自身生活质量总主观感受、自身健康状况总主观感受及总分高于治疗前,且观察组高于对照组,差异均有统计学意义(P<0.05),见表6。
表6 两组治疗前后生活质量评分比较(分,±s)
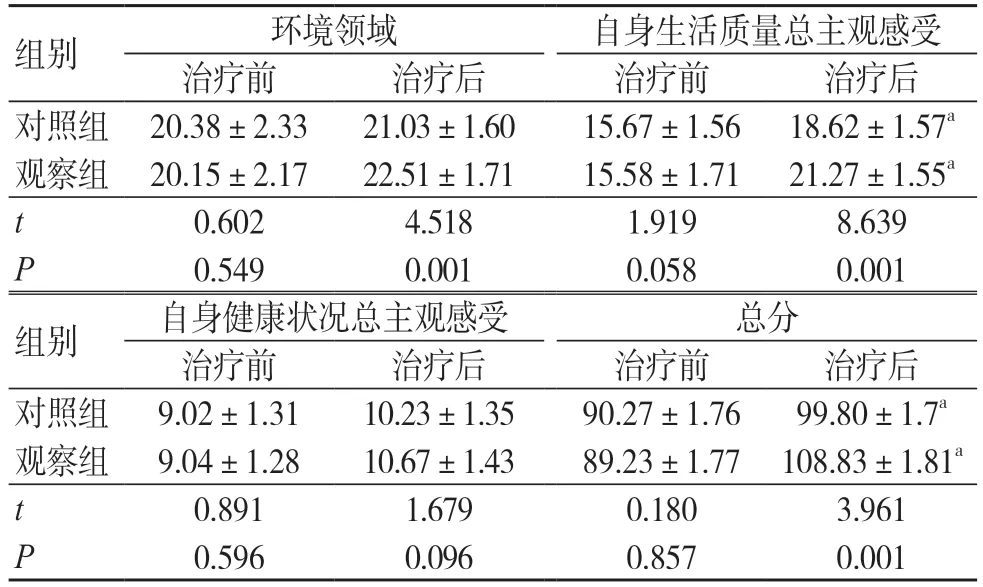
表6 两组治疗前后生活质量评分比较(分,±s)
注:与同组治疗前比较,aP<0.05
组别 环境领域 自身生活质量总主观感受治疗前 治疗后 治疗前 治疗后对照组 20.38±2.33 21.03±1.60 15.67±1.56 18.62±1.57a观察组 20.15±2.17 22.51±1.71 15.58±1.71 21.27±1.55a t 0.602 4.518 1.919 8.639 P 0.549 0.001 0.058 0.001组别 自身健康状况总主观感受 总分治疗前 治疗后 治疗前 治疗后对照组 9.02±1.31 10.23±1.35 90.27±1.76 99.80±1.7a观察组 9.04±1.28 10.67±1.43 89.23±1.77 108.83±1.81a t 0.891 1.679 0.180 3.961 P 0.596 0.096 0.857 0.001
3 讨论
随着人们生活方式的改变及社会人口老龄化的加剧,ACI 的发病率逐渐升高,部分患者发病后存在认知功能及行为能力减退。赋能理论下的强化康复护理通过强调自我效能,促进自我认知及行为改变,同时制订个性化康复护理方案,有利于促进患者认知和行为功能恢复,提高康复效果和生活质量。神经肌肉电刺激主要通过刺激机体神经元活性,提高组织修复作用,进一步提高认知功能。本研究将两者结合探讨对ACI 患者的认知功能及行为能力的影响,并深入探讨其机制及优势,以更好地指导临床实践。
认知功能是大脑的复杂功能之一,包含思维及记忆活动。ACI 可能导致认知功能障碍,与脑损伤的位置、程度及神经递质等因素相关。ACI 发生血栓阻塞血管,可增加局部缺氧缺血,促使神经细胞凋亡,加重大脑区域损伤,进而引发认知功能障碍[9]。研究表明,ACI 可能诱发星形胶质细胞凋亡,破坏血脑屏障,引发脑组织水肿及炎症反应,加重脑损伤,进而影响认知功能[10]。另外,神经细胞损伤可能导致突触萎缩及前后元件受损,进而影响认知功能[11]。认知功能的衡量可以通过包括MMSE 和MoCA,以及occludin、ZO-1 等血清指标。研究表明,血脑屏障通透性的增高可能与occludin 和ZO-1 的异常表达有关,进而影响神经细胞健康,导致记忆能力下降和认知功能障碍[12-13]。本研究结果显示,观察组MMSE 和MoCA 评分、occludin 及ZO-1 水平均高于对照组,表明赋能理论下的强化康复护理联合NMES 可显著提高认知功能。NMES 作为一种非侵入性治疗手段,通过刺激神经、肌肉等组织促进患者康复。研究表明,NMES 可提高神经细胞兴奋性,促进神经递质释放,增强认知功能。强化康复护理可通过认知功能训练和语言能力提高等方式促进受损认知功能恢复[14-15]。赋能理论强调人的积极性和主动性,可激发脑卒中患者的自我探索和学习能力,有利于提升其认知功能[16]。
ACI 发生后可导致大脑局部缺血或坏死,患者可合并注意力、记忆、言语和运动等方面的缺损,进而影响行为生活能力。本研究结果显示,观察组肢体FMA、ADL 评分均高于对照组,表明赋能理论下强化康复护理联合NMES 可加快恢复患者行为能力。NMES 可通过电流刺激加强肌肉收缩并调节神经递质水平,有利于促进神经功能的恢复[17]。强化康复护理可通过采取针对性措施,提高患者肢体功能,促进患者康复。赋能理论下的强化康复护理可帮助脑梗死患者恢复肢体功能[18],通过提高自我效能、自主性、社交支持帮助患者增强自身信念,提高康复效果和生命质量。本研究结果显示,观察组BDNF 、IGF-1 水平高于对照组,UCH-L1 水平低于对照组,表明赋能理论下的强化康复护理联合NMES 可提高神经功能。ACI 患者血清中的BDNF、IGF-1 水平降低,可避免神经损伤的加重,促进神经功能的恢复。UCH-L1 是脑组织中重要的泛素切割酶,脑梗死后UCH-L1 水平升高,可加重神经元突出数量及功能障碍,因此,降低UCHL1 水平利于神经功能恢复[19]。赋能理论下的强化康复护理可为脑卒中患者提供综合、系统的康复服务,强化正面反馈和家庭、社会支持,有效促进神经功能的恢复和重建,进而提高生命质量[20]。本研究结果显示,观察组生命质量高于对照组,表明赋能理论下的强化康复护理联合NMES 可提高患者生命质量。
综上所述,神经肌肉电刺激仪联合赋能理论下的强化康复护理可提高急性脑梗死患者认知水平,增强肢体及生活功能,改善生命质量。

