磁共振成像增强肝胆期不同病理分级肝内肿块型胆管癌的信号特征分析
殷小平,邢立红,卓利勇,张宇,王佳宁,刘珊,陈新星
(河北大学附属医院放射科,河北 保定 071000)
0 引言
肝内肿块型胆管癌(intrahepatic mass-forming cholangiocarcinoma,IMCC)是肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)最常见的亚型,约占60%[1]。约90%为普通腺癌,根据WHO病理分级可为高分化、中分化、低分化,以中至高分化腺癌多见[2]。IMCC缺乏特异的临床表现和血清标志物,早期诊断困难,恶性度高,预后差,易复发和转移。肿瘤分化不良与患者较短的总生存期相关[1]。有研究显示,对早期边界清楚、高分化的ICC患者,有效的手术切除可改善患者长期生存率[3]。因此早期明确病理分级,对临床治疗和患者预后具有重要指导意义。肝细胞特异性对比剂已普遍应用于肝脏疾病。应用钆贝葡胺注射液对比剂,约96%IMCC病灶于肝胆期表现为靶征,极少数表现为低信号[4],部分靶征信号不均匀,称为分层靶征[5]。有研究显示,预测IMCC分化程度的独立危险因素为淋巴结转移、MRI动态增强方式及表观弥散系数平均值,联合应用可提高预测效能[6]。MRI增强肝胆期信号特征与病理分级关系的研究鲜有报道,本团队前期研究探索IMCC病例分化程度与MRI信号的关系,将IMCC病灶分为中高分化和低分化,肝胆期信号分为靶征和非靶征[7],本次研究将IMCC病理分级和肝胆期信号进一步细化,深入探讨IMCC病理分级与肝胆期信号的关系,以期为术前临床诊断和评估提供理论基础。
1 资料与方法
1.1 研究对象
回顾性分析2018年1月至2022年1月在河北大学附属医院确诊的IMCC患者。纳入标准:(1)经手术或穿刺病理证实为ICC,且病理分级明确;(2)取得病理前行肝脏MRI平扫加增强扫描;(3)取得病理前未经任何治疗。排除标准:(1)病理类型为混合型肝细胞癌—胆管细胞癌;(2)图像质量不佳,不能用于分析。
49例患者纳入研究,男31例,女18例,平均年龄(60.98±11.02)岁。
1.2 检查方法
MRI检查采用GE Discovery MR 750 3.0 T 超导型MR扫描设备、德国Siemens Amira 1.5 T超导型MR扫描设备、飞利浦Achieva 1.5 T超导型MR扫描设备,采用腹部相控阵线圈。对比剂采用钆贝葡胺注射液,肘静脉团注,剂量0.1 mmol/kg,注射流率2.0 mL/s。延迟90~120 min,行肝胆期扫描。
1.3 图像分析
影像图像经2名具有副主任医师资格的影像医师在不知晓病理的情况下阅片,意见不一致时经协商达成一致。具体描述特征如下。(1)病灶大小分为长径<3 cm、长径3~6 cm、长径>6 cm。(2)肝胆期信号特征分为:①靶征,即外周低信号、中心高信号;②多层靶征,即外周低信号、中间层高信号、最中心低信号;③低信号;④等信号;⑤高信号。(3)肝胆期病灶外周低信号环分为:①存在,环完整;②存在,环不完整;③不存在。
病理学分析:所有患者术后标本送病理科行苏木精-伊红染色,对于分化较差、染色难以判定组织学类型的病例,行免疫组化染色以明确诊断。病理分级含高分化、中分化、低分化。
1.4 统计学方法
采用SPSS 22.0统计软件,计量资料的统计学描述为均数±标准差。分类资料的统计学描述为频数,并用卡方检验,P<0.05为差异有统计学意义。
2 结果
49例IMCC确诊患者按照病理分级分为3类,高分化5例,中分化26例,低分化18例。见表1。
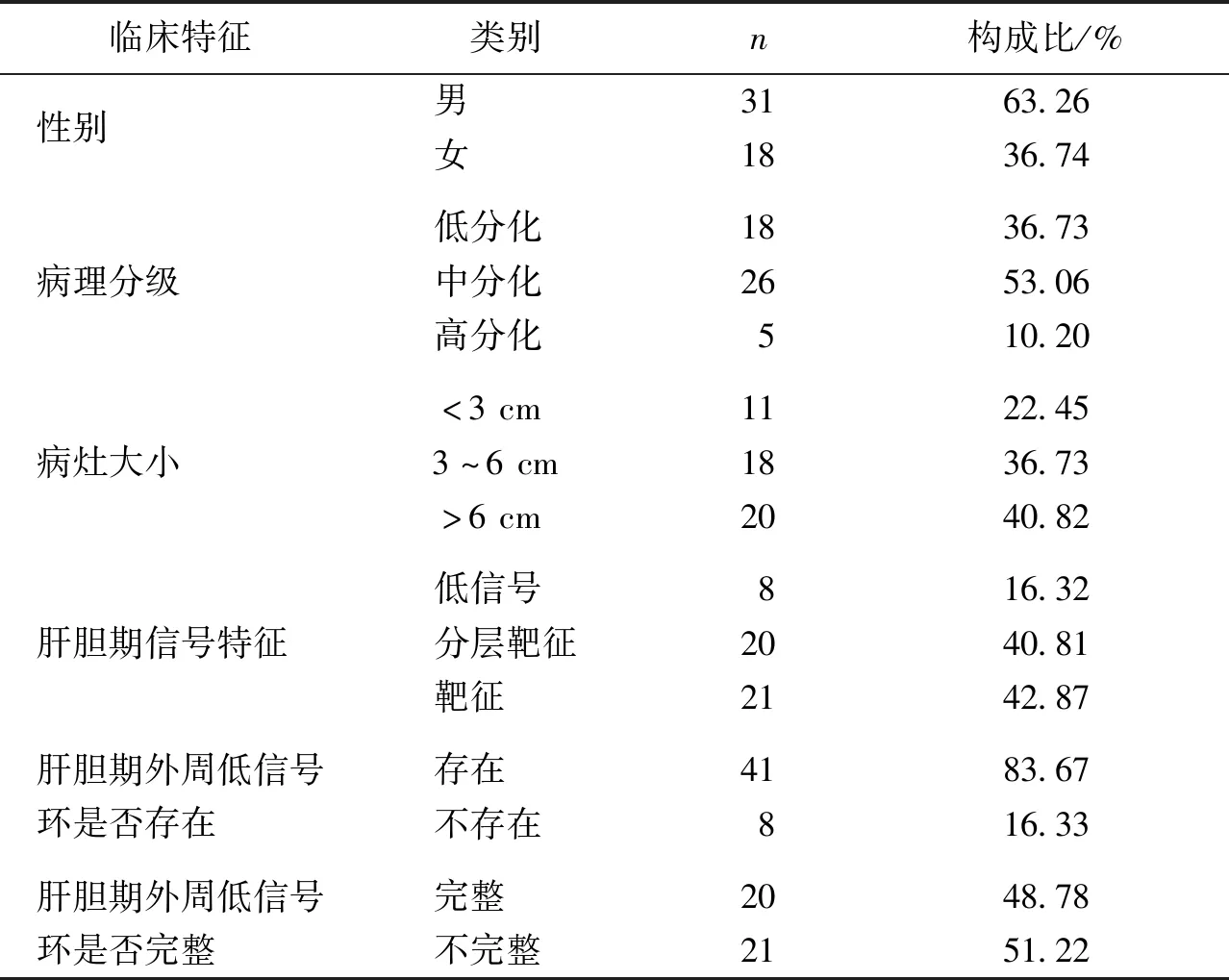
表1 患者基本资料
2.1 肝胆期信号特征和病理分级的关系
肝胆期出现靶征者21例,分层靶征20例,低信号8例,未见等信号及高信号病灶。高分化:靶征1例,分层靶征2例,低信号2例(图1)。中分化:靶征14例(图2),分层靶征7例,低信号者5例。低分化:靶征6例,分层靶征11例(图3),低信号1例(图4)。肝胆期信号特征在不同病理分级间差异无统计学意义(χ2=2.377,P=0.305)(表2)。
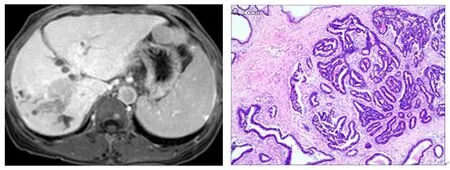
图1 肝胆期呈低信号的高分化IMCC(苏木精-伊红染色×200)

图2 肝胆期外周低信号环完整的中分化IMCC(苏木精-伊红染色×200)
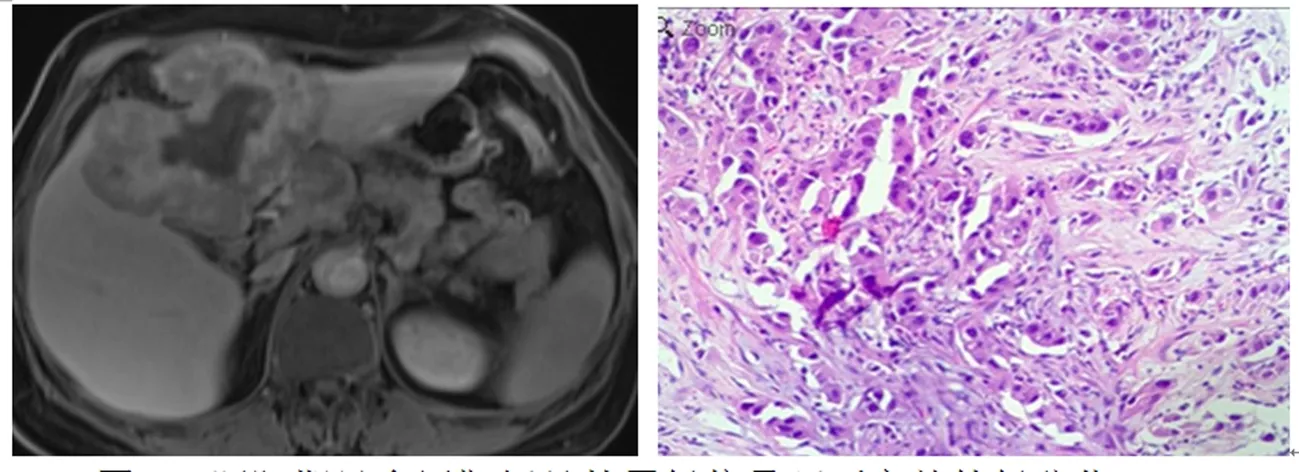
图3 肝胆期呈多层靶征且外周低信号环不完整的低分化IMCC(苏木精-伊红染色×200)

图4 肝胆期呈低信号的低分化IMCC(苏木精-伊红染色×200)
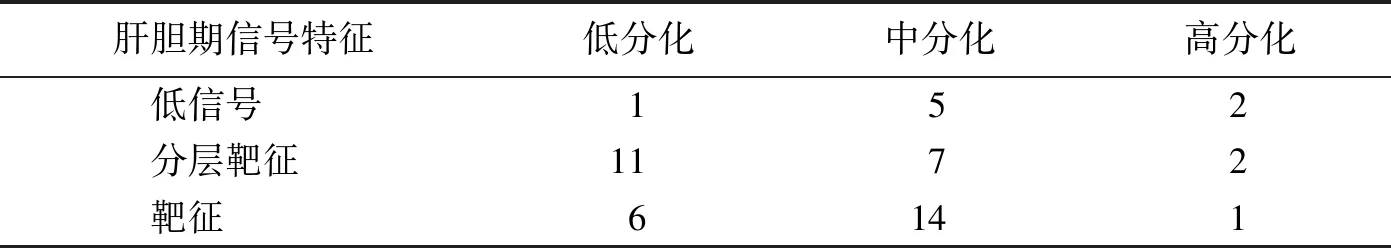
表2 肝胆期信号特征和病理分级的关系 例
2.2 肝胆期外周低信号环和病理分级的关系
肝胆期病灶外周低信号环存在41例,其中低信号环完整20例,不完整21例。高分化:外周低信号环存在3例,环均不完整。中分化:外周低信号环存在21例,环完整14例(图2),环不完整7例(图5)。低分化:外周低信号环存在17例,环完整6例,环不完整11例(图3)。肝胆期外周低信号环是否存在在不同病理分级间差异无统计学意义(χ2=3.740,P=0.154)(表3),外周低信号环是否完整在不同病理分级间差异有统计学意义(χ2=6.618,P=0.037)(表4),即外周低信号不完整多见于低分化IMCC患者。

图5 肝胆期外周低信号环不完整的中分化IMCC(苏木精-伊红染色×200)

表3 肝胆期外周低信号环是否存在与病理分级的关系 例

表4 肝胆期外周低信号环是否完整与病理分级的关系 例
2.3 病灶大小和肝胆期信号特征、病理分级的关系
病灶长径<3 cm者11例,3~6 cm者18例,>6 cm者20例(表1),病灶大小在3种肝胆期信号间差异有统计学意义(χ2=18.937,P=0.001)(表5),即病灶越大,肝胆期更多表现为分层靶征(图3);而病灶大小与病理分级无相关性(χ2=3.840,P=0.147)(表6)。

表5 病灶大小和肝胆期有无靶征的分布 例

表6 病灶大小和病理分级的分布 例
3 讨论
本研究中IMCC肝胆期靶征出现率为42.87%,分层靶征出现率为40.81%。靶征的病理基础为病变中心富含纤维组织,肝胆期对比剂蓄积呈高信号,而外周肿瘤细胞丰富,不摄取对比剂呈相对低信号[4-5,8]。理论上IMCC分化程度越低,肿瘤细胞生长越快,中心更易囊变及坏死[9],本研究推测分化程度越低,肝胆期更易呈分层靶征,其最中心低信号为囊变坏死区。但研究结果并未发现肝胆期信号特征与病理分级具有相关性。分析原因可能与本研究样本数量较少有关,后续研究将继续增加样本量。本研究显示,肝胆期IMCC病灶外周低信号环是否完整与病理分级具有相关性,外周低信号环不完整多见于低分化IMCC。分析可能的原因:(1)IMCC分化程度越低,病灶外周肿瘤细胞越丰富,肿瘤细胞生长速度不一致,可能出现局部肿瘤细胞分布过少过薄[10],低信号显示不明显,视觉上形成低信号环不连续;(2)IMCC病灶越大,形态越不规则[11],局部低信号环可能显示不清;(3)IMCC分化程度越低,边缘发现微血管浸润的概率越大[12],与正常肝实质的界限相对不清楚,致使局部低信号环显示不清。
本研究还显示,IMCC病灶大小与肝胆期信号具有相关性,病灶越大,肝胆期更多表现为分层靶征。分析原因可能为病灶体积越大,中心部分供血越差,易出现坏死[6],坏死成分不摄取对比剂,也不出现对比剂蓄积,从而表现为分层靶征。本研究尚未发现病灶大小与病理分级具有相关性,推测与病例数量较少有关,后续会增加样本量进一步研究。
本研究将肝胆期信号特征和IMCC病理分级均进行细分类,并探讨两者之间的关系,目前鲜有类似报道。本研究也存在一些局限性:首先,病例数量较少,可能会对研究结果有一定的影响;其次,本研究为回顾性研究,在病例筛选时可能存在一定的偏倚。
4 结论
肝胆期外周低信号环是否完整与IMCC病理分级具有相关性,低信号环不完整多见于低分化IMCC。病灶大小与肝胆期信号特征具有相关性,病灶越大,肝胆期更多表现为分层靶征。本研究有助于术前预测病变的病理分级,为临床治疗和患者预后提供重要参考价值。

