金丝桃苷通过AMPK/SIRT1 通路介导的自噬途径对糖尿病小鼠胰岛素抵抗的改善作用
郝 冰,赵志轩,赵玉梅,王久英
(1.牡丹江医学院附属红旗医院一分院,黑龙江 牡丹江 157000; 2.牡丹江医学院附属红旗医院中西医科,黑龙江 牡丹江 157000; 3.牡丹江医学院附属红旗医院药学部,黑龙江 牡丹江 157000; 4.牡丹江医学院附属红旗医院门诊预检分诊,黑龙江 牡丹江 157000)
糖尿病是一种终身性的内分泌代谢障碍性疾病,以高血糖为特征,可慢性损害眼、肾、心脏、血管、神经等各组织并引起功能障碍,近年来发病率不断上升,已成为严重危害人类健康的慢性杀手[1-2]。胰岛素抵抗指机体组织器官对胰岛素的敏感性降低,进而导致对葡萄糖的摄取、利用减少,引起血糖升高,是糖尿病最主要的致病因素及病理基础[3]。目前已有的降糖药在临床治疗中并非适用于所有患者,开发能改善胰岛素抵抗的降糖药物势在必行。自噬是一种溶酶体依赖性的降解途径,能降解受损细胞器、未折叠蛋白质等细胞内成分,为细胞存活提供必需原料,提高细胞质量[4]。自噬的过度激活会造成细胞不必要的损伤,而自噬反应过弱可能无法有效保护细胞,以上情形均可能导致胰岛素抵抗发生[5-6]。金丝桃苷,又称槲皮素-3-O-β-D-吡喃半乳糖苷,为黄酮醇苷类化合物,具有护肝、抗氧化、抗炎、降血糖等作用[7-8]。研究发现,金丝桃苷能降低自噬,减轻H9c2 心肌细胞的缺血再灌注损伤[9]。AMP 活化蛋白激酶/沉默信息调节因子1 (AMP-activated protein kinase/silent information regulator 1,AMPK/SIRT1)通路是介导自噬的常见途径,在改善棕榈酸诱导的肝脏胰岛素抵抗时发挥重要作用[10]。本研究通过基于AMPK/SIRT1 通路介导的自噬途径探讨金丝桃苷对糖尿病小鼠胰岛素抵抗的改善作用。
1 材料
1.1 动物 SPF 级雄性C57BL/6 小鼠40 只,7 ~8 周,体质量22~24 g,购自济南朋悦实验动物繁育有限公司[实验动物生产许可证号SCXK (鲁) 2019-0003],饲养于牡丹江医学院 [实验动物使用许可证号SYXK (黑) 2019-006],室温20 ~25 ℃,相对湿度55% ~65%,明暗交替12 h/12 h,摄食饮水自由,适应3 d 后进行实验。本研究经本院动物伦理委员会审核批准(伦理号20210010218)。
1.2 试剂与药物 链脲佐菌素(streptozotocin,STZ)、金丝桃苷(纯度≥98%,批号YZ-111521)、雷帕霉素、HE染色试剂盒购自北京索莱宝科技有限公司; 小鼠空腹胰岛素(fasting insulin,FINS) ELISA 试剂盒购自上海梵态生物科技有限公司; Beclin 1 免疫组化试剂盒购自上海雅吉生物科技有限公司; 兔抗p-AMPK、兔抗AMPK、兔抗SIRT1、兔抗微管相关蛋白1 轻链3 (microtubule-associated protein 1 light chain 3,LC3)、兔抗p62、兔抗Bcl-2 相关X 蛋白(Bcl-2 associated X protein,Bax)、兔抗caspase-6、兔抗GAPDH、山羊抗兔IgG 购自英国Abcam 公司。
1.3 仪器 三诺安稳优加血糖仪(长沙三诺生物传感股份有限公司); Nikon Ti-S 显微镜(日本Nikon 公司); Alpha View 凝胶成像仪(美国ProteinSimple 公司)。
2 方法
2.1 糖尿病小鼠模型制备 采用高脂饲料喂养及STZ 腹腔注射的方式诱导建立糖尿病小鼠模型。小鼠用高脂饲料喂养5 周,禁食不禁水12 h,连续5 d 每天腹腔注射40 mg/kg STZ (用0.1 mmol/L 柠檬酸缓冲液溶解,现用现配,配制后0.5 h 内用完),结束腹腔注射后7 d 测定空腹血糖( fasting blood glucose,FBG ),当小鼠 FBG 大于11.1 mmol/L 时判定糖尿病模型建立成功[11],此时可观察到小鼠摄食、饮水量增多。
2.2 分组与给药 将成功建立糖尿病模型且无病重迹象的小鼠分为模型组,金丝桃苷低、高剂量组,自噬激活组,每组8 只。另取同期喂养普通饲料、腹腔注射等体积0.1 mmol/L 柠檬酸缓冲液的8 只小鼠为对照组。金丝桃苷低、高剂量组小鼠分别灌胃给予25、100 mg/kg 金丝桃苷[12],自噬激活组小鼠灌胃给予100 mg/kg 金丝桃苷和1 mg/kg 雷帕霉素,对照组、模型组小鼠灌胃等体积生理盐水,每天1 次,连续28 d。
2.3 小鼠体质量、FBG、FINS 测定及胰岛素抵抗指数(HOMA-IR) 计算 给药结束后,小鼠空腹12 h,称定体质量。尾静脉取血1 mL,在4 ℃下离心15 min,留取血清,-80 ℃保存备用。使用血糖仪测量FBG 水平,使用ELISA法测定FINS 水平,计算HOMA-IR,公式为HOMA-IR =(FBG×FINS) /22.5。
2.4 HE 染色检测小鼠肝组织病理变化 小鼠断颈处死,摘取肝脏,部分用4%甲醛固定,其余部分于-80 ℃冷冻保存,用于Western Blot 检测。将4%甲醛固定的肝组织样本经石蜡包埋后切片(3 μm),切片脱蜡、水化后进行HE 染色,封片,于显微镜下观察肝组织病理形态变化。
2.5 免疫组化染色检测肝组织Beclin 1 阳性细胞比例 小鼠肝组织切片常规脱蜡至水,室温下加0.2% Triton X-100孵育10 min,3% H2O2溶液孵育10 min,放入枸橼酸钠缓冲溶液中,微波炉加热修复,常温冷却并用5%脱脂奶粉溶液孵育30 min,在4 ℃下加入兔抗Beclin 1 孵育过夜,室温下加入羊抗兔IgG 孵育30 min,滴加SABC 反应20 min,经DAB 显色、苏木精衬染,封片,显微镜下观察5 个视野的Beclin 1 阳性细胞并计数,计算Beclin 1 阳性细胞比例。
2.6 Western blot 法检测小鼠肝组织AMPK/SIRT1 通路、自噬及凋亡相关蛋白表达 取冷冻保存的肝组织,于冰上加RIPA 裂解液(含有蛋白酶抑制剂) 研磨裂解,提取总蛋白,测定蛋白浓度。取10 μg 总蛋白沸水浴变性后上样,聚丙烯酰胺凝胶电泳,将目的蛋白转膜至PVDF 膜,用5%脱脂奶粉溶液封闭2 h,加入一抗(兔抗p-AMPK、兔抗AMPK、兔抗SIRT1、兔抗LC3、兔抗p62、兔抗Bax、兔抗caspase-6、兔抗GAPDH) 4 ℃下孵育过夜,加入二抗(山羊抗兔IgG) 37 ℃孵育1 min,用ECL 化学发光液显影,凝胶成像仪扫描成像,Image J 图像分析软件分析蛋白条带灰度值。
2.7 统计学分析 通过SPSS 21.0 软件进行处理,数据以(±s) 表示,多组间比较采用单因素方差分析,进一步组间两两差异比较采用SNK-q检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 金丝桃苷对糖尿病小鼠体质量、FBG、FINS 水平及HOMA-IR 的影响 与对照组比较,模型组小鼠体质量降低(P<0.05),FBG、FINS 水平及HOMA-IR 升高(P<0.05);与模型组比较,金丝桃苷各剂量组小鼠体质量升高(P<0.05),FBG、FINS 水平及HOMA-IR 降低(P<0.05),且高剂量组效果更佳; 与金丝桃苷高剂量组比较,自噬激活组小鼠体质量降低(P<0.05),FBG、FINS 水平及HOMAIR 均升高(P<0.05),见表1。
表1 各组小鼠体质量、FBG、FINS 水平及HOMA-IR 比较(±s,n=8)

表1 各组小鼠体质量、FBG、FINS 水平及HOMA-IR 比较(±s,n=8)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与金丝桃苷高剂量组比较,▲P<0.05。
组别体质量/gFBG/(mmol·L-1)FINS/(ng·mL-1)HOMA-IR对照组31.85±1.127.86±0.433.77±0.381.32±0.25模型组26.89±1.25*25.67±4.22*11.14±1.04*12.73±1.14*金丝桃苷低剂量组28.46±0.95#19.36±2.84#8.80±0.76#7.56±0.95#金丝桃苷高剂量组30.04±1.03#14.15±2.68#7.26±0.79#4.58±0.73#自噬激活组26.56±0.87▲24.43±3.52▲10.58±0.93▲11.50±1.18▲
3.2 金丝桃苷对糖尿病小鼠肝组织病理形态的影响 对照组小鼠肝组织中细胞形态正常、边界清晰、排列整齐; 模型组小鼠肝组织中细胞形态不规则、结构不完整(黑箭头),伴有空泡、水肿、坏死现象(红箭头); 金丝桃苷各剂量组小鼠肝组织病理损伤减轻,肝细胞结构相对完整;与金丝桃苷高剂量组比较,自噬激活组小鼠肝组织病理损伤加重,见图1。
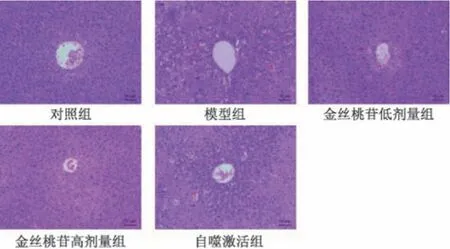
图1 各组小鼠肝组织HE 染色(×200)
3.3 金丝桃苷对糖尿病小鼠肝组织中Beclin 1 阳性细胞比例的影响 与对照组比较,模型组小鼠肝组织Beclin 1 阳性细胞比例升高(P<0.05); 与模型组比较,金丝桃苷各剂量组小鼠肝组织Beclin 1 阳性细胞比例降低(P<0.05),且高剂量组效果更佳; 与金丝桃苷高剂量组比较,自噬激活组小鼠肝组织Beclin 1 阳性细胞比例升高(P<0.05),见图2、表2。

图2 各组小鼠肝组织Beclin 1 蛋白免疫组化染色(×200)
表2 各组小鼠肝组织Beclin 1 阳性细胞比例比较(%,±s,n=8)

表2 各组小鼠肝组织Beclin 1 阳性细胞比例比较(%,±s,n=8)
注: 与对照组比较,*P<0.05; 与模型组比较,#P<0.05; 与金丝桃苷高剂量组比较,▲P<0.05。
组别Beclin 1 阳性细胞比例对照组6.63±1.12模型组35.36±2.78*金丝桃苷低剂量组18.54±1.97#金丝桃苷高剂量组12.05±1.59#自噬激活组22.78±2.06▲
3.4 金丝桃苷对糖尿病小鼠肝组织AMPK/SIRT1 通路及自噬、凋亡相关蛋白表达的影响 与对照组比较,模型组小鼠肝组织p-AMPK/AMPK、SIRT1、LC3-Ⅱ/LC3-Ⅰ、Bax、caspase-6 蛋白表达升高 (P<0.05),p62 蛋白表达降低(P<0.05); 与模型组比较,金丝桃苷各剂量组小鼠肝组织p-AMPK/AMPK、SIRT1、LC3-Ⅱ/LC3-Ⅰ、Bax、caspase-6蛋白表达降低(P<0.05),p62 蛋白表达升高(P<0.05),且高剂量组效果更佳; 与金丝桃苷高剂量组比较,自噬激活组小鼠肝组织p-AMPK/AMPK、SIRT1、LC3-Ⅱ/LC3-Ⅰ、Bax、caspase-6 蛋白表达均升高(P<0.05),p62 蛋白表达降低(P<0.05),见图3。

图3 各组小鼠肝组织AMPK/SIRT1 通路及自噬、凋亡相关蛋白表达变化(±s,n=8)
4 讨论
近年来,糖尿病在全球20~79 岁成人群体中患病率已达7.3%,预计2045 年将达8.3%[13]。改善胰岛素抵抗可控制糖尿病患者血糖水平,减少并发症发生,改善预后,但目前部分患者服用临床常用药物无法改善胰岛素抵抗状态[14-15]。因而,寻找能改善胰岛素抵抗状态的新药物具有重要价值。本研究建立糖尿病小鼠模型后,可见小鼠体质量降低,FBG、FINS 水平及HOMA-IR 升高,表明造模成功,小鼠存在胰岛素抵抗。肝脏在血糖稳态调节中发挥关键作用,其异常与胰岛素抵抗相关。本研究发现,糖尿病小鼠肝组织中细胞形态、结构异常,肝组织Bax、caspase-6表达升高,表明小鼠体内高血糖状态会影响凋亡蛋白表达,导致肝细胞凋亡,损伤肝组织,进而促进胰岛素抵抗发生。
金丝桃苷具有抗炎、降脂等多种生理活性,是治疗2型糖尿病的中药方剂益气滋阴饮中活性较高的小分子化合物[16-17]。研究表明,金丝桃苷能调控前脂肪细胞的糖脂代谢,改善糖尿病小鼠糖脂代谢及心肌损伤,减轻胰岛素抵抗[18-19]。本研究结果显示,金丝桃苷可降低糖尿病小鼠FBG、FINS 水平及HOMA-IR,提高体质量,改善肝脏凋亡蛋白表达及组织病变,表明金丝桃苷可调控糖代谢,减轻肝组织损伤,改善胰岛素抵抗状态。
自噬激活与细胞凋亡关系密切。本研究发现,模型组小鼠肝组织Beclin 1 阳性细胞比例及LC3-Ⅱ/LC3-Ⅰ蛋白表达升高,p62 蛋白表达降低,表明糖尿病小鼠肝组织中自噬蛋白LC3 转化及自噬下游p62 降解顺利,自噬流通畅,肝组织中自噬反应增强。研究表明,金丝桃苷减轻H9c2 心肌细胞缺血再灌注损伤的机制与降低自噬有关[9],而AMPK/SIRT1 是自噬反应发生的上游通路,AMPK 磷酸化后激活SIRT1 可启动自噬反应[20]。本研究显示,金丝桃苷可降低糖尿病小鼠肝组织Beclin 1 阳性细胞比例、LC3-Ⅱ/LC3-Ⅰ蛋白及AMPK/SIRT1 通路激活水平,提高p62 蛋白表达,表明金丝桃苷降低自噬水平可能是改善糖尿病小鼠胰岛素抵抗状态的相关机制。此外,本研究发现自噬激活剂雷帕霉素可减轻金丝桃苷对AMPK/SIRT1 通路激活的降低作用,小鼠肝脏自噬及凋亡水平升高,肝组织病变及胰岛素抵抗状态加重,小鼠体质量降低,表明金丝桃苷改善糖尿病小鼠胰岛素抵抗状态的作用机制可能与抑制AMPK/SIRT1 通路介导的自噬途径有关。
综上所述,金丝桃苷能改善糖尿病小鼠的胰岛素抵抗及高血糖状态,其机制可能与抑制AMPK/SIRT1 通路介导的自噬,减轻肝脏损伤状况有关。但金丝桃苷是否还通过其他通路发挥作用,后续将设置不同浓度梯度及阳性药物组进行完善,探究其潜在机制。

