桑寄生种子高产木质纤维素降解酶内生真菌的筛选与鉴定
宋利沙,万凌云,韦树根,潘丽梅,霍 娟,付金娥,蒋 妮
(广西壮族自治区药用植物园/广西卫生健康委员会重点实验室,南宁 530023)
【研究意义】桑寄生为桑寄生科钝果寄生属[Taxilluschinensis(DC.)Danser]植物,其干燥茎叶是常用的大宗中药材,具有祛风湿、补肝肾、强筋骨和安胎元等功效,为《中国药典》(2020 版)收载品种之一[1]。桑寄生作为寄生植物,具有独特的生活方式,其果实为浆果,鸟类摄食消化果肉后排出的桑寄生种子附着在寄主植物枝条上[2],在寄主植物表面萌发后其吸器侵入寄主表皮并伸长至寄主植物维管系统形成“生理桥”,从寄主植物体内获取营养和水分,最终实现寄生。野外调查发现,鸟类摄食排出并附着在寄主植物上的桑寄生种子中仅有一半能寄生成功,桑寄生种子实现寄生极其复杂且困难[3]。广西壮族自治区药用植物园桑寄生课题组前期研究发现,桑寄生种子具有丰富的内生真菌,但有关桑寄生种子内生真菌对桑寄生种子萌发的意义尚不清楚。因此,探索桑寄生种子内生真菌对桑寄生种子萌发和寄生的作用,对开展桑寄生侵入寄主细胞壁降解作用机制研究及实现桑寄生人工栽培具有重要意义。【前人研究进展】已有较多研究报道真菌可降解寄主植物细胞壁从而侵入寄主,可为开展桑寄生内生真菌降解桑寄生寄主细胞壁的作用研究提供借鉴[4-6]。植物细胞壁的主要成分为木质素和纤维素,有关真菌对木质素和纤维素降解作用方面的研究已有报道[6-7],但主要为虫拟蜡菌(Ceriporiopsissubvermispora)、白腐真菌黄孢原毛平革菌(Phanerochaetechrysosporium)和鲑色波斯特孔菌(Postiaplacenta)等模式木腐菌[8-9]。白腐真菌被认为是降解木质素最有效、最主要的真菌,其在长期进化过程中形成了一套木质素降解酶系统,包括锰过氧化物酶、漆酶和木质素过氧化物酶等[10],这些酶均能降解植物细胞壁的木质素、纤维素和半纤维素等成分[11]。有研究发现,微生物(真菌、细菌和放线菌)在纤维素材料降解中发挥着关键作用,可产生多种水解酶,包括纤维素酶、蛋白酶和木聚糖酶等,且微生物活动可提供有关有机物分解过程的有用信息[7]。Chen等[12]基于Tulasnellasp.和Serendipitasp.两种真菌接种同一寄主植物铁皮石斛(Dendrobiumofficinale),并对3个发育阶段进行转录组比较分析,结果发现编码寄主植物细胞壁重要结构蛋白的差异表达基因(DEGs)在共生萌发期尤其在原球茎期能显著上调,说明这些基因可能与铁皮石斛种子共生萌发过程中降低植物免疫反应、真菌成功定植或识别菌根真菌存在密切关系。徐安民等[13]、Erikssonke等[14]研究认为,产漆酶的菌株在以愈创木酚为指示剂选择培养基上长出的菌丝能产生明显红褐色,具有降解木质素能力。熊乙[15]将刚果红和苯胺蓝染色剂加入培养基,通过产生水解圈判断其降解木质纤维素的能力,并通过复筛得到6株功能菌。【本研究切入点】广西壮族自治区药用植物园桑寄生课题组前期研究发现,桑寄生吸器根可产生一系列细胞壁降解酶[16-17],但其种子内生真菌是否也产生这些细胞壁降解酶,目前未见相关研究报道。【拟解决的关键问题】从不同培养时间桑寄生种子中分离内生真菌,分别在愈创木酚固体培养基和纤维素固体培养基上筛选出产生显色圈和透明圈的菌株,测定其漆酶、木质素过氧化物酶、锰过氧化物酶和纤维素酶活性,筛选出桑寄生种子高产木质纤维素降解酶内生真菌菌株,并根据菌株的形态特征和分子生物学方法确定其分类地位,为开展桑寄生侵入寄主细胞壁降解作用机制研究及实现桑寄生人工栽培提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 桑寄生种子样品采集 2020年1月,在广西南宁市广西壮族自治区药用植物园桑寄生种植基地桑树上采集桑寄生成熟种子,带回实验室去除果皮和果胶,选取健康、大小、成熟度一致的种子,在直径15 cm、垫有无菌滤纸的培养皿中培养,每5 d取1次样,20 d内共取样4次。
1.1.2 底物处理 用于发酵木质纤维生物物质底物的小麦麸皮购自河南中鹤现代农业开发集团,参考陶颜娟[18]的方法(略有改动)进行前处理。将小麦麸皮粉碎过40目筛,加入10倍体积蒸馏水,混合研磨25.0 min。用150目筛过滤,沉淀部分于60 ℃烘箱干燥24 h。加入10倍体积蒸馏水于95 ℃下加热30.0 min,调节pH至5.6,加入1.5%(w/w)α-淀粉酶,于95 ℃搅拌反应30.0 min,用碘液检测是否反应完全。降温至50 ℃,调节pH至9.0,加入3.0%(w/w)碱性蛋白酶,搅拌2 h,弃上清,用150目筛于清水中过滤冲洗直至洗涤液不浑浊,将剩余固体物质于60 ℃烘箱干燥24 h。将干燥得到的麸皮用微型粉碎机粉碎,过100目筛,50 ℃恒温烘箱烘干,过夜备用。
1.1.3 培养基配制 参考徐安民等[13]的方法配制PDA培养基、种子液体培养基、愈创木酚固体培养基和液体发酵基础培养基。
PDA培养基:马铃薯200.00 g/L,葡萄糖20.00 g/L,琼脂20.00 g/L,pH自然,1×105Pa灭菌30.0 min。
种子液体培养基:葡萄糖20.00 g/L,酵母膏2.00 g/L,KH2PO43.00 g/L,MgSO4·7H2O 1.50 g/L,VB10.50 g/L,pH自然,1×105Pa灭菌30.0 min。
愈创木酚固体培养基:马铃薯200.00 g/L,葡萄糖20.00 g/L,琼脂20.00 g/L,KH2PO43.00 g/L,MgSO4·7H2O 1.50 g/L,VB10.02 g/L,愈创木酚1.00 g/L,pH自然,1×105Pa灭菌30.0 min。
液体发酵基础培养基:选取1.1.2处理过的麦麸30.00 g/L,KH2PO43.00 g/L,MgSO4·7H2O 1.50 g/L,(NH4)2SO41.40 g,CaCl20.30 g,FeSO4·7H2O 5.00 mg/L,MnSO4·H2O 1.60 mg/L,VB10.02 g/L,pH自然,分装至250 mL三角瓶中,每瓶100.00 mL,1×105Pa灭菌30.0 min。
参考Kim等[19]的方法配制纤维素固体培养基(刚果红染色培养基):羧甲基纤维素钠5.00 g/L,酵母膏0.50 g/L,蛋白胨0.50 g/L,牛肉膏0.30 g/L,KH2PO43.00 g/L,K2HPO45.00 g/L,(NH4)2SO42.00 g/L,MgSO40.40 g/L,CaCl20.10 g/L,微量元素溶液1.00 mL,琼脂粉20.00 g/L,0.50 g刚果红粉末溶于50.00 mL无菌水中。
1.2 试验方法
1.2.1 内生真菌分离与纯化 选取健康饱满的桑寄生种子,依次用75%乙醇表面消毒30 s和2.50%次氯酸钠溶液表面消毒2.5 min,无菌水洗3次;用无菌镊子和手术刀将其切成约5.0 mm大小组织块,置于PDA(含有链霉素)平板上,每平皿5个组织块,每样品3个平皿,28 ℃培养,待组织块边缘长出菌丝,再转接至PDA平板上培养、纯化并保存。参考朱宏建等[20]的方法,采用超净工作台无菌检测法、漂洗液无菌检测法和组织印迹无菌检测法检测表面消毒是否彻底,以确保种子内生真菌准确分离。
1.2.2 木质纤维素降解酶(漆酶、木质素过氧化物酶、锰过氧化物酶和纤维素酶)菌株筛选 木质素降解酶菌株初筛:以0.1%愈创木酚加入PDA培养基中做成平板[21],在超净工作台上挑取纯化后直径为6.00 mm的内生真菌组织块于平板上,每株菌株3个重复,于恒温培养箱28 ℃培养11 d。观察显色圈和透明圈产生情况并测量其直径,记录菌落颜色。菌落圈直径(J)与显色圈或透明圈直径(X)的比(J/X)小于1.00表示菌株能选择性降解木质素(主要通过木质素过氧化物酶、漆酶和锰过氧化物酶来完成)。
纤维素降解酶菌株初筛:采用透明圈法,配置纤维素固体培养基后,接种经纯化菌株的组织块(直径6.00 mm),每组3次重复,28 ℃恒温培养11 d,用0.1%刚果红染色15.0 min,然后用1.00 mol/L NaCl脱色15.0 min,观察统计菌落透明圈大小(菌落透明圈直径=透明圈直径-菌落直径),透明圈直径扩大,说明产纤维素酶活性增加[13]。
将有显色圈和透明圈的木质纤维素降解酶菌株按照1.2.2方法进行复筛。
1.2.3 酶液制备 选取有显色圈和透明圈的木质纤维素降解酶菌株培养5~7 d,分别定量接种,吸取摇匀的种子液10.00 mL加入装有100.00 mL液体发酵培养基的250 mL三角瓶中,每株菌株接种2瓶,每瓶接5个直径为6.00 mm的菌饼,于26 ℃下140 r/min恒温摇床中培养11 d。菌种液体培养从第4天开始取样,每隔1 d取样1次,发酵液用4层纱布过滤,滤液在3000 r/min条件下离心15.0 min,上清液即为粗酶液[16]。
1.2.4 酶活性测定 漆酶、木质素过氧化物酶和锰过氧化物酶活性分别采用ABTS法、苯酚红法和藜芦醛法进行测定[13],纤维素酶活性采用3,5-二硝基水杨酸(DNS)法测定[22]。
1.2.5 内生真菌鉴定 参考方中达[23]的方法记录菌落形态,参考国际分类网站(http://www.indexfungorum.org)进行菌落形态初步鉴定。参考Kumar等[24]的方法,利用MEGA 7.0的邻位连接法联合构建ITS rDNA(ITS1 5′-TCCGTAGGTGAACCTGCGG-3′和ITS4 5′-TCCTCCGCTTATTGATATGC-3′)系统发育进化树,进行分子生物学鉴定;采用MightyAmp DNA Polymerase Ver.3(1.25 U/50 μL)试剂盒(Takara Bio Inc.,Japan,cat. no. R076A),挑取内生真菌的菌丝作为模板直接用于PCR反应,凝胶成像检测后,将有目的条带的PCR产物送至华大基因(广州)股份有限公司测序;测序结果与NCBI公布的GenBank中的序列进行BLAST比对。利用MEGA 7.0的Neighbor-Joining法构建ITS rDNA系统发育进化树。
1.3 统计分析
试验数据采用Excel 2013进行整理,以SPSS 19.0进行单因素ANOVA分析。
2 结果与分析
2.1 内生真菌的分离
从桑寄生不同培养时期的种子中共分离得到内生真菌菌株57株,其中,从培养第5天的桑寄生种子中分离到内生真菌5株,从培养第10天的桑寄生种子中分离到内生真菌24株,从培养第15天的桑寄生种子中分离到内生真菌13株,从培养第20天的桑寄生种子中分离到内生真菌15株。
2.2 木质素降解酶和纤维素降解酶活力平板检测
2.2.1 木质素酶活力检测结果 从图1可看出,产漆酶菌株在愈创木酚固体培养基中产生明显的红褐色菌落。试验观察发现,57株内生真菌在愈创木酚固体培养基上共培养11 d时既无菌落圈也无显色圈产生的菌株有21株,菌落圈直径与显色圈直径比小于1.00的有11株,菌落圈直径与显色圈直径比大于1.00有0株,有显色圈而无菌落圈的菌株有16株,有菌落圈而无显色圈的菌株有9株,说明菌落圈与显色圈直径比小于1.00的菌株能选择性降解木质素(表1)。故采用愈创木酚法从11株菌落圈直径与显色圈直径比小于1.00和有显色圈而无菌落圈的16株菌株中定性筛选出显色圈大且明显的4株内生真菌(15H3、2013、106和10y11),用于后续酶活性测定。

表1 培养11 d时不同菌株的菌落圈直径和显色圈直径比较

A-1、B-1、C-1和D-1分别为菌株15H3、2013、106和10y11红褐色菌落的背面。A-1,B-1,C-1 and D-1 are the backs of the reddish brown colonies of strains 15H3,2013,106 and 10y11,respectively.图1 4株桑寄生种子内生真菌菌株在愈创木酚固体培养基中的生长情况(培养第7天)Fig.1 Growth of 4 strains of endophytic fungi from seeds of T. chinensis on guaiacol solid medium(7 days of culture)
由表2可知,随着培养时间的延长,4株桑寄生种子内生真菌菌株的菌落圈和显色圈也在增长,在培养至第11天时均不再增长,其中,在培养第7天时,4株菌株的显色圈直径间差异显著(P<0.05,下同),表现为菌株106>菌株10y11>菌株2013>菌株15H3。图1为4株桑寄生种子内生真菌菌株在愈创木酚固体培养基中培养第7天时的生长情况。
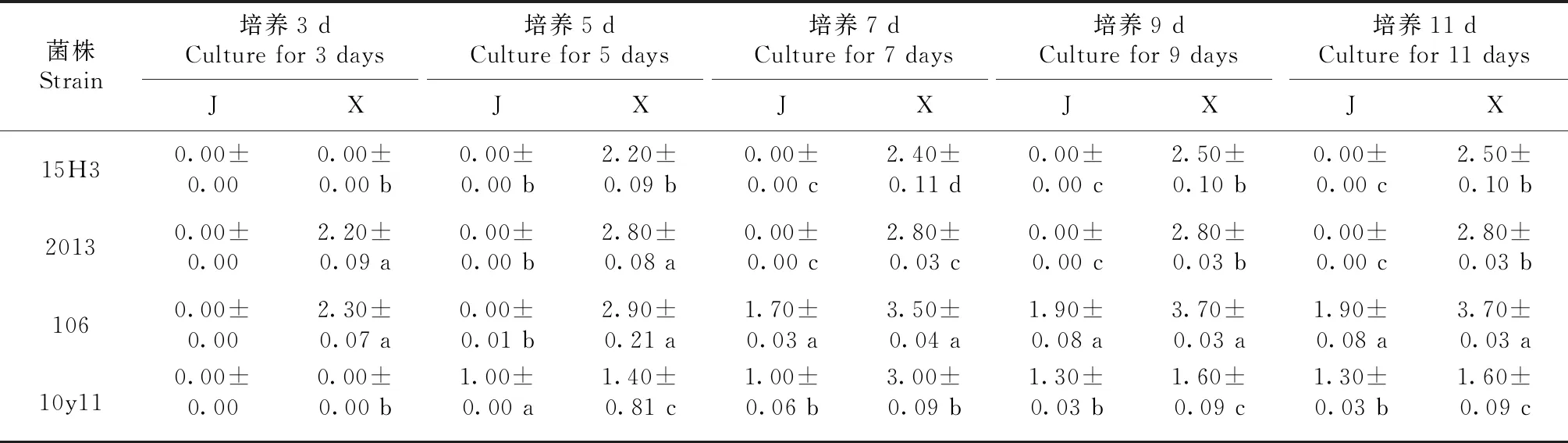
表2 不同培养时间4株内生真菌菌株的菌落圈直径和显色圈直径变化情况
2.2.2 纤维素降解酶活力检测 将57株内生真菌菌株在纤维素固体培养基中培养3、5、7、9和11 d,其中,培养第7天时观察发现,有14株内生真菌有菌落圈而无透明圈,有43株内生真菌的菌落圈直径与透明圈直径比值小于1.00(表3),无菌落圈直径与透明圈直径比值大于1.00的菌株。从菌落圈直径与透明圈直径比值小于1.00的菌株中选出显色圈大且明显的菌株(15H3、2013、106和10y11)进行酶活试验(图2),结果(表4)表明,4株菌株的直径均随着培养时间的延长逐渐变大,培养9 d后不再发生变化,其中,在培养第7天时,4株菌株的透明圈直径间差异显著,表现为菌株106>菌株10y11>菌株15H3>菌株2013。由图2可知,透明圈大小与纤维素酶活性高低存在一定的相关性,但培养到一定时间后透明圈不再增长。
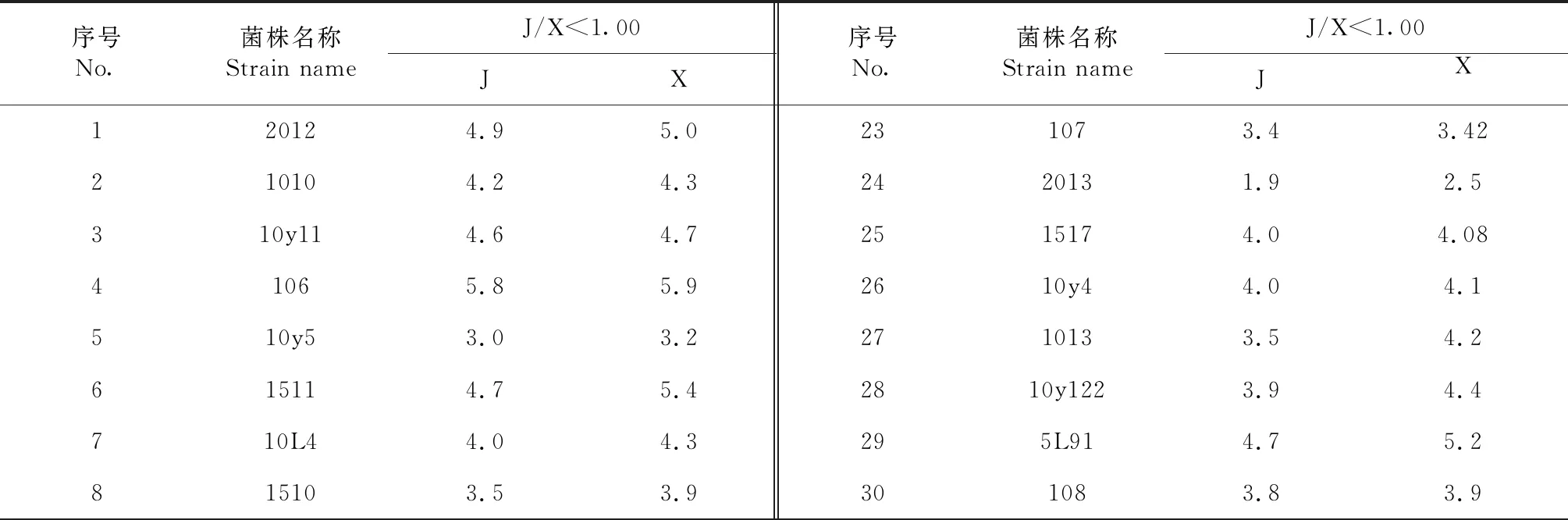
表3 培养7 d时不同菌株的菌落圈直径和透明圈直径比较
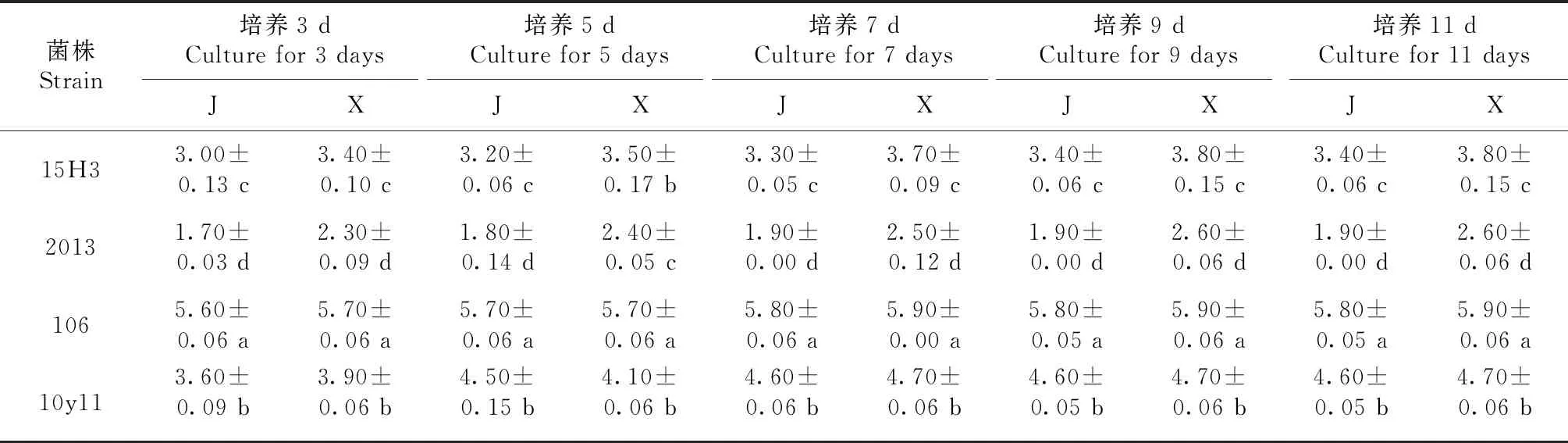
表4 不同培养时间4株内生真菌菌株的菌落圈和透明圈直径变化情况(cm)
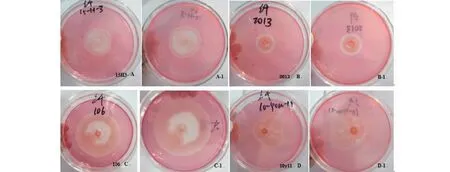
图2 4株桑寄生种子内生真菌菌株在纤维素固体培养基中的生长情况(培养第7天)Fig.2 Growth of 4 strains of endophytic fungi from seeds of T. chinensis on cellulose solid culture-medium(7 days of culture)
2.3 木质素降解酶活性分析
2.3.1 漆酶活性测定 由表5可知,4株菌株产漆酶的高峰时间均在培养第9天,此后开始下降;在产漆酶高峰,菌株106的漆酶活性最高,为57.98 U/mL,其次依次为菌株15H3、10y11和2013,酶活性分别为34.93、4.13和0.39 U/mL,四者间差异显著;4株菌株的漆酶活性在整个培养时期表现为菌株106>菌株15H3>菌株10y11>菌株2013。

表5 不同培养时间4株内生真菌菌株的漆酶活性比较
2.3.2 锰过氧化物酶活性测定 由表6可知,菌株106和10y11的锰过氧化物酶活性均随着培养时间的延长而提高,在培养第9天出现最高值,分别为7.81和8.56 U/mL,而菌株15H3和2013的锰过氧化物酶活性均随着培养时间的延长一直在提高,在培养的第11天达最高值,酶活性分别为5.74和11.69 U/mL;4株菌株的锰过氧化物酶活性在培养第9天时表现为菌株2013>菌株10y11>菌株106>菌株15H3,4者间差异显著。
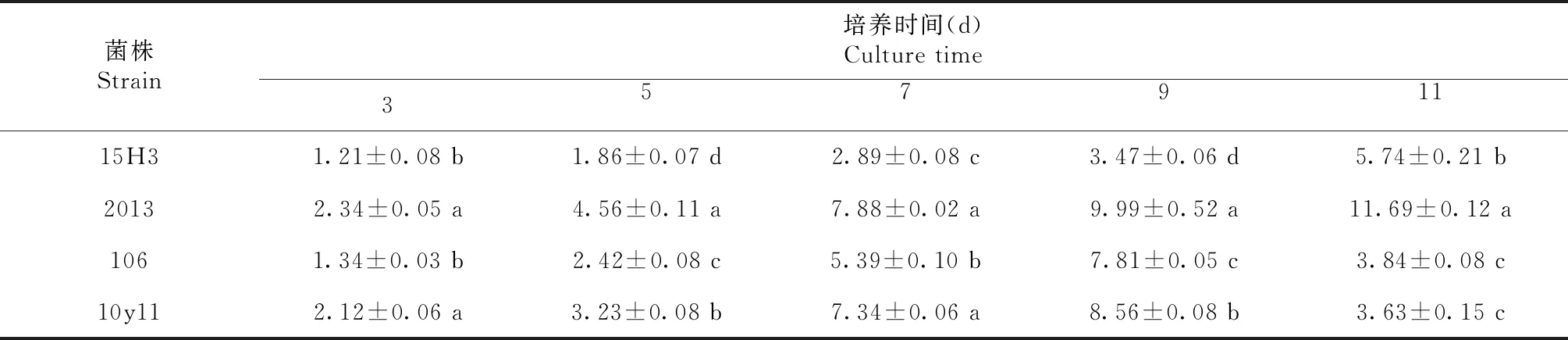
表6 不同培养时间4株内生真菌菌株的锰过氧化物酶活性比较
2.3.3 木质素过氧化物酶活性测定 由表7可知,菌株2013、106和10y11的木质素过氧化物酶活性均随着培养时间的推移逐渐升高,最高值均出现在培养第9天,分别为4.86、1.50和2.86 U/mL,此后开始下降;菌株15H3的木质素过氧化物酶活性一直升高,最高值出现在培养第11天,为7.14 U/mL;4株菌株的木质素过氧化物酶活性在培养第9天时表现为菌株15H3>菌株2013>菌株10y11>菌株106,其中,菌株15H3的木质素过氧化物酶活性与菌株2013差异不显著(P>0.05,下同),但二者均显著高于菌株10y11和106。

表7 不同培养时间4株内生真菌菌株的木质素过氧化物酶活性比较
2.4 纤维素酶活性分析
由表8可知,菌株2013、10y11和15H3的纤维素酶活性最高值均出现在培养第9天,分别为0.32、0.12和0.25 U/mL,此后菌株2013的纤维素酶活性开始下降,菌株10y11和15H3的纤维素酶活性保持不变,而菌株106的纤维素酶活性在整个培养时期一直提高;4株菌株的纤维素酶活性在培养第9天表现为菌株2013>菌株15H3>菌株10y11>菌株106,其中,菌株15H3和2013的纤维素酶活性显著高于菌株106和10y11,而菌株106与10y11无显著差异。

表8 不同培养时间4株内生真菌菌株的纤维素酶活性比较
2.5 菌株鉴定结果
以ITS rDNA序列构建4株菌株的系统发育进化树,结果(图3)显示,菌株15H3和2013分别与拟盘多毛孢属(Pestalotiopsisarceuthobii,CBS MH85 8656)和垫壳孢属(Coniellapseudogranati,CBS KJ86913)聚在同一分支,菌株106和10y11与Fusariumincarnatum(CBS MH866002/CBS MH865897)(镰孢属)聚在同一分支,相似度达99%~100%。因此,分别将15H3和2013鉴定为拟盘多孢属和垫壳孢属,将菌株106和10y11鉴定为镰孢属。将4株菌株序列分别提交至GenBank数据库,获得登录号分别为ON025793、ON025792、ON02579和ON025794。

图3 基于ITS rDNA序列构建的4株桑寄生种子内生真菌菌株系统发育进化树Fig.3 Phylogenetic tree of of 4 strains of endophytic fungi from seeds of T. chinensis based on ITS rDNA sequence
3 讨 论
本研究选取麦麸作为57株桑寄生种子内生真菌培养的木质纤维生物物质底物,在培养3、5、7、9和11 d时分别测定发酵液的木质素降解酶(漆酶、木质素过氧化物酶和锰过氧化物酶)和纤维素降解酶活性,发现有4株菌株(15H3、2013、106和10y11)的酶活性均在培养第9天急剧提高,其中菌株15H3的漆酶和纤维素酶活性分别达34.93和0.25 U/mL,经形态观察和分子生物学鉴定,该菌株为拟盘多毛孢属真菌,与郝杰杰等[25]的研究结果一致。由于漆酶可用于燃料脱色和燃料降解[26],因此,菌株15H3发酵液提取液的颜色明显浅于另外3株菌株的发酵液提取液,表明其漆酶活性较高,且高于曹永佳等[27]报道的拟盘多毛孢属2个白腐真菌,说明拟盘多孢属真菌是一株较有效的产漆酶半知菌。此外,菌株106也产生具有很高活性(57.98 U/mL)的漆酶,该菌株鉴定为镰孢属菌株,但目前未见关于该菌能产漆酶的报道。
菌株15H3、2013和106的锰过氧化物酶、木质素过氧化物酶和纤维素酶活性最高峰均出现在培养第9天,与池玉杰和伊洪伟[28]报道的白腐菌木质素酶和纤维素酶活性变化规律一致。经形态和分子生物学鉴定,菌株15H3、2013和106分别为拟盘多孢属、垫壳孢属和镰孢属菌株,这是首次报道3种真菌以麦麸质纤维生物物质为底物产生木质纤维素降解酶。前人曾报道有6种半知菌类真菌(Alternariasp.、Penicilliumsp.、Cephalosporiumsp.、Tricherdermasp.、Pestalotiopsissp.和Aspergillusfumigatus)降解马尾松凋落叶片可产木质纤维素酶(漆酶、锰过氧化物酶、木质素过氧化物酶和纤维素酶)[26],但除拟盘多毛孢属真菌外,本研究的其他真菌与该6种半知菌类真菌不同属。
木质纤维素的降解是几种酶共同作用的结果,主要通过漆酶、木质素过氧化物酶和锰过氧化物酶完成[29],且酶活性高低与显色圈大小有着必然联系,但不是线性正相关关系[30];纤维素降解酶主要是内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶,将纤维素彻底水解为单糖需要这3种酶的协同作用[31]。本研究筛选并鉴定获得4株具有较高木质纤维素降解能力的桑寄生种子内生真菌菌株,因其产生的木质纤维素酶(漆酶、木质素过氧化物酶、锰过氧化物酶和纤维素酶)极有可能突破寄主表皮细胞的细胞壁,从而成功寄生在寄主体内,这为桑寄生侵入寄主植物细胞壁降解作用机制研究提供了理论依据。本研究后续仍需以桑寄生寄主桑树的树皮为木质纤维生物物质底物,来测定这些酶的活性及产木质纤维素降解酶的降解速率,并考虑利用不同固体培养基优化、延长发酵周期和添加吐温80、阿魏酸、Cu2+或二甲代苯胺等诱导因子提高菌株木质素纤维素降解酶的活性,以剖析桑寄生内生真菌对寄主细胞壁降解的作用机制,进而为桑寄生的繁育提供理论依据和应用指导。
4 结 论
从桑寄生种子中能分离、筛选出15H3、2013、106和10y11共4株高产木质纤维素降解酶菌株,其中,菌株15H3和2013分别鉴定为拟盘多孢属和垫壳孢属,菌株106和10y11鉴定为镰孢属,可为桑寄生侵入寄主细胞壁降解作用机制研究打下基础,为桑寄生的繁育提供参考依据。

