玉米黄酒发酵过程中微生物菌群结构与挥发性风味物质的相关性分析
郭建华,赵晓旭,蒋海娇
(齐齐哈尔大学 食品与生物工程学院,黑龙江 齐齐哈尔 161006)
中国黄酒是以谷物为原料,利用酒曲作为糖化发酵剂酿造而成的发酵酒。酒曲中含有多种微生物,包括酵母菌、霉菌和细菌[1-2]。黄酒的风味特点取决于多种微生物共同作用产生的风味物质,包括酯、高级醇、脂肪酸、醛、酚等[3]。对黄酒发酵微生物进行群落分析发现,优势细菌菌群多为芽孢杆菌属、糖多孢菌属、葡萄球菌属、肠杆菌属[4-6],而优势真菌菌群为曲霉属[7]。唐鳗秋等[8]研究表明,黄酒发酵过程中葡萄球菌属、肠杆菌属、Kosakonia为发酵前期的主要细菌菌属,发酵第5天时细菌菌群多样性最高。刘芸雅等[4]研究发现,黄酒发酵过程中的微生物组成与酒曲有一定的相关性,在属水平上黄酒发酵液中主要优势细菌包括糖多孢菌属、芽孢杆菌属、葡萄球菌属、高温放线菌属、乳杆菌属等,不同的细菌变化情况呈现多样性,并与发酵条件存在对应关系。
微生物菌群结构对黄酒风味物质的生成具有重要影响。Mou等[9]采用宏基因组学分析了黄酒发酵过程中真菌与风味物质之间的关系,结果表明挥发性风味物质的生成受发酵液性质及微生物多样性的影响很大。Liu等[10]的研究表明,在黄酒发酵过程中,细菌中 10 个主导属具有不同的变化特性,其中芽孢杆菌和乳酸菌是最主要的细菌属,并且形成黄酒中重要的风味化合物[11]。刘芸雅[12]研究表明黄酒发酵过程中芽孢杆菌属与 3种酯类、1 种吡嗪类物质的相关性较强;而乳杆菌属、明串珠菌属和肠杆菌属与有机酸有良好的相关性;假单胞菌属、肠杆菌属分别与 13 种、8 种挥发性成分有较强的相关性。
本文通过研究玉米黄酒发酵过程中微生物菌群结构和挥发性风味物质的变化,利用多元统计方法分析菌群结构与风味物质的相关性,为解释玉米黄酒发酵过程中风味物质的生成特点和筛选优良菌株提供了实验基础。
1 材料和方法
1.1 玉米黄酒发酵工艺
称取一定量洗干净的脱胚玉米(产自黑龙江省齐齐哈尔市)置于0.15%~0.2%的亚硫酸溶液中,55 ℃水浴下浸泡48 h。之后将玉米用清水进行冲洗,沥干后备用。将浸过的脱胚玉米放入蒸锅中,蒸米45 min。将蒸熟的脱胚玉米缓慢降温至35 ℃左右,放入 2 000 mL烧杯中,加入酒曲(0.1%~0.2%,购于广西省),搅拌均匀,用4层纱布封口,置于恒温培养箱(SPX-150Ⅱ,天津市泰斯特仪器有限公司)中,于30 ℃下培养3 d,然后在烧杯内加入玉米质量2倍的水,于25 ℃下发酵30 d。
1.2 16S rDNA/ITS高通量测序
1.2.1 基因组提取
在玉米黄酒发酵第0,6,12,18,24,30天取样,每次取10 mL样品于无菌离心管中,在高速离心机(HERMLE-Z200A,贺默(上海)仪器科技有限公司)中以4 000 r/min离心10 min,上清液用于挥发性风味成分分析,沉淀用于提取基因组高通量分析。
1.2.2 微生物菌群结构检测
对黄酒进行宏基因组提取后,使用带Barcode的引物341F-806R和ITS1F-ITS2R扩增16S V4和ITS不同基因区域[13-14]。PCR扩增条件:步骤一:95 ℃进行5 min;步骤二:95 ℃进行30 s;步骤三:55 ℃进行30 s;步骤四:72 ℃进行45 s;步骤二~步骤四进行27次循环;步骤五:72 ℃进行10 min。PCR扩增体系见表1。
表1 PCR扩增体系Table 1 PCR amplification system
将同一样品的PCR产物进行混合,使用2%琼脂糖凝胶电泳进行检测,PCR产物用AxyPrep DNA凝胶回收试剂盒(Axygen公司)进行凝胶切割回收,纯化好的 DNA 样品于-20 ℃ 保存。将PCR扩增后的产物送交上海美吉公司利用Illumina MiSeq PE300测序平台进行高通量测序。将测定的结果进行优化序列统计,并根据序列相似度水平为97%生成OTU。OTU产生后,统计样品中含有的OTU情况及每个OTU中含有序列的数目,将序列与Silva库对比,得到序列的分类学信息。在此基础上进行样品菌群的丰度指数(Chao 1)、多样性指数(Shannon/Simpson)及覆盖率指数(Coverage)分析。多样性指数分析利用Mothur软件实现[15]。相关性分析利用Simca-P 14.1和SPSS软件实现[16]。根据属分类绘制每种玉米黄酒样品的菌群结构柱状图。
1.3 挥发性风味物质测定
1.3.1 样品处理
挥发性风味物质利用三重串联四极杆气质联用仪(7890B,Agilent Technologies Inc.,USA)。样品处理根据参考文献[17],取0.75 mL样液于10 mL顶空瓶中,加入1 g NaCl、2.25 mL蒸馏水,加盖密封,混合均匀后放入70 ℃水浴锅中平衡40 min,用气密针吸取1 mL瓶内液上气体注入气质色谱仪中进行定性和定量分析,得出样液中挥发性风味物质的含量。
1.3.2 GC/MS分析条件
色谱条件:Agilent HP-5MS色谱柱(30×0.25 mm×0.25 μm),程序升温:初始温度50 ℃,保持2 min,然后以5 ℃/min的速率升到100 ℃,再以10 ℃/min的速度升至240 ℃,保持5 min。进样口温度250 ℃;柱流速1 mL/min;载气He(纯度大于99.999%);不分流进样;进样量1 mL。
质谱条件:电子能量70 eV;离子源温度220 ℃;质量扫描范围35~450 amu;溶剂延迟时间4 min。
1.3.3 定量分析方法
通过质谱库进行定性分析,用峰面积归一化法进行计算,从而得到待测组分百分比含量,公式如下:
式中:Mi为样品中检测组分百分比含量,Ai为检测组分峰面积,A1+A2+A3+…+An为样品中所有检测到组分峰面积之和。
2 结果与讨论
2.1 玉米黄酒发酵过程中微生物菌群结构分析
2.1.1 玉米黄酒发酵过程中细菌菌群分析
在玉米黄酒发酵过程中,分别在第0,6,12,18,24,30天取酒样,进行菌群结构和多样性分析。细菌OTU统计结果及多样性指数见表2。
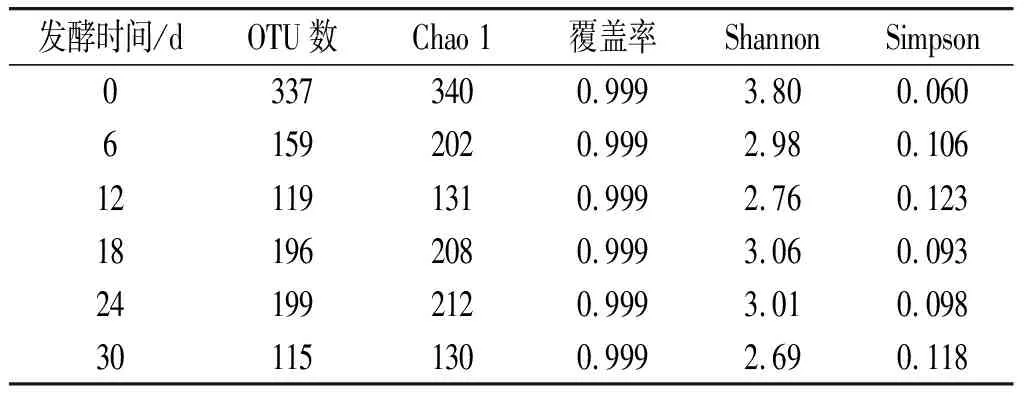
表2 细菌OTU聚类统计及多样性指数表Table 2 Clustering statistics and diversity indexes of bacterial OTU
由表2可知,随着发酵时间的延长,OTU数呈先减少后增多再减少的趋势。发酵第0天时,OTU数最大,说明在发酵初期,细菌的种类组成最丰富。Chao 1在生态学中用来估算样品中物种总数[18]。反映环境体系中微生物多样性多采用Shannon指数和Simpson指数,Simpson指数越大,说明体系中微生物多样性越低,而Shannon指数则正好相反。Chao 1值先减少后增多再减少,Shannon值变化也是如此,说明这一阶段的物种总数变化和多样性也呈此规律,随着时间的延长,在高酸和高乙醇浓度的抑制下,微生物多样性逐渐降低。而Simpson指数的变化也印证了这一规律,第0天指数值为0.06,到第12天则为0.123,第18天降为0.093,第30天升到0.118,测序深度反映了测序的覆盖范围,结果均大于0.999,说明测序深度足够,结果可靠。
利用高通量测序技术,在玉米黄酒发酵过程中共检测到239个细菌属。其中有18个主要细菌属(以下括号内数字为该属的平均丰度),分别为魏斯氏菌属(Weissella,21.28%)、慢生根瘤菌属(Bradyrhizobium,16.80%)、嗜氢菌属(Hydrobacter,10.09%)、糖多孢菌属(Saccharopolyspora,4.90%)、乳杆菌属(Lactobacillus,4.26%)、Chloroplast_norank菌属(3.96%)、乳球菌属(Lactococcus,3.63%)、柠檬酸杆菌属(Citrobacter,3.40%)、Ralstonia菌属(2.76%)、不动杆菌属(Acinetobacter,1.79%)、嗜盐单胞菌属(Halomonas,1.53%)、诺卡氏菌属(Nocardia,1.48%)、假单胞菌属(Pseudomonas,1.43%)、Reyranella菌属(1.43%)、贪铜菌属(Cupriavidus,1.32%)、Pseudolabrys菌属(1.11%)、鞘氨醇单胞菌属(Novosphingobium,0.86%)、Muribaculaceae_norank菌属(0.5%)。其余菌属总平均丰度小于0.5%。在属水平上绘制玉米黄酒中细菌菌群结构柱状图,见图1。
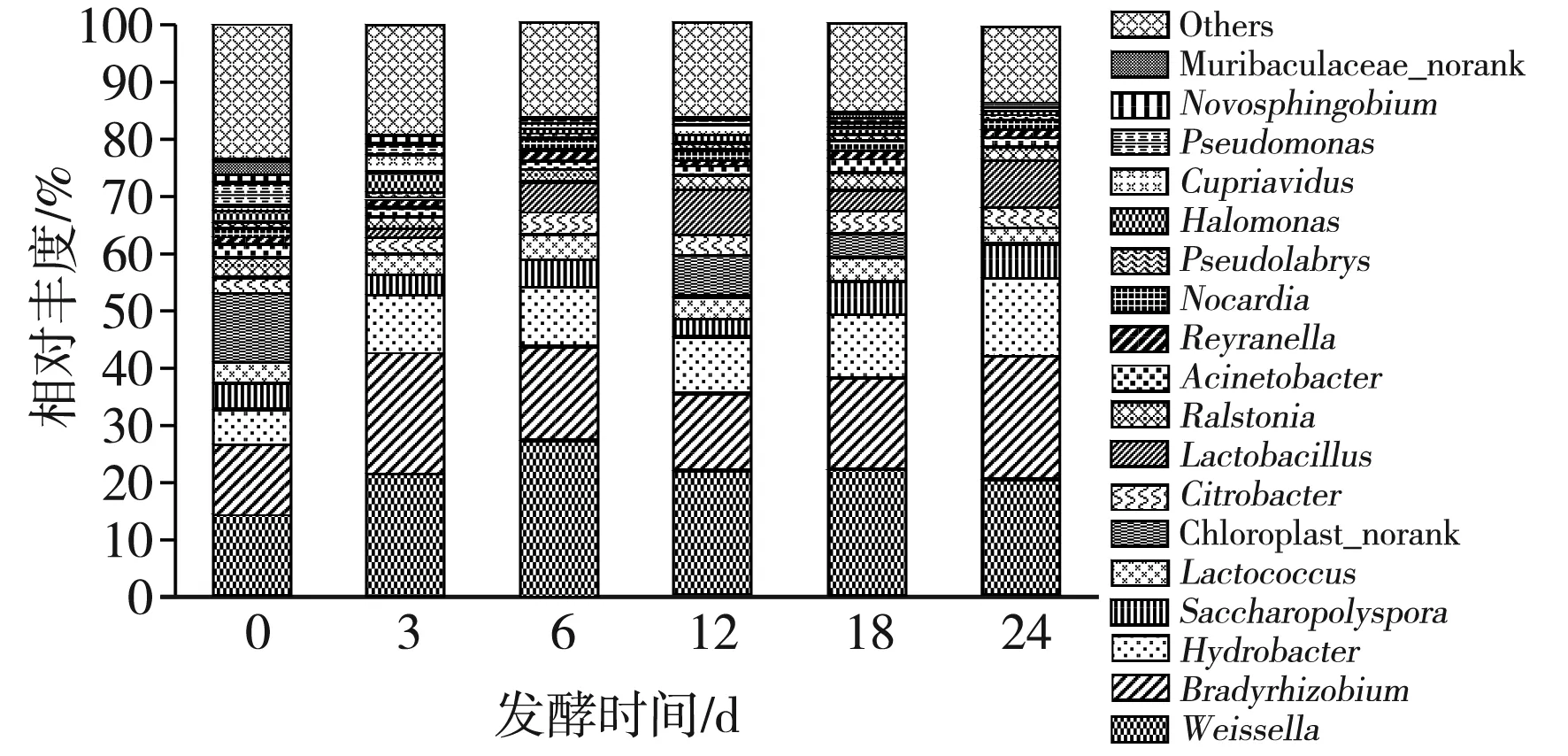
图1 玉米黄酒发酵过程中细菌属水平相对丰度变化Fig.1 Changes of the relative abundance of bacterial genera during the fermentation of corn yellow wine
由图1可知,在玉米黄酒发酵过程中,不同的细菌属呈现出不同且复杂的变化特点。其中慢生根瘤菌属、嗜氢菌属、乳杆菌属、糖多孢菌属呈先升高后下降再升高的趋势,另外乳杆菌属、糖多孢菌属的占比在发酵末期达到峰值8.46%和6.25%。说明这些菌群在发酵初期比较适应发酵体系,到了中期由于酸度和乙醇浓度的提高,一部分不耐酸和乙醇的菌群消亡,另一部分则适应了这种环境继续繁殖。而贪铜菌属、嗜盐单胞菌属、乳球菌属、柠檬酸杆菌属、魏斯氏菌属、Reyranella菌属都随发酵时间的延长呈先上升后下降的趋势,并且都在发酵中期出现相对丰度最大值,分别为2.75%、3.47%、4.41%、4.31%、27.33%、1.54%。这些细菌的生长繁殖大都需要氧气的参与,因此在发酵前期氧气较丰富的情况下,菌属占比快速升高,而到了发酵中期,氧气被消耗形成低氧环境,抑制了占比扩大的趋势。不动杆菌先下降后上升,说明这种菌属有着较强的环境适应能力。Chloroplast_norank菌属、假单胞菌属、Muribaculaceae_norank菌属、鞘氨醇单胞菌属从发酵初期就呈下降趋势,直到末期。诺卡氏菌属、Pseudolabrys菌属、Ralstonia菌属的丰度在发酵过程中一直保持稳定。
2.1.2 玉米黄酒发酵过程中真菌菌群结构变化分析
真菌OTU统计结果及多样性指数见表3。

表3 真菌OTU聚类统计及多样性指数表Table 3 Clustering statistics and diversity indexes of fungal OTU
由表3可知,真菌测序深度(覆盖率)均达到0.999以上,说明检测全面。真菌的OTU数呈现出先增加后减少的变化特点,并在第18天达到峰值,为35。真菌的OTU数变化与细菌差别很大,而且远远低于细菌的OTU数,在发酵末期真菌OTU数不到细菌种类的1/4,这和传统发酵食品泡菜的微生物群落变化十分相似[19]。随着发酵时间的延长,Shannon指数呈先升高后降低的趋势,Simpson指数则先降低再升高,说明这一阶段真菌的物种总类和多样性也是这样变化的,但与细菌多样性变化不同的是,发酵末期与发酵初期相比物种总类和丰度有所增加。
在玉米黄酒发酵过程中共检测出19个真菌属,包括1种未分类菌属。其中曲霉菌属(Aspergillus,56.76%)、Cyberlindnera菌属(40.26%)、Kwoniella菌属(1.23%)、异常威克汉姆酵母菌属(Wickerhamomyces,1.17%)、红酵母菌属(Rhodotorula,0.32%)、根霉菌属(Rhizopus,0.11%)、毛霉菌属(Mucor,0.07%)、Meyerozyma菌属(0.04%)和出芽短梗霉菌属(Aureobasidium,0.02%)是玉米黄酒发酵过程中的9种主要菌属(括号内数字为该属的平均丰度),其余菌属平均丰度小于0.01%。在属水平上绘制真菌菌群结构柱状图,见图2。
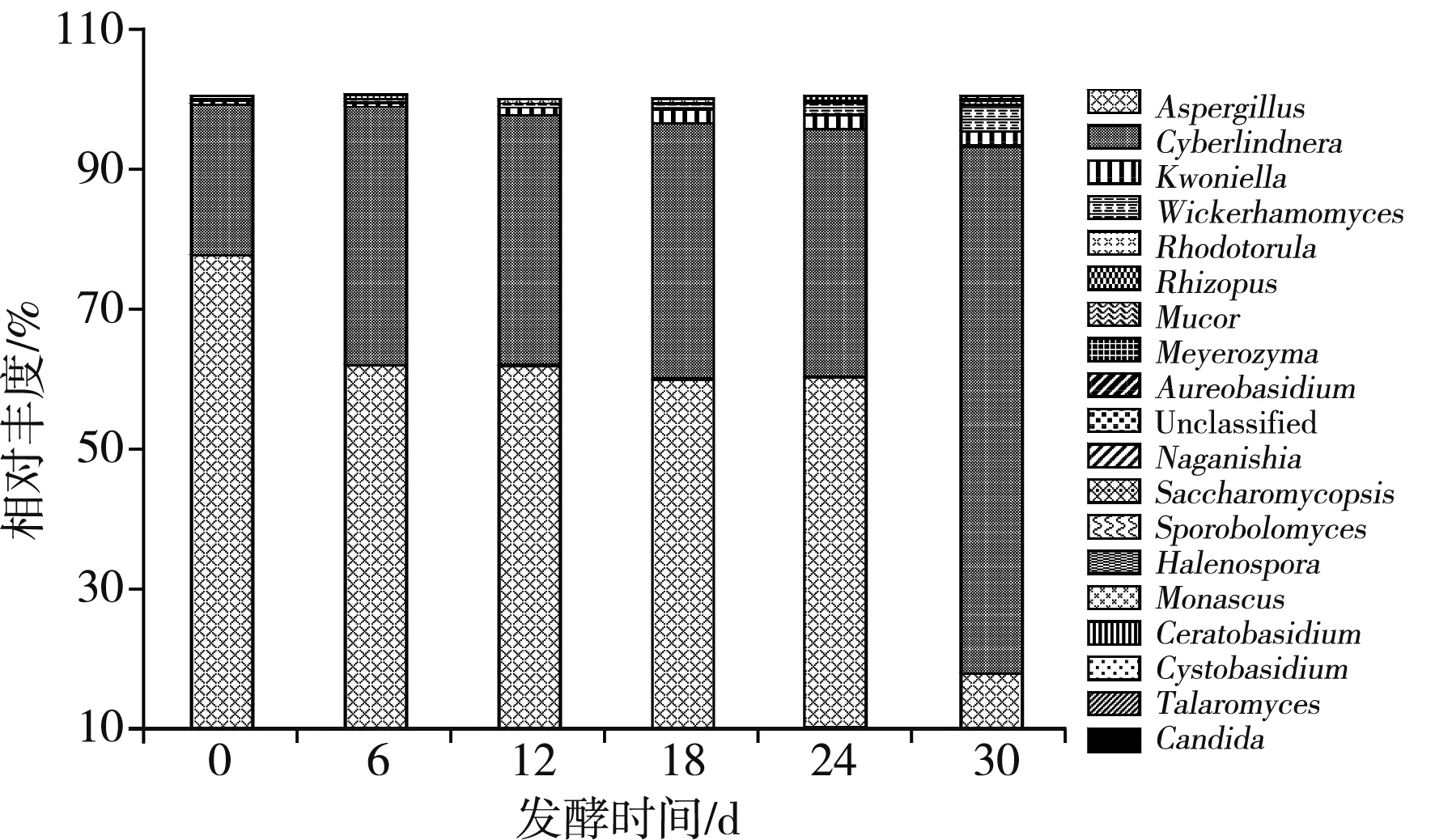
图2 玉米黄酒发酵过程中真菌属水平相对丰度变化Fig.2 Changes of relative abundance of fungi during the fermentation of corn yellow wine
由图2可知,曲霉菌属和Cyberlindnera菌属是玉米黄酒发酵醪液中的绝对优势菌属,对玉米黄酒芳香物质的生成起到重要作用。这两种菌属呈现出不同的变化特点,从发酵第0天~第6天,曲霉菌属相对丰度明显下降,而Cyberlindnera菌属的相对丰度显著升高。从第6天~第24天,两种菌属的相对丰度都比较稳定,从第24天~第30天,曲霉菌属的相对丰度明显下降,而Cyberlindnera菌属的相对丰度又显著增加,达到最大值。在发酵前期,在玉米黄酒发酵液中含有丰富的氧气,大量的曲霉菌属产生水解酶,分解原料的大分子物质,如将淀粉水解为还原糖,为酒精发酵提供碳源和能源。随着发酵的进行,氧气逐渐被消耗,乙醇浓度越来越高,因此曲霉属的相对丰度逐渐降低。而Cyberlindnera菌属是主要产酒精的微生物,它能够适应高酸和高乙醇的环境,在曲霉菌属逐渐减少的情况下,Cyberlindnera菌属为发酵后期的主要菌属。在发酵末期相对丰度升高的微生物还有Kwoniella菌属、Meyerozyma菌属、毛霉菌属和红酵母菌属,说明这些微生物能够耐受高酸、高乙醇环境。而出芽短梗霉菌属、根霉菌属、异常威克汉姆酵母菌属的相对丰度有所下降,说明这些微生物对高酸和高乙醇环境不耐受。
2.2 玉米黄酒发酵过程中挥发性风味物质含量的变化
玉米黄酒在发酵过程中会由于菌群的代谢形成大量的挥发性风味物质,主要是酯类和醇类物质,它们对黄酒酒体风格特征起到了重要影响。利用GC-MS技术对不同发酵时期的玉米黄酒进行检测,检测到24种挥发性风味物质,包括14种酯类物质、5种醇类物质以及其他类化合物,结果见表4。
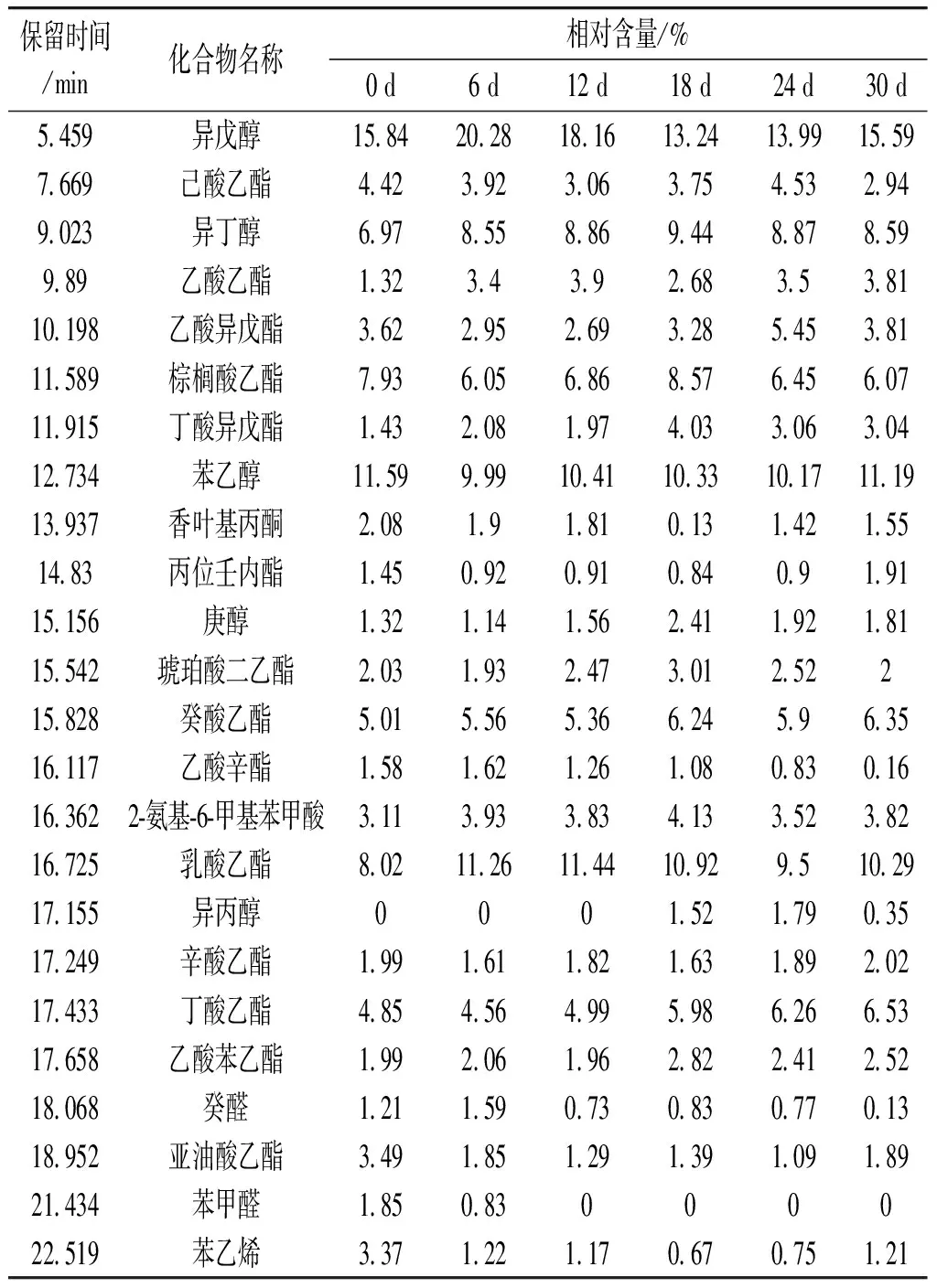
表4 玉米黄酒酿造过程中挥发性风味物质的含量变化Table 4 Changes of the content of volatile flavor substances during the fermentation of corn yellow wine
酯类物质是玉米黄酒中第一大类挥发性风味物质,乙醇酯是主要的酯类物质,因为乙醇是酒中含量最高的醇类物质,它能与各种酸类物质进行酯化反应,生成大量乙醇酯[20]。由表4可知,在玉米黄酒发酵过程中,酯类物质含量呈现出比较复杂的变化特性。有一些酯类物质含量在整个发酵期间比较稳定,如己酸乙酯、乙酸异戊酯、棕榈酸乙酯、琥珀酸二乙酯、丙位壬内酯、癸酸乙酯、辛酸乙酯。而丁酸异戊酯、乙酸乙酯、乳酸乙酯、丁酸乙酯、乙酸苯乙酯的含量呈逐渐升高的趋势。乙酸辛酯和亚油酸乙酯的含量下降很多。
高级醇类物质是玉米黄酒中第二大类挥发性风味物质。在本次实验中,从玉米黄酒中共检测到5种醇类物质,其中异戊醇是含量最多的醇类物质,其次为苯乙醇和异丁醇,庚醇和异丙醇含量较少。玉米黄酒发酵过程中,醇类物质整体呈先升高后保持平稳,然后稍有下降的趋势。大部分高级醇类物质在发酵12 d前达到了峰值,其主要原因是高级醇主要由酵母通过代谢作用生成,在发酵前期,还原糖含量较高,酵母生成乙醇和其他高级醇的速度较快,而到了中期以后,还原糖含量减少,生成的高级醇的数量变少,到了发酵后期,部分高级醇被酯化,导致其含量稍有下降。
在玉米黄酒中还检测到了3种醛酮类、1种烯类、1种酸类等挥发性风味物质。其中香叶基丙酮、癸醛、苯甲醛、苯乙烯等挥发性物质都在发酵开始时含量最高,之后含量逐渐下降。而2-氨基-6-甲基苯甲酸在发酵18 d时含量达到最高,之后含量下降。
2.3 微生物与挥发性风味物质的相关性分析
利用Simca软件对27个主要微生物属和挥发性物质进行相关重要性分析。横坐标为微生物属,纵坐标VIP(pred)为微生物属与挥发性风味物质的重要性指标。与挥发性组分相关的重要微生物属分析见图3。
由图3可知,27种主要微生物属与挥发性风味物质之间的VIP(pred)值都在0.35~1.25之间,其中VIP(pred)值>1.2的有2个属,VIP(pred)值在1.1~1.2之间的有10个属,VIP(pred)值在1.0~1.1之间的有4个属,选取VIP(pred)值>1的16个微生物属与挥发性组分进行相关性分析,见表5。
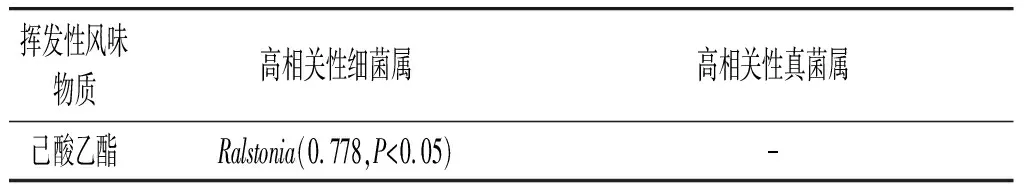
表5 微生物与挥发性组分相关性分析结果Table 5 Correlation analysis results of microorganisms and volatile components
相关性分析结果显示,有14种挥发性物质与一种或多种微生物属具有显著相关性。 其中Weissella属、Lactobacillus属、Pseudomonas属、Rhodotorula属、Kwoniella属等均与多种酯类物质的生成具有显著相关性。Weissella属是发酵食品领域常见的菌属,它既可以代谢产生有机酸,还可以产生大量的酯类物质,在泡菜以及白酒发酵过程中都有发现[21]。在玉米黄酒发酵过程中,Weissella属与异丁醇、乙酸乙酯、乳酸乙酯的生成具有显著相关性。Lactobacillus属是很多酒中的优势菌群,与乳酸和乳酸乙酯的生成息息相关,也是白酒中的主要菌群之一,它在玉米黄酒发酵过程中与丁酸异戊酯、癸酸乙酯、丁酸乙酯、乙酸苯乙酯代谢生成具有明显的相关性。Pseudomonas属是一种条件致病菌,但它在很多白酒发酵中又是优势菌群[22],在玉米黄酒中发现它与亚油酸乙酯、苯甲醛和苯乙烯有明显相关性。Rhodotorula属是葡萄酒中的重要组成微生物,有增香和降解氨基甲酸乙酯的作用,在乳制品和泡菜中也经常出现[23],是玉米黄酒中的主要菌属之一,它与癸酸乙酯、乙酸苯乙酯等几种酯类物质的生成具有显著相关性。Kwoniella属被发现存在于茅台镇白酒主酿区域中,但是对于生香成分目前研究甚少[24],在玉米黄酒中与丁酸异戊酯、庚醇具有显著相关性。
3 结论
玉米黄酒发酵过程中,微生物菌群结构复杂,并且随着发酵的进行,微生物菌群结构也发生着变化,不同微生物的相对丰度在发酵期间呈现出不同的变化。在玉米黄酒发酵过程中共鉴定出239个细菌属,其中有18个为主要细菌属,鉴定出18个真菌属,其中Aspergillus和Cyberlindnera等9个属是主要真菌属。在玉米黄酒发酵过程中共检测出24种挥发性风味物质,包括14种酯类物质、5种醇类物质以及其他类化合物,它们在整个发酵过程中呈现出不同的变化规律。相关性分析结果表明,有16种微生物属与14种挥发性风味物质具很高的相关性,其中Weissella、Lactobacillus、Pseudomonas、Rhodotorula、Kwoniella与乙酯类化合物及高级醇有显著相关性。由此说明玉米黄酒发酵过程中风味物质的生成是多种微生物共同作用的结果。

