灵芪合剂影响肝细胞生长因子/上皮间质转化因子通路抑制结直肠癌
王国胜 李嘉雯 李 娜 何西涛 董咨余 刘振新
(1 哈尔滨医科大学附属第一医院,哈尔滨,150000; 2 哈尔滨医科大学附属第四医院,哈尔滨,150000; 3 哈尔滨医科大学附属第六医院,哈尔滨,150000)
我国结直肠癌(Colorectal Cancer,CRC)发病率在近几十年来呈逐渐上升趋势。现在CRC的死亡率为全部恶性肿瘤死亡率中的主要类型之一[1],CRC调整死亡率男性为5.29/10万,女性为3.86/10万[2]。近年来,肿瘤的治疗越来越多地应用中药。有研究发现,中药对肿瘤的作用机制可能是“多靶点作用”,并且具有独特的功效[3],即有选择地反复作用于某种疾病的多个直接靶点和间接靶点从而达到治疗疾病的目的[4]。在本实验室的前期研究中发现,部分中药对LoVo人结直肠癌细胞(Human Colon Cancer Cells)的相关表达因子有所影响[5]。在我们以往的研究中,根据LoVo的细胞生长曲线,灵芪胶囊各组对肿瘤细胞的生长具有一定的抑制作用;灵芪胶囊(换气、灵芝、莪术、茯苓、人参、枸杞子、山药、山慈菇、重楼等)对诱导细胞凋亡效果显著[6]。另一方面,肝细胞生长因子(Hepatocyte Growth Factor,HGF)/上皮间质转化因子(Mesenchymal-epithelial Transition Factor,c-Met)信号通路被认为是结直肠癌转移所必需的,结直肠癌早期的强有力的诊断指标[7-8]。HGF/c-Met信号转导通路是目前诱导细胞迁移的关键信号通路[9]。因此,本实验室通过建立肿瘤模型,使用自研中药灵芪合剂(黄芪、灵芝、莪术等合剂)[10],来验证本合剂配方是否可通过调控HGF/c-Met信号通路从而抑制CRC细胞的侵袭和转移。
1 材料与方法
1.1 材料
1.1.1 细胞 LoVo细胞(黑龙江省肿瘤研究所,货号:STCC00011G)。
1.1.2 动物 24只裸鼠由黑龙江中医药大学药物安全性评价中心提供,合格证编号:SCXK(黑)2020-003。体质量20~25 g,清洁级,8周龄,给药前适应性喂养5~7 d(普通饲料,常规饮水,室温控制在22 ℃左右,相对湿度约60%)。本课题所有涉及动物的试验均已通过哈尔滨医科大学实验动物伦理委员会的批准,动物伦理审批号:LL2017032802,符合清洁级实验动物标准。
1.1.3 药物 灵芪合剂由哈尔滨医科大学附属第一医院制剂室生产,由黄芪、灵芝、莪术、茯苓、人参、贯众、山药、枸杞子、重楼、山慈菇等组成,每粒含生药1.65 g[11]。
1.1.4 试剂与仪器 胸苷酸合成酶抑制药5-氟尿嘧啶(5-Fluorouracil,5-FU)注射液(国泰医药股份有限公司,国药准字H2020959)。细胞裂解液(增强型,上海碧云天生物技术研究,货号:P0013);0.45 μm聚偏二氟乙烯(Polyvinylidene Fluoride,PVDF)膜(Sigma公司,德国,货号:P2938);HGF多克隆抗体[货号:Anti-HGF antibody(EPR12230)ab178395]、c-Met多克隆抗体[货号:Anti-Met(c-Met) antibody(EP1454Y)-N-terminal ab51067]以上购自美国Abcam公司;通用型电泳仪(上海天能科技有限公司,型号:TanonESP300);转膜仪(BayGene公司,美国,型号:BG-Power60);倒置荧光显微镜(Olympus公司,日本,型号:CKX41);荧光显微镜(NIKON公司,日本,型号:NIKON ECLIPSE C1);高速低温离心机(Sigma公司,德国,型号:Centrifuge 5424R);微量分析天平(METTLER公司,瑞士,型号:E260);全自动化学发光分析仪(通用电气公司,美国,型号:Imager 600)。
1.2 方法
1.2.1 分组与模型制备 1)动物实验分组:裸鼠按照完全随机法分为6组,每组4只,阴性对照组,阳性对照组,5-FU注射液组,灵芪合剂高剂量组、中剂量组和低剂量组,每组4只。2)除阴性照组裸鼠外,其他组裸鼠按0.2 mL/只接种LoVo于常规皮肤消毒后的裸鼠右前肢腋部皮下,接种24 h后进行下步操作。
1.2.2 给药方法 实验时将灵芪合剂临时配制成溶液。灵芪合剂高剂量组、中剂量组和低剂量组分别为5.0 g/kg、2.5 g/kg、1.25 g/kg,给药方式均为灌胃给药,连续给药7 d;阴性对照组以0.2 mL生理盐水灌胃;5-FU注射液组以5-FU注射液0.027 g/(kg·d)灌胃;阳性对照组不进行任何干预。
1.2.3 检测指标与方法
1.2.3.1 动物实验 蛋白质印迹法检测裂解肿瘤组织细胞,提取蛋白,使用BSA计算蛋白含量和上样量。灌胶、上样,进行电泳。转模后进行一抗和二抗的孵育,一抗浓度:HGF(1∶1 000稀释)和c-Met(1∶1 000稀释),二抗浓度:辣根过氧化物酶(Horseradish Peroxidase,HRP)标记二抗羊抗兔(1∶5 000)稀释,时间分别为10 h和2 h。采用Imager 600全自动化学发光分析系统进行目的蛋白化学发光的检测,获取并保存结果。应用图像处理软件(ImageJ)分析蛋白灰度值。
1.2.3.2 c-Met的免疫荧光检测步骤 1)准备处理好的肿瘤组织切片,并置于65 ℃恒温箱烤片1 h。接下来使用1×磷酸盐缓冲液(Phosphate Buffered Saline,PBS)洗涤3次,5 min/次。2)0.5%聚乙二醇辛基苯基醚(Triton X-100)使用1×PBS配制,室温通透细胞15 min,1×PBS浸洗玻片3次,3 min/次。3)使用柠檬酸盐缓冲液进行抗原修复。将切片浸入柠檬酸盐缓冲液(pH=6.0),微波炉高火加热8 min后拿出,冷却至室温。冷却后PBS(pH值7.2~7.6)洗涤3次,3 min/次。4)加入3% H2O2,室温10 min。PBS冲洗3次,3 min/次。5)血清封闭:切片滴加血清放入湿盒中,室温20 min。6)孵育一抗:滴加适当稀释的一抗(c-Met),对照组滴加等量PBS,4 ℃冰箱过夜。7)加荧光二抗:PBS浸洗3次,3 min/次,吸干切片上多余液体后滴加稀释好的荧光二抗,湿盒中37 ℃孵育1 h,PBS浸洗3次,3 min/次。8)复染核:滴加4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)避光孵育5 min,对切片进行染核,PBS洗涤4次,去除多余DAPI。9)封片:使用防荧光淬灭封片剂进行封片,接下来使用荧光显微镜观察。
1.2.3.3 凋亡检测 用0.25%的胰酶消化肿瘤组织。在消化时加2%的牛血清白蛋白(Bovine Serum Albumin,BSA)可防止消化过度。用1×PBS洗涤。细胞收集:用胰酶消化收集后,于室温2 000 r/min,离心半径6 cm,离心5~10 min,离收集细胞;用预冷1×PBS(4 ℃)重悬细胞1次,2 000 r/min,离心半径6 cm,离心5~10 min,洗涤细胞;加入300 μL的1×结合缓冲液(Binding Buffer)悬浮细胞;膜联蛋白V荧光素(Annexin V-FITC)标记:加入5 μL的Annexin V-FITC混匀后,避光,室温孵育15 min;碘化丙啶(Propidium Iodide,PI)标记:上机前5 min再加入5 μL的PI染色。

2 结果
2.1 HGF和c-Met的蛋白质印迹法检测结果 灵芪合剂能够显著抑制HGF蛋白表达量,其中灵芪胶囊高、中、低剂量组与阳性对照组比较,差异有统计学意义(P<0.05)。见图1。灵芪胶囊能够影响c-Met蛋白相对表达量,高剂量组效果更为明显,差异有统计学意义(P<0.05)。见图2。
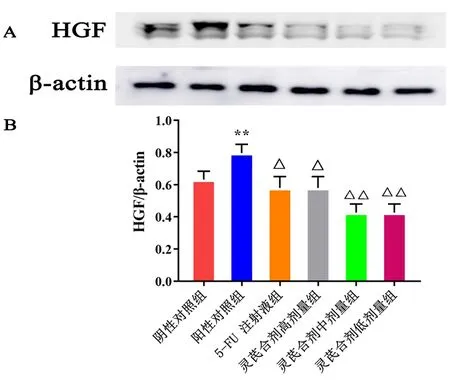
图1 HGF蛋白的表达与HGF/β-actin结果(n=4)注:A. HGF与内参蛋白印迹图; B. HGF与β-actin蛋白条带强度之比;与阴性对照组比较,*P<0.05,**P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01
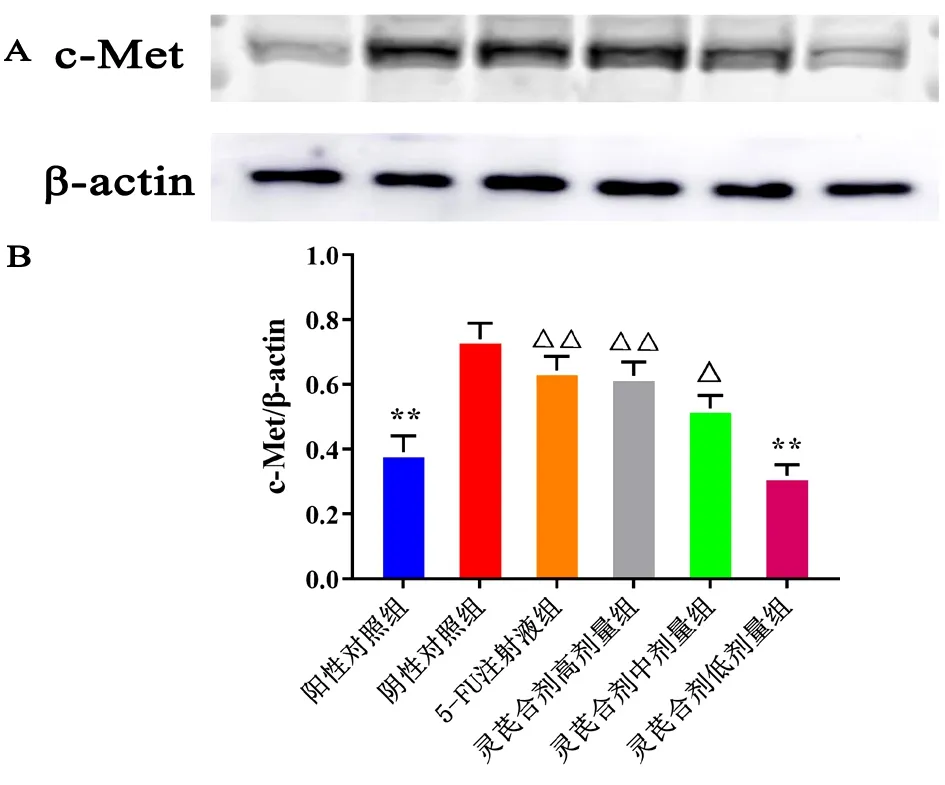
图2 检测c-Met蛋白的表达与c-Met/β-actin结果(n=4)注:A. c-Met与内参蛋白印迹图; B. c-Met与β-actin蛋白条带强度之比;与阴性对照组比较,*P<0.05,**P<0.01;与阳性对照组比较,△P<0.05,△△P<0.01
2.2 凋亡检测结果 灵芪合剂高剂量组诱导细胞凋亡的作用最为显著,与阳性对照组比较,差异有统计学意义(P<0.01)。见图3。

图3 灵芪合剂诱导组织凋亡与调亡指数(免疫荧光染色,×400)注:A.细胞凋亡结果;B.各组凋亡指数;与阴性对照组比较,**P<0.01;与阳性对照组比较,△△P<0.01
2.3 c-Met的免疫荧光表达结果 在肿瘤组织中c-Met表达量很低,在灵芪合剂高剂量治疗后c-Met表达量显著增多,与蛋白质印迹法的蛋白表达结果相一致。见图4。

图4 c-Met免疫荧光表达(免疫荧光染色,×400)注:DAPI染蓝色为细胞核,红色为c-Met蛋白阳性表达
3 讨论
CRC是全球癌症被公认的死亡第三大原因[12]。发病率和死亡率随着时间的推移迅速增加,预计全球CRC负担将激增60%[13],新发病例超过220万,到2030年将有110万人死亡[14]。因此,找到一种除了手术疗法外的有效治疗方法刻不容缓。
在正常生理条件下,HGF/c-Met的相互作用强烈介导细胞组织和细胞分裂[15],如上皮细胞增殖和迁移、血管生成和伤口愈合[16]。而HGF/c-Met通路也参与不同类型的恶性肿瘤,在肿瘤的增殖、侵袭和转移中起关键作用[17]。本课题组多年来从事着消化道肿瘤及相关研究[18-20],近些年来发现灵芪胶囊对于各种消化道肿瘤具有一定的抑制作用,其中该药物对LoVo细胞的抑制作用非常明显[6,21],具有一定的开发潜力。
从HGF和c-Met蛋白的表达结果可以看出,在没有应用灵芪合剂治疗的组别HGF表达量较高,c-Met的蛋白表达量较低;在应用灵芪合剂治疗后,2个蛋白的表达量反转,分别降低和升高,且差异显著。在免疫荧光实验中,其结果与蛋白质印迹法检测结果基本一致,这也表明了灵芪合剂对HGF/c-Met信号通路的影响,从而影响癌症发展。
本研究结果表明,c-Met在CRC进展和转移中起重要作用。HGF/c-Met信号通路的干预可能为探索CRC转移的新药物疗法提供宝贵的靶点,潜在的c-Met抑制剂可能在结肠癌的治疗中具有治疗价值,同时也为中药治疗癌症提供先例,为中药制剂提供新方向。
综合本研究结果,经灵芪合剂治疗的结直肠癌裸鼠模型,其肿瘤细胞的HGF蛋白表达明显下降,而c-Met蛋白表达明显增强,其高剂量灵芪合剂调控HGF和c-Met表达效果与5-FU相当,免疫荧光检测结果与蛋白质印迹法检测结果一致,表明灵芪合剂可能通过下调HGF的表达,上调c-Met的表达,达到抑制肿瘤的效果。制备CRC内体裸鼠荷瘤模型,并选取中医药经典方剂,经现代化工艺制成灵芪合剂,深入分析阐明灵芪合剂对CRC的抑制作用及其机制。并通过体内验证灵芪合剂的生物学功能及药效学研究,灵芪合剂能够抑制CRC裸鼠荷瘤模型的肿瘤生长,其作用机制与灵芪胶囊机制肿瘤过程中激活的HGF/c-met细胞通路有关,进一步明确灵芪合剂对CRC的抑制作用及其作用途径,为灵芪合剂在CRC肿瘤治疗过程中积累了宝贵的临床经验,为CRC的治疗提供理论基础和新的思路。
利益冲突声明:本研究作者均无利益冲突。

