原位电离质谱技术在微生物菌株筛选中的应用进展
刘欢,崔球
(1 中国科学院青岛生物能源与过程研究所,中国科学院生物燃料重点实验室,山东省合成生物学重点实验室,山东 青岛 266101; 2 山东能源研究院,山东 青岛 266101; 3 青岛新能源山东省实验室,山东 青岛 266101)
微生物细胞工厂是绿色生物制造的重要基石,可助力实现“双碳”目标。在微生物菌株开发过程中,合成生物学的“设计-构建-测试-学习”循环已成为示范流程,可加速菌种进化工程。基于底盘细胞的理性或半理性改造来获取多样性突变文库的技术已经得到了长足的发展[1]。然而,突变文库中筛选目标菌株的高通量策略的发展进展缓慢,从而限制了其应用。目前,通过检测细胞代谢表型来筛选目标基因型菌株是筛选突变文库的一种直接且精准的方法。但是,目前主流的细胞代谢表型筛选方法通常耗时耗力且效率低下,成为合成生物学发展中的“限速步骤”之一。
目前,基于细胞代谢表型的高通量筛选方法主要包括荧光标记、拉曼光谱和质谱技术。荧光标记技术具有高灵敏度和特异性等优势,是目前应用最为广泛的细胞表型检测技术之一[2]。它的通量可以高达107个/h[3]。然而,缺乏特异性荧光探针限制了该方法的使用范围,此外,有些细胞可能会受到荧光标记的影响,影响其自身的生物学特性,对于原位检测也会造成困扰。拉曼光谱技术是一种高效的细胞表型识别技术,具有无损、非标记、高通量和低成本等优点[4]。然而,由于大多数细胞表型的拉曼信号较弱,拉曼检测灵敏度较低,更难以进行低浓度细胞表型的分析。此外,利用拉曼光谱技术可获得细胞代谢组表型的总体光谱特征,但难以从分子水平上获取胞内单一种类分子的完整拉曼光谱特征。
质谱(mass spectrometry,MS)是一种强大的分析技术,通过检测气相离子来鉴定和定量化合物,并提供化合物分子量和化学结构信息[5]。质谱具备高特异性、高灵敏度、普适性、快速、微量和非标记等优点,因此在各个学科领域广泛应用。其中,电离源作为质谱的关键核心部分,能够将分子离子化。常用的电离源包括电喷雾电离(electrospray ionization,ESI)源[6]、基质辅助激光解吸/电离(matrix-assisted laser desorption/ionization,MALDI)源[7]、大气压化学电离源和大气压光电离源等,这些电离源往往需要在真空或负压条件下分析较纯净的样品。气相色谱-质谱联用(gas chromatography MS,GC-MS)和液相色谱-质谱联用(liquid chromatography MS,LC-MS)技术已成为现代分析化学的“金标准”,可用于各种复杂样品的分析[8]。例如,GC-MS可以用于靶向分析解脂耶氏酵母菌生物合成的终产物中链脂肪酸[9]。然而,细胞样品的扩大培养、复杂样品制备和较长时间的色谱分离使得这些技术的通量较低,限制了它们在菌株高通量筛选中的应用。
原位电离质谱(ambient ionization MS,AIMS)是一组新型的分析技术,它可以直接解吸和电离天然样品中的待测分子,无需分离或样品预处理。这种技术突破了经典电离方法的束缚,可以在大气压条件下实现固体样品的实时、表面和原位检测[10]。在过去的二十年中,AI-MS已经发展出多种在大气压下工作的技术,并广泛应用于多个科学领域,如生物医学、制药和法医学、植物科学、微生物学、神经科学以及癌症病理学等[11]。
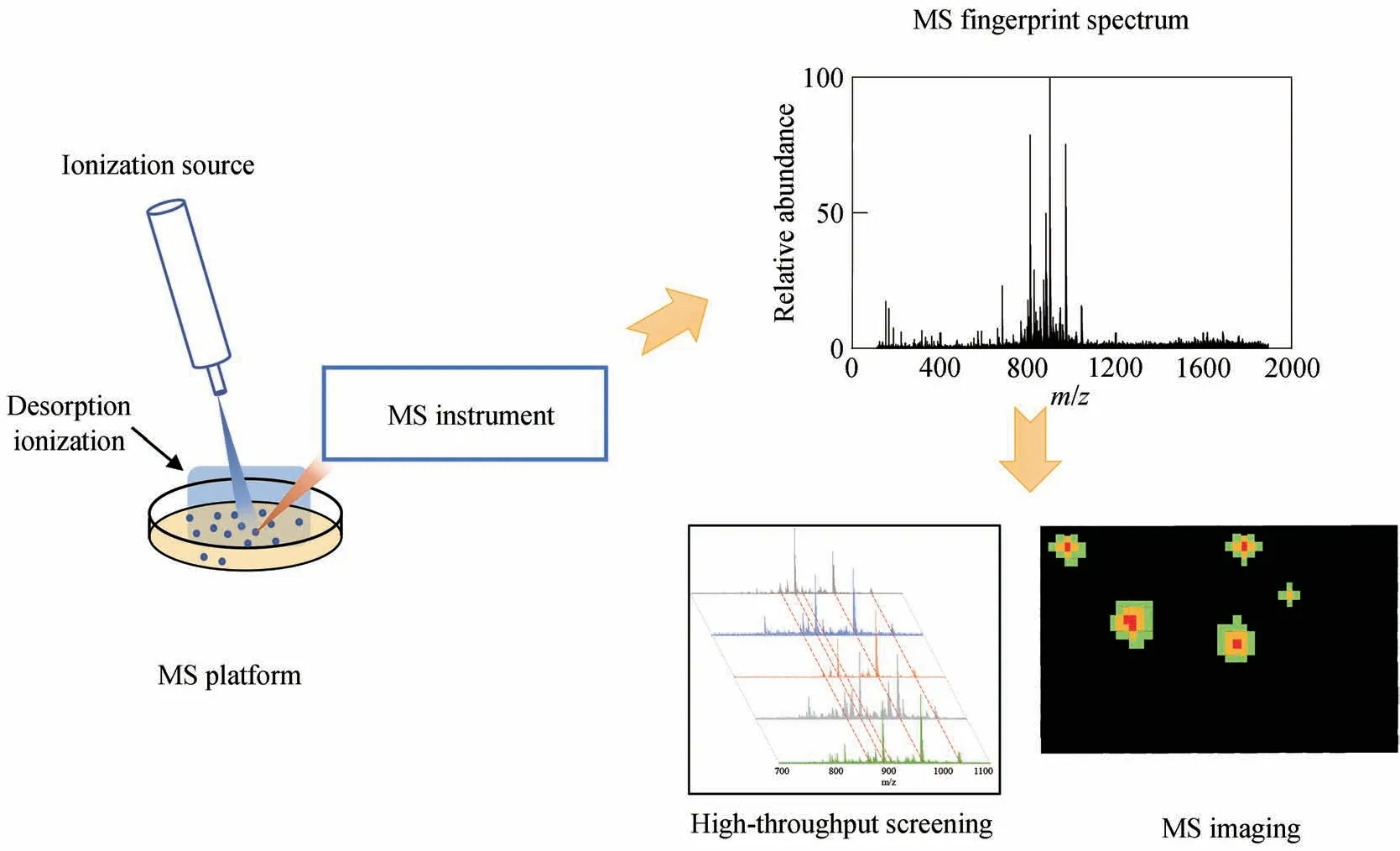
本文旨在探讨MALDI-MS和AI-MS在微生物菌株高通量检测和筛选中的应用(图1)。首先介绍了经典MALDI-MS和基于电喷雾、激光和等离子体的AI-MS的工作机制,以及它们如何实现对完整微生物细胞的直接检测。其次,详细介绍了质谱技术在微生物突变文库的高通量筛选和活菌落成像中的研究进展。最后,探讨了AI-MS在微生物菌株选育中的优势和不足,并展望了AI-MS在合成生物学领域未来的发展方向。

图1 质谱技术在微生物检测中的应用Fig. 1 Application of mass spectrometry in microbial detection
1 质谱电离技术工作机制及表征完整微生物细胞
1.1 基质辅助激光解吸/电离质谱
MALDI-MS已经发展成为一种快速可靠的微生物细胞分析技术[12-13]。自20世纪90年代起,MALDI-MS用于直接识别菌落中的蛋白质[14-15]。在该技术中,将菌样品和基质混合,在样品靶板上形成共结晶,然后将其放置于MALDI源中,在高真空条件下进行检测。这种方法能够实现约每秒1个样品的分析通量。基质的选择直接影响到MALDI-MS的图谱质量。通常用于菌样检测的基质包括α-氰基-4-羟基肉桂酸(CHCA)、2,5-二羟基苯甲酸(DHB)和3,5-二甲氧基-4-羟基肉桂酸(芥子酸)[12]。基质溶液通常由水、有机基质和强酸组成,具有穿透微生物细胞壁和提取细胞表型分子的能力。MALDI-MS可以直接获取菌样细胞表型分子的指纹图谱,包括脂质谱和蛋白质谱等。这些谱图可用于在属、物种或亚群水平上鉴定细菌[13]。目前已有许多文献对于MALDI-MS在细菌鉴定方面进行了综述[12-13,16-19],因此此处不再赘述。
由于具有样品制备简单、耐高盐、化学覆盖广和高通量等优点,MALDI-MS已成为成熟的高通量分析平台,非常适合进行大规模微生物样品的快速筛选[20-22]。虽然MALDI-MS通量显著提高,样品处理步骤减少,但是目前基于真空采样的MALDI技术可能受限于对不稳定或挥发性小分子的检测。此外,基质的应用和共结晶的异质性可能会影响菌的表型定量,同时高丰度的背景峰可能会对小分子的检测灵敏度产生影响[12]。此外,MALDI-MS适用于直接检测革兰氏阴性菌细胞,而对于革兰氏阳性菌细胞的检测通常需要先制备全细胞裂解液或粗细胞提取物,然后再进行质谱检测。
1.2 原位电离质谱技术
AI-MS技术是由质谱学家Cooks教授于2004年首次提出[10,23]。该技术在常压条件下,无需或仅需极少样品前处理过程,便可直接实现对样品待测组分的质谱分析。AI-MS已成为质谱科学和仪器研究的焦点,同时也催生了基于不同电离机制的原位电离技术。无需或仅需极少样品前处理,AI-MS即可在常压敞开条件下直接对细胞进行分析,因此在完整微生物细胞的直接检测中具有重要的应用价值。本文将重点介绍基于电喷雾、激光和等离子体的AI技术(表1),并详细描述它们在微生物细胞检测中的应用。

表1 原位电离技术及在微生物检测中的应用案例Table 1 AI techniques and their application examples in microbial detection
1.2.1 基于电喷雾的原位电离技术
解吸电喷雾电离(desorption electrospray ionization,DESI)技术首次由Cooks团队提出,是一种基于电喷雾电离的AI技术。在DESI[图2(a)]中,带电溶剂在高速气流的辅助下形成初级微滴,解吸和电离样品表面的待测组分,随后形成次级微滴,并在飞溅过程中被引入质谱仪进行分析[10,23,51]。DESI技术具有实时、表面和原位检测固体样品表面痕量组分的能力[51]。随着AI-MS技术的不断发展,DESI技术也得到了持续改进和优化,以适应各种实际应用领域[51-59]。本节将重点介绍DESI-MS在完整微生物细胞分析方面所取得的应用进展。
第一个应用案例是Cooks团队[24]首次采用DESIMS技术对3种大肠杆菌菌株(DH10B,JM109和XL1-Blue)和2种鼠伤寒沙门氏菌菌株(TL212和LT1)的完整细胞进行了分析。在DESI-MS实验中,首先将1 μL的新鲜细胞悬浮液均匀沉积(约0.5 cm2)在载玻片上。接下来,在室温下将载玻片上的细胞悬浮液蒸干约1~2 min,以除去水分。然后,使用50%甲醇水溶液作为电喷雾试剂,对细胞中的分子进行解吸和电离。同一平板上培养的2个菌落的分析时间间隔设置为5 min。该研究成功获取了5种革兰氏阴性菌活细胞的脂质(主要为磷脂)指纹图谱。通过主成分分析,可以区分不同的菌种和菌株。除此之外,DESI-MS还被用于表征革兰氏阳性菌枯草芽孢杆菌菌株生物膜的指纹图谱[25]。这些指纹图谱主要包含了枯草芽孢杆菌外泌的表面活性脂肽(C13、C14、C15等)的信息,可用于微生物的鉴定和表征。
第二个应用案例是McLean团队[26-27]采用DESI-MS结合微孔膜支架方法,实现了对完整菌落细胞的分析。在实验中,微生物菌落被培养在琼脂基质的膜支架上,然后将膜从琼脂中取出并贴在载玻片上,直接进行DESI-MS检测。DESIMS采样和无监督分割方法相结合,可以进行微生物相互作用的空间化学分析[26],以及微生物菌落的非定向分析[27]。需要注意的是,DESI-MS技术本质上是一种表面分析技术,主要用于测量细胞外泌代谢物和与细胞膜相关的分子,很难提供细胞内代谢物分子信息。
纳解吸电喷雾电离(nano-DESI)技术是由Laskin团队首次提出的[图2(b)][28,30,60-61]。该技术利用初级熔融石英毛细管将溶液输送到样品表面,在距离质谱口附近的自吸式纳毛细管与样品表面形成液桥(直径为10~200 μm),溶解并提取样品表面分析物,然后通过纳毛细管将其输送至质谱口处进行电离。nano-DESI技术实现了高度局部化采样,通过减小液桥与样品接触面积可以提高空间分辨率,而增大液桥与样品接触面积可以提高质谱电离效率。DESI和nano-DESI都属于常压下的液体萃取电离技术,它们之间的区别在于:DESI利用高速气流辅助溶液雾化形成带电液滴,对样品表面分子进行解吸和电离;而nano-DESI则通过每分钟纳升级的流速形成恒定液桥,无需气流辅助,从而消除了样品溅射现象,并提高了采样效率。
使用nano-DESI技术可以温和地对表面微生物进行提取和分析,从而直接分析活菌落,也可以用于表征和鉴定微生物相互作用的分子特征(表1)[28,30]。Laskin团队[30]使用nano-DESI技术对琼脂平板上共培养的2种细菌菌株链霉菌(Streptomyces coelicolorA3)和枯草芽孢杆菌(Bacillus subtilisPY79)进行分析,获取它们的空间分子特征。通过利用nano-DESI-MS/MS数据建立细菌相互作用期间释放的代谢物分子网络,鉴定出1种新的枯草芽孢杆菌表面活性素类似物。同时,结合nano-DESI-MS与分子网络分析,可以检测到假单胞菌菌株(Pseudomonassp. SH-C52)中一种预测但尚未经过实验证实的脂肽thanamycin。此外,该团队利用nano-DESI技术对琼脂平板上的集球藻属菌落(Synechococcussp. PCC 7002)进行快速分析[29],发现几种未曾报道的单半乳糖基二酰基甘油和二半乳糖基二酰基甘油分子。通过使用一维扫描获取琼脂上代谢物的化学梯度,成功鉴定出菌落释放到琼脂上的糖基甘油和蔗糖两种代谢物。此外,nano-DESI实验进一步表明了代谢物扩散与菌落的年龄存在相关性。
纸喷雾电离(paper spray ionization,PSI)技术是由Cooks团队首次提出的[图2(c)],不同DESI和nano-DESI技术,PSI技术是用纸作为样品载体,具有电喷雾电离和原位电离的特点,可用于快速进行复杂混合物的定性和定量分析[62-66]。在PSI源中,使用一片三角纸作为纸基,位于质谱口的前端。通过一个铜夹施加高电压(3~5 kV)到纸基上,然后将含有分析物的溶剂添加到纸基上形成离子,进行质谱检测[62]。PSI技术集成了样品的收集、分析物的分离和分析物的电离三个步骤,具有低成本、易制备和易于进行化学改性等优点,在简单样品处理和电离方面具有广阔应用前景。作者开发了一种PSI-MS结合同位素内标方法,用于快速分析土壤和沉积物中有机污染物四溴双酚A[67]。在该方法中,将甲醇提取物和同位素内标加载到纸基上,然后通过在纸基上施加高电压的方式,使得分析物在纸基尖端处被电离并引入质谱。PSI-MS能够在1 min内完成单个样品的检测,其线性范围为0.1~100 μg/L,检测限为0.039 μg/L,是一种快速和有效的分析方法。Cooks团队[31]还利用PSI-MS技术,在无需样品制备的情况下,快速区分了不同种类的细菌。在PSIMS中,将细菌菌落(约100 μg)涂抹在三角纸表面中间位置,滴加15 μL溶剂湿润纸基,并施加高电压。在电场作用下,带电液滴被引入质谱仪进行分析。每个样品的采集时间为1~2 min。PSIMS技术通过获取细菌细胞膜的磷脂特征质谱图谱,并结合主成分分析和线性判别分析,成功区分了革兰氏阳性和阴性菌的8个不同属,共计16种不同物种。此外,该团队还使用PSI-MS技术直接对2种微藻菌株片剂Kyo-Chlorella和Nannochloropsisform中的极性脂质进行了表征[32]。
微滴撞击诱导喷雾电离(microdroplet impactinduced spray ionization,MISI)技术由Basuri团队提出[图2(d)][33],与PSI技术类似。在MISI技术中,通过在第一张纸基上施加高电压,产生带电微滴。这些带电微滴沉积在第二张纸基上,该纸基含有流动的分析物溶液。通过电荷转移反应,在纸基尖端产生携带分析物的二次带电微滴,然后将这些微滴引入质谱进行检测。MISI技术最多可以串联三个级联喷雾源。由于高电压没有直接施加在分析物的纸基上,MISI可以作为一种非入侵方法,用于原位检测枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)和恶臭假单胞菌(Pseudomonas putida)中的脂质分布,以区分不同种类的细菌。整个MISI分析过程可以在1~2 min内完成,且细菌细胞在经过多次MISI分析后仍保持89%的活力。与标准PSI相比,MISI在没有直接施加高电压到样品上的方面更具优势,可以实现对活细菌样本的无创原位检测,并通过特征脂质分布区分不同种类的细菌。
热解吸-电喷雾电离(thermal desorptionelectrospray ionization,TD-ESI)质谱由谢建台团队提出,是一种通过热辅助解吸细菌细胞分析物的电喷雾质谱技术[图2(e)][34]。该方法涉及使用金属探针采集培养皿中的菌落样品,进行溶剂提取。随后,将探针插入到TD-ESI源中,进行热解吸分析物,并在氮气的辅助下将解吸的分析物输送到ESI喷雾中进行电离。最后,进行质谱检测。整个过程在1 min内完成。TD-ESI-MS技术能够同时获得5种革兰氏阴性菌和5种革兰氏阳性菌的脂质谱图,结合主成分分析(PCA)和层次聚类分析(HCA),通过脂质谱图差异性来区分不同细菌物种。该方法在细菌蛋白质谱图的MALDI-MS分析中也得到了验证。
简易环境声波喷雾电离(easy ambient sonicspray ionization,EASI)技术由Eberlin团队于2006年引入[图2(f)][68-69]。不同于以上AI技术,该技术不需要使用加热、高压、激光、电晕放电或辅助气体,仅依靠声波喷雾生成密集的带电液滴云,用于分析物的收集和电离。EASI技术是一种最简单、最容易实现的原位电离技术。在EASI技术中,通过声速流动的氮气机械破坏溶液中均匀分布阳离子和阴离子,将溶液均匀分解成非常小的液滴。然后,这些带有正负电荷的液滴流束击中沉积有分析物的表面,实现液滴的萃取和分析物的电离过程。这些产生的分析物离子随后会从液滴中释放到气相中,并进入质谱仪进行进一步分析[70]。EASI-MS已成功应用于研究蓝藻在不同生长条件下的脂质变化[35-36]。例如,刘虎威团队[36]利用EASI-MS研究了单细胞蓝藻[聚囊藻(Synechocystis6803)和聚球藻(Synechococcus7002)]、丝状蓝藻[鱼腥藻(Anabaena7120)]在不同生长阶段中脂质硫酸喹诺糖二酰甘油(SQDG)和磷脂酰甘油(PG)的变化情况。研究发现,脂质成分可用于确定蓝藻的生长状态,进一步了解蓝藻细胞的生理状态。结果显示,这3种蓝藻在不同培养时间下的SQDG/PG比例显著降低,脂质的不饱和水平也发生显著变化。
张新荣团队开发了几种微萃取结合电喷雾质谱技术,用于单细胞中代谢物的分析,如探针电喷雾质谱(probe ESI-MS,PESI-MS)[71]、尖端溶剂萃取质谱(in-tip solvent microextraction MS,ITSME-MS)[37]、脉冲直流电喷雾电离质谱(Pico-ESI-MS)[72]。其中,ITSME-MS是一种用于分析单个细胞脂滴中磷脂酰胆碱和甘油三酯分子的新方法[图2(g)][37]。该方法首先使用纳米尖端吸入单个脂滴,然后在纳米尖端内注入脂质提取溶剂,并进行nanoESI-MS分析。在尖端区域形成梯度溶液体系,从水性缓冲溶液到疏水性的有机溶剂,依次分离和分析磷脂酰胆碱和甘油三酯分子。这种方法已成功应用于分析HepG2细胞中的脂滴,并比较了不同脂滴的脂质谱。
Sciex Echo-MS和微流体质谱是具有高通量分析潜力的重要平台。Echo-MS平台利用声学液体处理机器人,将纳升级别的液滴从微孔板中喷射到开放端口接口(open-port probe,OPP)中。OPP携带流动的溶剂流,在0.5~2 s的循环时间内进入ESI源进行质谱检测[73]。多重反应检测(multiple reaction monitoring,MRM)作为Echo-MS检测技术,用于分析物的定量检测[38]。该平台适用于高通量分析微孔板中的细胞外上清液或粗细胞提取液[38,73]。微流体平台具有产生微升级别水滴的能力,这些水滴可以分散在不相容的流体中,用于捕获和培养单个细胞[39]。在培养完成后,这些水滴中的内容物能够以30滴/s的速率直接进行在线ESI-MS检测[74],也可以将水滴点样到样品靶板上,以1个样品/s的速率进行离线MALDI-MS检测[40,75]。微流体质谱平台适用于检测培养液中细胞外泌的代谢表型分子[39]。
1.2.2 基于激光的原位电离技术
基于激光的原位电离技术通常利用紫外(ultraviolet,UV)或红外(infrared,IR)脉冲激光,以有效促进样品烧蚀或解吸,然而激光光源的电离效率相对较低,导致在激光烧蚀或解吸过程中生成的大部分分子仍是中性的[76]。因此,大多数基于激光的AI-MS技术采用了耦合二次电离方法,如电喷雾辅助激光解吸/电离(electrospray assisted laser desorption/ionization,ELDI)、LAESI、MALDESI[76-82]。
激光烧蚀电喷雾电离(laser ablation electrospray ionization,LAESI)技术于2007年由Vertes团队提出[图3(a)],并详细阐述了该电离源的构造、电离机理及其实际应用[42-43,83-90]。LAESI源利用中红外脉冲激光(例如Er:YAG固态激光器,波长2.94 μm)聚焦到样品表面,通过烧蚀和解吸产生气相分子羽流。随后,在与正交电喷雾羽流相互作用的过程中,将这些分子电离并引入质谱[76,91]。由于水分子中O—H键可强烈吸收中红外光,因此,LAESI技术适用于在常压下直接检测含水样品,例如细胞和组织[42,92]。与ESI相似,LAESI也适用于极性分子的分析。在LAESI的源构造中,采用了类似于nanoESI源的配置,其中毛细管被用作喷雾发射器,无需气动辅助电离。激光烧蚀具有在受限区域内进行采样的能力,同时具备高重复性和高通量性,因此适用于复杂样品的质谱成像研究[84]。在没有对样品进行预处理和不添加任何基质的情况下,Vertes团队[41]利用LAESI-MS对细菌菌落的生长、代谢和抗生素抑制进行了分子成像研究。他们使用单脉冲激光(0.9 mJ)聚焦在大肠杆菌菌落上,产生直径为150 μm、深度为25 μm的烧蚀坑,然后对菌落及琼脂进行分析,以获取菌落内源性代谢物和脂质的分布情况。

图3 基于等离子体和激光的原位电离技术示意图Fig.3 Diagram of ambient ionization sources based on plasma and laser
激光辅助快速蒸发电离(laser-assisted rapid evaporative ionization,LA-REI)MS平台由Takáts团队提出[图3(b)][44],同样不需要添加基质即可原位检测菌样品。该平台利用二氧化碳激光器促使样品进行热解吸,并结合快速蒸发电离方法实现电离。LA-REI-MS可直接对琼脂平板上菌落进行分析。激光产生约500 μm光斑照射在菌落上,产生的蒸气流通过PTFE管道运输到质谱口处进行电离。整个菌落分析过程只需约8 s即可完成。LA-REI-MS被用于对具有临床意义的15种微生物中的25个分离株进行形态分析,使用随机森林模型进行留一法交叉验证,分类准确率达到了97.2%。
基质辅助激光解吸电喷雾电离(matrix assisted laser desorption electrospray ionization,MALDESI)技术于2006年由Muddiman团队引入[图3(c)][82,93]。该技术的解吸和电离机理与LAESI技术相似,使用337 nm UV或2.94 μm IR激光器蒸发样品表面分子,形成气相分子羽流,并与正交电喷雾羽流相互作用发生电离,引入质谱。MALDESI使用内源性水和外源冰作为基质,以更好地从样品表面解吸化合物[94-95]。MALDESI-MS可用于对单个细胞的脂质进行快速灵敏分析[45]。在这项研究中,无需提取和/或富集分析物,而是直接将HeLa细胞分散在载玻片上,MALDESI源对细胞分子进行采样和电离。该方法能够检测出45种主要为磷脂的脂质物种。该研究结果证实了MALDESI-MS在快速脂质组学分析中的可行性和有效性。
大气压激光电离质谱(atmospheric pressure laserspray ionization mass spectrometry,AP-LSI mini MS)是由徐伟团队提出,并成功应用于直接细菌分析[图3(d)][46]。在该研究中,首先将琼脂平板上的细菌悬浮在甲醇水溶液中,浓度为2×107cfu/mL。然后,将5 μL基质溶液和细菌溶液分别加载到样品板上,在质谱入口处进行激光烧蚀解吸和电离,再引入质谱仪进行检测。该方法每次质谱扫描可检测到约1000 cfu的细菌。该工作无需复杂的提取和制备步骤,即可获得细菌细胞壁和细胞膜中寡肽和脂质等小分子的指纹谱,同时,结合监督多变量统计方法正交偏最小二乘法,可在属和种水平上区分出21种食源性细菌。
大气压基质辅助激光解吸/电离(atmospheric pressure matrix-assisted laser desorption/ionization,AP-MALDI)技术由Laiko团队首次引入[96]。APMALDI可与多种MS仪配合使用,只需进行少量改造,其小激光光斑尺寸使其具有更高的分辨率和更好的重复性。通过改善激光的聚焦直径,可以在自然条件下实现1.4 μm的横向分辨率[47]。Voorhees团队使用AP-MALDI-MS对琼脂培养基上生长的球状芽孢杆菌(Bacillus globigii,BG)培养物进行了分析,它们使用脉冲紫外激光照射基质CHCA与完整的BG细胞共结晶样品,并成功检测到生物标志物环状脂肽[97]。
1.2.3 基于等离子体的原位电离技术
实时直接分析(direct analysis in real time,DART)技术于2005年由Cody团队首次提出,是第一个基于等离子体的AI技术,并且仍然是目前最常用的技术之一[图3(e)][98]。在DART源中,载气(通常为氦气、氩气和氮气)暴露于电晕放电针中,通过电晕放电的方式使气体分子激发到亚稳态。然后,亚稳态分子与空气中的水分子发生反应,形成质子化的水簇,从而对质谱口处的样品进行解吸和电离。该方法通过加热气体来提高样品表面分子的解吸效率,进而提高灵敏度。DART技术适用于分析分子质量小于1000 Da的挥发性化合物。DART源能够解吸和电离样品表面分子,但无法直接分析完整的细胞。Pierce团队[48]采用DART-MS分析细菌细胞中脂肪酸甲酯离子。他们将全细菌细胞悬浮液与甲基化试剂氢氧化四甲基铵混合,并沉积在毛细管底部。DART源提供500 ℃氦气流与毛细管底部样品接触,使细菌细胞发生原位甲酯化和电离,并将离子引入质谱仪进行分析。Cody团队[99]采用DART-MS表征脂肪酸来鉴定细菌,而无需进行衍生化和样品处理。DART源在进行脂质分析时,通过在熔融棒上提供350 ℃的氦气流,对细胞脂质提取液进行处理,并鉴定其中的多种脂肪酸、甘油酯和磷脂。由于高温气流的作用,部分脂质会发生热分解反应产生脂肪酸离子。因此,DART源并不适用于分析热不稳定的挥发性分子。
介质阻挡放电电离(dielectric barrier discharge ionization,DBDI)和低温等离子体(low-temperature plasma,LTP)是利用低温等离子体进行样品分析的AI技术。DBD是通过在由绝缘屏障隔开的两个电极之间施加高压交流电来产生放电的技术。DBDI是张新荣团队在2007年首次提出的一种应用该原理的离子化技术[100]。DBDI技术由针电极、铜电极和两者之间装有样品的载玻片组成。针电极尖端产生等离子体会直接作用于载玻片上的样品,引发其解吸和电离[图3(f)]。Liu团队[49]采用nanoESI-DBDI源在单个植物细胞(洋葱)和人体细胞(PANC-1)中检测极性和非极性化合物 。在该实验中,他们使用内径为1 μm的毛细管插入细胞中进行采样,并使用nanoESI源对细胞中极性代谢物进行直接电离;而DBDI则作为后电离源,用于电离细胞中的非极性代谢物。在nanoESI(3.5 kV)-DBDI(2.6 kV)模式下,他们成功检测到洋葱细胞中的49种化合物和PANC-1细胞中的73种化合物。这种串联模式的应用提高了细胞中不同极性代谢物的检测范围、电离效率和检测限。通过结合nanoESI和DBDI技术,研究人员可以更全面地分析细胞中的代谢产物,提供了对细胞代谢的更深入了解。Liu团队[101]提出了一种基于活性毛细管DBDI-MS的高通量和无标记单细胞分析方法。在该研究中,电离过程发生在与质谱仪连通的毛细管内,通过这种方式大大提高了稳定性和离子传输效率。DBDI-MS平台能够同时分析单个细胞中多种代谢物,包括有机酸、羰基化合物、杂环化合物和脂质等。通过该方法,研究人员能够根据代谢谱中的特征,将不同的细胞类型进行区分,如293T、PANC-1、CFPAC-1、HeLa和iBAs。这种单细胞分析方法的检测通量约为38个细胞/min,实现了高通量分析的目标。
LTP[图3(g)]探针是DBDI技术的一种变体,利用DBD产生低温等离子体[102]。LTP探针的结构由一个玻璃管作为介电屏障,将内部接地电极和外部带电铜带电极分隔开来。通过施加交流电压,形成DBD等离子体,并直接与样品相互作用,使样品中的分子发生电离,并引入质谱[102]。Zhang团队[50]使用LTP-MS技术对来自细菌样品中的脂肪酸乙酯(fatty acid ethyl esters,FAEE)进行了检测。在实验中,他们选取了16种不同细菌(约109cfu/mL)悬浮在70%乙醇中。不需要进行提取或其他样品制备步骤,只需取1.5 μL样品沉积在载玻片上,并等待其干燥后进行LTP-MS分析。通过这种方法,成功获得了16种细菌的特征FAEE质谱图。在这种方法中,利用LTP-MS技术获得的质谱数据,结合主成分分析方法,可以对细菌进行区分和分类。然而,需要注意的是,作为表面分析技术,如DART、DBDI和LTP等,在对完整细胞进行分析时存在一定的挑战。
2 微生物突变文库高通量筛选应用案例
2.1 基质辅助激光解吸/电离质谱
MALDI-MS是一种成熟的高通量分析的平台,非常适用于大规模微生物样品的高通量筛选(表2)[21-22,103-104]。

表2 主要原位电离技术及在菌株筛选和成像中的应用案例Table 2 Main AI techniques and their application examples in microbial strain screening and imaging
Zhao团队[22,104]多年来一直致力于开发无标记的高通量细菌菌落MALDI-MS方法,用于酶突变文库的高通量筛选。该团队开发了一种图像引导质谱方法,能够在菌落、液态微滴等多种样品类型中,识别和分析所选定位置的目标,实现高通量分析[104]。这种方法在酵母脂肪酸合成酶突变体菌落的筛选中得到了应用。通过该方法,发现了5个菌落的脂肪酸C16:1和C18:1比值的平均值为18.1±1.1,明显高于其他菌落。进一步的DNA测序验证了这5个菌株都是G1250S突变体。
此外,司同团队[103]采用无标记质谱的方法进行定向进化新酶的活性筛选。在这项研究中,他们通过位点饱和诱变和epPCR文库在重组大肠杆菌中自动创建和培养表达环二肽合成酶(CDPS)突变体,并提取和准备样品。采用MALDI-MS 对样品进行检测(每个样品用时5 s),并通过自定义的计算方法处理获取的质谱数据。使用多变量分析方法,对在115~373 Da范围内的190个可能的二酮类肽分子的108个理论质荷比值进行分析。通过这种方法,该研究在一周内对4500个epPCR文库菌株进行了筛选,并成功鉴定出1个产生新环二肽产物(L-Phe-L-Val)的F186L CDPS突变体。这个发现揭示了先前未知的残基F186在底物特异性上的显著影响。此外,该团队还报道了在深圳合成生物学基础设施的集成机器人工作单元上,羊毛硫肽突变体库的自动化高通量筛选流程[109]。该流程包括DNA文库构建、宿主转化、肽生产、质谱分析和琼脂扩散测定的活性筛选。其中,在对重组生产的Halα肽进行的筛选中,该团队在数周内完成了微孔板中380个单残基突变体和大于1300个三重残基组合突变体的序列活性关系的快速分析,并发现1种Halα突变体,该突变体相对野生型具有增强的特异抗菌活性。这项工作展示了高通量和自动化筛选流程在羊毛硫肽突变体库中的应用,有助于发现具有改进特性的突变体。
2.2 原位电离质谱
DESI-MS和LA-REI-MS是可通过原位检测活菌落来实现突变文库高通量筛选的两种典型原位电离质谱技术,下面重点介绍它们在菌株筛选中的应用案例。
Barran团队[107]开发一种无标记筛选平台,利用DESI结合离子淌度质谱成像(mass spectrometry imaging,MSI)技术,在活菌落中进行生物转化的分析(表2)。该平台的操作步骤如下:首先,在琼脂平板的尼龙膜上接种含有所需质粒/文库的大肠杆菌细胞;其次,对菌落进行孵育、诱导表达和培养,在这个过程中,生物转化产物被产生并积累在菌落中;最后,使用DESI-MSI技术,可以对菌落进行分析,每个样品用时约10 s。通过将特定产物的m/z值的离子强度与平板表面上的x-y物理位置相关联,可以将数据处理成可视化的分子图像。这样,可以检测到每个菌落在平板上的具体物理位置,并获得与之相关的质谱信息。在该平台中,首先使用DESI-MSI技术检测苯丙氨酸氨裂解酶(PAL)催化的苯丙酸氨加成反应。该实验使用携带活性PAL的大肠杆菌细胞菌落,将其培养在含有底物苯丙酸的氨基碳酸盐缓冲液中。通过DESI-MSI监测,可以检测到L-苯丙氨酸(m/z164)及其他生物转化产物的生成。此外,该团队还利用DESI-MSI技术研究了菌落中完整细胞表达的P450单加氧酶参与的二氯芬酸的羟基化反应。DESI-MSI技术由于其原位直接取样、标记自由和实时监测等优点,在生物催化领域有着广泛的应用。这项工作结合了DNA信息和DESI-MSI分析结果,发挥了重要作用,特别是在文库筛选中。
McLean团队[27]采用了微孔膜支架和非靶向DESI-MSI方法,对包括工程菌株及其生物合成产物在内的细菌菌落进行了多重代谢组学分析。该方法具有直接采样、高通量和空间分辨能力。为了进行这项工作,研究团队首先利用基因工程手段将具有不同表达受控游离脂肪酸(FFA)组成和链长的硫酰辅酶A酰基转移酶(TesA)转移到大肠杆菌中。然后,通过在琼脂基质的膜支架上培养这些转基因大肠杆菌,研究团队可以根据需要的时间点将膜取出并固定在载玻片上。使用DESIMSI技术,无需对样品进行预处理,可以直接采样并分析膜上的大肠杆菌及其生物合成产物。在这些实验中,典型的DESI-MSI像素尺寸为50 μm×250 μm,可以在42 min内完成对356个菌落的采样。该研究利用靶向检测生物合成产物脂肪酸的离子图像定位特定菌落,并结合基因编辑的预测结果,确定了具有高产脂肪酸C12:0的TY05菌株和高产脂肪酸C8:0的NHL17菌株的位置。此外,研究还采用非靶向采集和无监督分割的方法,根据其测量的代谢组成功地鉴定了4种产脂肪酸的大肠杆菌菌株。通过分析所有测量特征,可以确定脂肪酸之外的样品类型之间的分子差异,例如氨基酸、小肽、脂质和其他小分子,这有助于深入研究代谢途径和菌株的代谢特征。
Gowers团队[108]利用自动LA-REI-MS技术对琼脂平板上的酿酒酵母菌落进行了快速质谱分析(表2)。在LA-REI-MS中,高功率CO2激光以0.8 cm2面积聚焦在菌落上,通过烧蚀细胞,产生含有代谢物、结构性脂质等生物分子的气相离子气溶胶。这些离子气溶胶随后被导入质谱仪进行分析,提供即时的半定量代谢物数据。该工作流程首先对琼脂平板上的菌落进行光学检测,然后使用自动化算法选取菌落,并利用机器人辅助激光对菌落进行扫描,每个菌落的分析时间小于10 s,实现了数据的快速收集。为验证LA-REI-MS技术的可靠性,该研究首先对产生紫色素的酿酒酵母菌落进行了检测。研究团队使用了模块化DNA克隆技术将紫色素生物合成过程中的5个异源基因组装到一个CEN/ARS质粒中,并将其成功转化到酵母菌中。为了构建一个含有32个酵母菌株的组合库,作者利用了不同强度的启动子进行基因表达,并将这个组合库涂于含有选择性琼脂的平板上,以形成单个菌落。作者利用LA-REIMS技术对这些菌落进行筛选,从中获取分析数据,并与平板上菌落图像进行比较以评价筛选方法的准确性。接下来,该研究利用LA-REI-MS技术对酵母生物合成的白桦酸进行检测。为此,研究人员采用了模块化组装方法,将白桦酸合成酶基因(BPLO和AtLUS1)与提高甲烷基酮途径通量的酶基因(tHMG1和ERG9)进行组合,并使用不同强度的启动子构建了一个组合质粒库。然后,将这个质粒库转化到一个包含P450还原酶酵素AtATR1的单倍体酵母菌株中,共得到了36个不同的酵母菌株。作者利用LA-REI-MS和LC-MS技术获取了这些酵母菌落中白桦酸含量的数据,并发现两种分析方法之间存在显著的相关性。最后,利用LA-REI-MS技术对上百个菌落进行了预筛选,成功地分离并验证了1种白桦酸产量提高了2.5倍的菌株。这些结果表明,LA-REI-MS技术对于有效筛选和鉴定白桦酸产量高的酵母菌株具有重要意义。该研究为通过代谢工程改造酵母菌来提高白桦酸产量提供了有益的数据和方法。
3 质谱成像
质谱成像(MSI)是一种能够在单个实验中可视化复杂样品表面大量化合物空间分布的分析方法[110]。MSI实验首先需要制备样品切片,然后通过各种解吸/电离方法进行扫描和电离,获取每个样品采样点的质谱图。从每张质谱图中提取目标质荷比(m/z)下每个化合物的离子强度,并将其组合成热图,以显示该化合物在整个样品表面的相对分布。与传统的标签探针光学成像方法相比,MSI无需标记即可对多种化合物进行非靶向成像。
3.1 基质辅助激光解吸/电离质谱成像
MALDI-MSI是一种无标记新技术,可生成2D离子密度图,能够在单次成像运行中确定数百种分析物的空间分布[13,105-106,111-113]。
Dreisewerd团队[105]通过UV-MALDI-MSI技术定位活菌落。与传统基质涂层方式不同,该研究使用2.94 μm波长的脉冲IR激光对细胞进行烧蚀,产生气相分子/离子流。通过使用UV激光作为定位电离源,对这些气相流进行电离,可将小分子代谢物、糖脂和磷脂的离子产量提高到几个数量级。该工作以铜绿假单胞菌、金黄色葡萄球菌和枯草芽孢杆菌的单一和共培养菌落作为示范细菌系统,通过对细胞特异性分子进行质谱成像,实现了定位菌株在菌落中的空间位置。
Sweedler团队[106]采用了MALDI-MSI和荧光成像的多模态成像方法来检测枯草芽孢杆菌菌落生物膜表面代谢物分布和基因表达模式。在该研究中,使用MALDI-MSI方法对在MSgg琼脂培养基上生长的枯草芽孢杆菌菌落生物膜进行检测,发现了2种同类相食的毒素,这些毒素在以前从未报道过。多模态成像方法对3种枯草芽孢杆菌菌株进行表征,分别为野生型分离株NCIB3610和2种突变株(Δspo0A和ΔabrB),这些菌株的生物膜分别具有缺陷和增强性。研究观察到,在关键的转录因子缺失后,生物膜形态、信号传导、同类相食因子分布及与基质相关基因表达都发生了相应的变化。
3.2 原位电离质谱成像
AI-MS具有高灵敏度、快速和易操作的优势,因此在质谱成像方面被广泛应用[114-121]。作为质谱成像的一个重要分支,原位质谱成像(ambient ionization mass spectrometry imaging,AI-MSI)技术已成为当前的研究热点。在AI-MSI中,化合物在环境条件下从样品表面解吸,并通过带电微滴、光子或等离子体等电离方式引入质谱仪。目前,基于不同电离方法的AI-MSI技术已被广泛应用于微生物学、疾病诊断、药物代谢等实际应用领域[114-119, 121-124]。
DESI-MSI通过对菌落进行质谱成像来筛选突变菌株的典型应用案例已在文章2.2部分展现[36,107],本章节不再详述。
Laskin团队[61]开发了一种结合剪切力显微镜的nano-DESI-MSI方法,可用于对复杂生物样品进行化学和形貌成像。该方法利用剪切力探头控制nano-DESI探针和样品之间的距离,对琼脂平板上枯草芽孢杆菌(Bacillus subtilisATCC 49760)菌落在不同生长时间下进行形貌和化学成分的成像分析。在菌落生长的1 d和7 d期间,平板上菌落的直径范围为10~13 mm,高度为0.2~0.8 mm。菌落表面特征脂肽的分布取决于菌落的年龄,其中在1 d菌落表面上分布均匀,而在7 d菌落上则主要分布菌落的“脊”区域上。
LAESI-MS是一种检测、成像和深度剖析生物细胞和组织中代谢物的重要工具(表1)[41,125-126]。Vertes团队利用LAESI-MSI与离子淌度相结合,直接在琼脂平板上对细菌(枯草芽孢杆菌和大肠杆菌)进行2D和3D成像。通过脂质分子的分布来区分琼脂平板上生长的大肠杆菌和枯草芽孢杆菌的区域。在枯草芽孢杆菌生长区域,PE(16:0/17:1)和PE(16:0/17:1)的丰度更高,而在大肠杆菌覆盖的区域,PE(31:1)、PE(18:1/18:1)和PG(34:1)的丰度更大。该研究还探讨了抗生素(链霉素和青霉素)与细菌培养物的相互作用,通过将一维数学模型拟合到琼脂平板上的抗生素和脂质浓度,推断抗生素的最小抑制浓度。
Anderton团队[127]采用金属辅助激光解吸/电离(metal-assisted laser desorption/ionization,MetALDI)MSI和MALDI-MSI对枯草芽孢杆菌菌落生物膜进行分析,并获得不同的细胞分子物种的子集。MetA-LDI-MSI主要用于鉴定多种小分子和中性脂质,而MALDI-MSI在检测其他脂质和表面活性蛋白质方面更为容易。该研究表明MetA-LDIMSI能够显著提高微生物样品成像的分子覆盖范围。
4 总结与展望
LC-MS和GC-MS已作为现代分析的“金标准”,广泛应用于各种实际应用领域中复杂样品的分析。在进行质谱定性和定量分析之前,需要对复杂样品进行提取、纯化等前处理及色谱分离等步骤。在微生物菌株检测和突变文库筛选中,目前的主流实验方法基于细胞代谢表型,包括摇瓶扩大培养、细胞破壁、分析物提取、纯化、衍生化以及色谱分离等步骤。由于该过程耗时且效率低下,制约了微生物菌株的选育进程。MALDIMS是微生物突变文库筛选的成熟平台之一,具有高通量、非标记、高灵敏等优点。该质谱技术的样品制备过程简单,只需要将细菌样品与基质共同沉积在样品靶板上进行共结晶。MALDI-MS需要在真空条件下完成细菌样品的直接检测,非常适合大分子量生物分子的分析。然而,MALDIMS仍有一些局限性。例如,在真空条件下采样可能会限制不稳定或挥发性小分子的检测,同时基质的应用可能会破坏细胞结构,这会影响表型分子的检测。此外,MALDI-MS更适用于直接检测革兰氏阴性菌细胞膜或外泌代谢表型分子的分析。然而,对于直接检测革兰氏阳性菌,需要提前对细菌细胞样品进行预处理,例如破坏细胞结构或获取全细胞裂解液。
AI-MS技术的发展突破了经典电离方法中有关真空和负压的限制。除了质谱本身的优点外,AI-MS在微生物菌株检测和筛选中具有以下优势:①常压敞开源,与真空电离源和常压封闭源不同,AI-MS可在敞开的大气压环境中进行原位、表面和实时采样分析活菌落,并可现场提取DNA;②高通量性,无复杂样品前处理和色谱分离,单个样品分析时间短,分析过程快速直接;③非标记的活体检测,可作为通用工作流程,满足许多不同生物催化反应的筛选需求;④质谱成像,可视化菌落细胞表型分子的空间分布,以有效确认微生物菌株的身份。因此,AI-MS在合成生物学微生物菌株检测和突变文库筛选研究中具有重要作用。然而,AI-MS技术在微生物完整细胞分析方面存在一些局限性,这些局限性与AI源构造和电离机制相关。基于电喷雾的AI-MS技术本身是一种表面分析技术,适合直接检测微生物细胞表面分子,如外泌分子、细胞壁或细胞膜上分子。然而,AI源的电离能不足以直接解吸和电离胞内分子,这使得利用此技术难以进行胞内分子的直接检测。同样,基于等离子体的AI-MS技术由于电离能的限制也无法直接检测微生物细胞。基于激光的AI-MS技术利用激光的能量来解吸细胞分子,并通过二次电离实现分子的电离。例如,LAREI-MS通过直接检测细胞脂质来筛选菌株,这些脂质主要为磷脂,是细胞膜的主要成分之一。然而,基于激光的AI-MS技术在检测微生物完整细胞时尚未能直接检测胞内代谢表型分子。因此,为了解决微生物突变文库筛选中的共性技术问题,需要通过提高细胞解吸和电离效率来改进AI-MS技术,例如使用强有机试剂或高能量脉冲激光来高效释放胞内表型分子,并使用改进的AI源来提高细胞表型的电离效率。这些改进是AI-MS技术的发展方向。
目前,AI-MS技术已经成为一种成熟的技术,在完整微生物细胞分析中具有重要的应用价值。然而,在微生物突变文库高通量筛选研究领域,AI-MS仍处于发展阶段,并且要实现高通量筛选的标准化、自动化还需要进一步的努力。为了实现这一目标,需要打破专业技术壁垒,融合生物、化学、机械、计算机、信息学等多种学科,建设通用高通量筛选质谱设备和方法体系,为微生物细胞工厂开发提供共性技术平台。基于AI-MS的高通量筛选策略在未来的合成生物学研究中将发挥重要作用。

