微液滴高通量筛选方法的研究与应用进展
秦伟彤,杨广宇
(上海交通大学生命科学技术学院,微生物代谢国家重点实验室,上海 200240)

高通量筛选(high-throughput screening,HTS)是药物发现过程中的重要环节,也是阐明基因和蛋白质功能的重要工具,它已被广泛应用于生物技术和制药领域[1-5]。通常认为HTS样本筛选通量大于103个/天及小于105个/天[6]。但是就以蛋白质进化为例,通过易错PCR的手段很容易就构建出库容量为1010的突变体文库[7],尽管自动移液工作站的出现减少了部分人工操作,但是所需的成本仍然较高,且样本的筛选通量小于106个/天,因此对大量生物样本库进行特定代谢物、酶、核酸、表型或突变的筛选逐渐成为一项重大挑战[8-9]。如何实现低成本、高速度、高特异性以及高灵敏度的筛选是HTS所面临的主要问题。
微流体系统最早出现于20世纪80年代,是一种精确操作微尺度流体(10-6~10-18L)的技术,可以将多个操作单元,比如液滴的生成、信号检测和分选等集成到一个芯片上,并自动完成整个分析过程,因此也被称为“芯片实验室”[10-11]。它的优点是样品消耗低、反应快速且具有并行处理的能力,这也使得样本的筛选通量提高到了108个/天,试剂的消耗量也降低为传统的微孔板筛选的百万分之一,为HTS领域带来了革命性的改变[12-14]。
传统的微液滴筛选系统(以酶进化为例)主要是通过将表达有不同酶突变体的菌株以及反应底物进行单细胞包裹,将液滴在芯片上或芯片外孵育特定时间,最后根据设定的筛选电压阈值,阳性液滴在介电泳(dielectrophoresis,DEP)作用力下进入收集通道,从而实现分选[15-16](图1)。液滴的生成方式已经有很多种,包括油包水(water in oil,W/O)、水包油包水(water/oil in water, W/O/W)、水凝胶珠的形式,液滴的体积也从纳升到皮升不等[14,17-19]。每个液滴均为一个独立的微反应器,从而能够分析从细胞内表达或由细胞分泌的酶功能,克服了传统流式细胞术和荧光激活细胞分选只能用于检测与细胞直接关联的荧光信号的限制。液滴信号检测与分选的方式也根据不同实验的需求,发展出了更多种类的液滴分选器[20]。
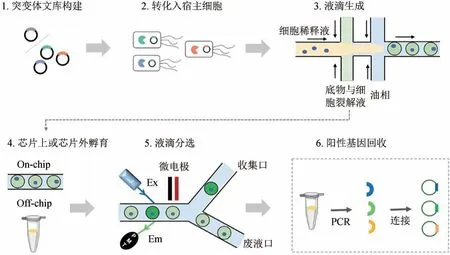
图1 传统的微流控分选流程示意图Fig. 1 The scheme of traditional microdroplets sorting devices
传统的基于微流体的液滴分选主要依赖于激光诱导荧光检测,以及荧光激活的微液滴分选系统,但是特别针对一些小分子药物及大部分酶分子,缺乏适用的荧光探针,而极大地限制了该系统的应用[21]。自Link等[22]于2006年开发了首套利用静电力实现液滴分选的设备以来,相继有不同原理的微液滴超高通量筛选系统被开发出来。按信号识别方式区分,包括结合荧光光谱[12]、吸收光谱[21]、分析质谱[23]、拉曼光谱[24]、电化学技术[25]、核磁共振[26]、图像识别[27]等技术;按控制液滴的偏转驱动力不同,又可以分为电[28]、声[29]、磁[30]、气动[31]或者热学[32]等系统。本文主要针对目前已开发出的不同的微流控筛选设备,根据检测信号的不同将其分为标记与无标记液滴分选技术,对其发展情况和使用情况进行了总结,并讨论了目前微液滴分选设备所存在的局限性及未来的发展方向。
1 标记液滴分选技术
标记液滴分选技术通常不是基于所测定的细胞或者酶分子本身的特征进行分选,而是需要引入化学分子或者荧光探针来间接实现分选。主要包括依赖于荧光信号的荧光激活液滴分选(fluorescence-activated droplets sorting, FADS)和基于紫外/可见光吸收变化的吸光度激活液滴分选(absorbanceactivated droplets sorting, AADS)技术(图2)。
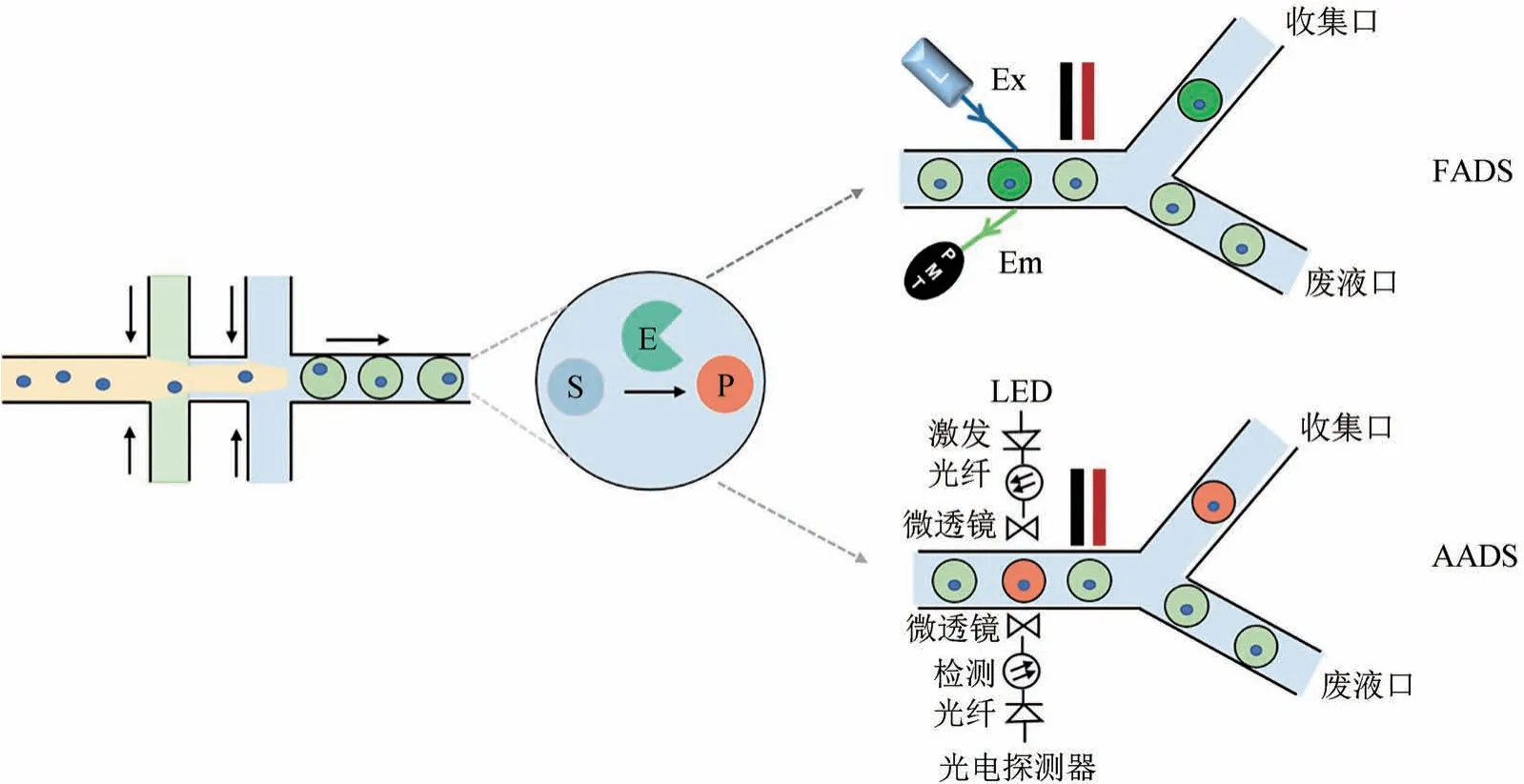
图2 标记液滴分选技术分选原理Fig. 2 The principle of labeled droplet sorting technology
1.1 荧光激活的液滴分选技术
荧光激活的液滴分选是目前主流的微流控筛选技术,其主要是通过设计不同的荧光探针或者酶级联反应来直接或间接实现目标酶基因型与荧光的耦联,因此具有更高的灵敏度[19,33-35]。与荧光激活细胞分选(fluorescence-activated cell sorting,FACS)原理相似,但是FADS与FACS相比最大的优势是其可对细胞内、细胞上、分泌到细胞外的信号以及无细胞体系进行分选,同时由于其配置了高速相机,能够实现分选的可视化[36]。FADS与其他液滴分选技术相比,另外一个优势是处理微液滴的分选通量高达5000个/s。目前已被成功应用于脂肪酶[33]、酯酶、纤维素酶[13]、淀粉酶[37]、聚合酶[38]等酶分子的改造。
经过十余年的发展,研究者们也对传统的FADS系统进行了升级改造。比如Ma等[17]开发了一套双色荧光分选体系,可以同时处理来自相同液滴的两个荧光信号,筛选出了具有高酶活性和高对映选择性的黄古珠酯酶突变体。Hasan等[39]开发了一种荧光寿命激活的液滴分选系统(fluorescence lifetime-activated droplet sorting,FLADS),但该系统的分选通量只有50个/s。Blaha和Hasan等[40]进一步通过对活细胞与死细胞进行精确的液滴分选证明了FLADS的可行性。此外,Hung等[41]优化了信号处理的硬件,并将分选通量提高到了2500个/s。
目前FADS技术也存在一些缺点,比如需要根据不同的酶分子及催化反应开发合适的荧光探针,而对于某些酶分子、不常见的细胞以及靶向分析物为小分子药物的实验,则缺乏适用的生物标记物和荧光探针,导致无法构建荧光耦联策略。同时选用的荧光探针还需保留在液滴中,不能发生扩散等问题。这些也极大地限制了FADS的广泛应用。为了克服FADS的局限性,其他种类的液滴分选技术比如吸光度、质量和拉曼等激活的液滴分选技术也相继被开发出来(表1)。

表1 不同微流控分选设备比较Table 1 Comparison of different microfluidic sorting equipment
1.2 吸光度激活的液滴分选技术
吸收光谱法被广泛应用于比色测定、蛋白质定量和酶动力学等方面[51-52],近年来科研人员也将其与微流控技术进行耦联,开发出了吸光度激活液滴分选技术AADS,实现了与FADS技术的互补[21]。与FADS相比, AADS检测的挑战是吸光率与路径长度成正比,这意味着液滴的小体积(pL)以及由此产生的短光路长度(μm)会影响检测的灵敏度[21,53]。Gielen等[21]首次介绍了一种使用介电泳和光纤的AADS系统,在液滴的吸光度被读出后再对液滴进行分选,分选通量约为300 个/s。但是他们声称在液滴中染料的浓度低于100 µmol/L时则无法完成分选,因为油相和水相的不同折射率会产生信号伪影,只能通过添加偏移染料来降低信号伪影。随后,Duncombe等[53]开发了一种基于全紫外可见光谱激活的液滴分选系统(UV-vis spectra-activated droplet Sorter,UVADS),将光路路径长度从50 μm增加到300 μm,但由于是全光谱,液滴的分选通量低于100 个/s。最近,Medcalf等[44]报道了一种集成双凹透镜聚焦、声表面波(surface acoustic wave,SAW)分选和吸光度激活的液滴分选系统,使其分选通量提高到了103个/s水平,同时使用折射率匹配油,通过去除侧面散射来提高信号质量,可对浓度差为50 μmol/L的液滴进行分类。理论上来讲,AADS可能会有更高的应用价值,相较于FADS更加具有普适性,因为大多数小分子在电磁光谱的紫外线和可见光区域均可表现出吸收。
2 无标记的液滴分选技术
无标记的液滴分选技术不需要添加额外的化学分子,而是利用检测的反应、化合物或细胞本身的物理或化学变化,来实现信号的检测与分选。目前已开发出了与质谱技术、拉曼光谱、核磁共振、电化学及图像分析等技术相结合的无标记分选技术(图3)。但是该类方法通常需要耦联不同的技术与特殊的设备。

图3 无标记液滴分选技术分选原理Fig. 3 The principle of unlabeled droplet sorting technology
2.1 质量激活的液滴分选技术
质谱(mass spectrometry,MS)是一种无标记的检测技术,并已成为通用的分析技术[55]。然而,传统的液相色谱-质谱法(liquid chromatographymass spectrometry,LC/MS)由于色谱分离而耗时,并且需要相对较大的样品体积,这对于HTS来说成本过高[56]。而质量激活液滴分选技术(mass activated droplet sorting, MADS)则是将微流控技术与MS的优势相结合,兼具高灵敏性、高选择性、低成本、可同时分析多种产物等优点[23]。Sun等[57-58]引入了第一种高通量液滴质谱法,证明了该系统样本筛选通量为1.7个/s,分析速度比传统的LC-MS快300倍左右。随后,Steyer等[59]开发了一种通过纳米-电喷雾电离(electrospray ionization,ESI)分析液滴的平台,它可抵抗基质效应从而实现样本的快速分析。尽管基于MS的液滴分选方法已经被证明了具有可行性,且相继有更多的改进方法逐渐被开发出来,但是在处理过程中液滴的损失限制了其在液滴分选中的应用。
为了克服这些限制,Holland-Moritz等[54]开发了一套真正意义上的基于ESI-MS激活的液滴分选系统,该系统整合了液滴分隔模块,由连接到质谱仪的微流控芯片和进行液滴计数的相机监控的分选区域两部分组成,注入到芯片中的液滴被分割成两个大小不等的液滴,较大的液滴进入质谱仪通道用于信号检测,较小的液滴则进入分选通道,两个通道之间具有一条延迟线,以保证液滴在经过质谱仪的检测后,另外一个同级液滴才进入分选通道[图3(a)]。该系统的样品分选通量可达0.7个/s,分选准确率约98%。尽管该系统处理样本的速度约为FADS的1/1000,但得益于质谱所固有的无标记特性,MADS几乎可以测定任何产物,且可以同时分析多种物质,证明了基于任何类型的测定信号进行微液滴筛选的可能性。
2.2 拉曼激活的液滴分选技术
拉曼光谱的原理是通过激光与样品相互作用时产生的化学键的振动和旋转来获取分子的信息,已广泛应用于物理、生物、化学、工业和医药等领域[60]。而拉曼激活的液滴分选技术(Ramanactivated droplet sorting,RADS)是一种无标记、无损伤的单细胞识别与分析技术,其整合了单细胞拉曼光谱(single-cell Raman spectra,SCRS)与液滴微流控技术,通过利用介电的单细胞捕获释放和电磁阀吸吮技术,在高速流动的状态下捕获单细胞,并实现拉曼采集、释放和分选[24]。该技术最大的缺陷是容易受油相和液滴中光学畸变的影响,在不使用表面增强技术的情况下灵敏度较低,使得这项技术很难应用于一些复杂的基质中。为了克服这些缺陷,Wang等[48]采用了液滴“先选再养”的方式,即先捕获单细胞的拉曼信号,再进行液滴包裹,并采用基于介电力驱动的方式,克服了制约通量提高的电磁阀作为分选驱动力的瓶颈问题,同时将芯片的材料PDMS替换成石英,使得该系统的细胞分选速率和灵敏度得到了较大的提升,分别达到了260个/min及98.3%[图3(b)]。Safir等[61]开发了一套基于人工智能辅助拉曼光谱与生物打印相结合的系统,用于血液中细菌的高通量检测。理论上来讲,RADS适用于所有类型的细胞,具有更广阔的应用前景。但目前,基于拉曼光谱的应用仍需要高拉曼强度和大的细胞散射截面。当将基于拉曼光谱的微液滴分选系统(droplet microfluidic screening systems,DMFS)应用于小型细胞如大肠杆菌时,则需要额外的优化。
2.3 核磁共振激活的液滴分选技术
核磁共振激活的液滴分选技术(nuclear magnetic resonance activated droplets sorting, NMRADS)相较于MADS,既是无标记分选技术,也是一种无损伤分选技术。NMR能够同时识别和量化数百种不同的复杂混合物中的化合物,提供了无与伦比的化学特异性。因此将其与微流控技术相结合,具有巨大的吸引力,但同时也是较大的挑战[62-63]。从NMR的角度来看,一类特别具有挑战性的集成功能元件是导电结构[26]。金属电极可用于电化学样品相互作用,然而它们可能导致严重的NMR光谱和SNR(signal to noise ratio,信噪比)退化。在微观尺度上这些问题更为复杂,因为畸变体积占据了样品体积中的更高比例[26]。此外,NMR与其他检测方法相比,检测的质量灵敏度较低(小于1 mmol/L)。核磁微线圈则是针对这些限制所开发的,但是将微线圈与小样本进行对接挑战较大[64]。
Swyer等[65]介绍了第一个NMR数字微流控系统,能够在高场NMR中实现微线圈中分析物与液滴的对接,可以观察木糖-硼酸盐络合和葡萄糖氧化酶催化等过程,但并没有实现分选。Davoudi等[26]通过将金属轨道放置在微流体通道的侧壁中,开发了一种NMR兼容的微流体平台[图3(c)],发现NMR射频激发性能得到了增强,而不影响静磁场的均匀性,从而能够在进行沉积的电极表面或处理室中的电极下方进行直接光学观察。这也为进一步实现NMR激活的液滴分选提供了技术基础与研究思路。
2.4 电化学激活的液滴分选技术
电化学检测同样也是一种无标记、无损伤的检测方法,可应用于复杂样品的检测。但是由于检测电极表面尺寸的限制(尺寸必须小于液滴),液滴的尺寸通常只能控制在纳升级别。Goto等[25]开发了一套可针对NADP依赖性氧化还原酶定向进化的电化学激活液滴分选系统(electrochemical-based droplet sorting,ECDS),通过将NAD(P)H测定装置与DEP分选设备相耦联[图3(d)],将酶促反应产生的电化学信号转化为交流信号,对约30 nL的液滴进行了分选,成功将酶的活性提高3倍左右。该方法检测的灵敏度约为1 μmol/L,但是液滴筛选通量也较低,约为10个/s。
Abbyad组[66]提出了一种基于界面张力(sorting based on interfacial tension,SIFT)的分选方法,通过利用不同pH值会产生不同界面张力的液滴的原理,低pH导致液滴的高界面张力,并且具有较低pH的液滴会倾向于沿着芯片上的轨迹流动,因此不需要额外的电极来进行区分。该方法可区分pH差异为0.2的液滴,最大分选速率约为30 Hz。Dobson等[67]利用特定的表面活性剂会导致界面张力对液滴pH非常敏感的原理,成功将此分选方法用于凋亡细胞的分离研究中。Zielke等[68]也基于SIFT原理,成功对具有不同水平糖酵解的细胞(癌症细胞亚群)进行了分离。
2.5 基于图像分析的液滴分选技术
基于图像分析的液滴分选技术(image-based droplets sorting, IBDS)是一种基于液滴内细胞形态,通过图像识别、处理与分析来实现分选的无标记分选技术[图3(e)][27,69]。该方法在细胞生物学领域越来越受欢迎,部分原因是近年来通过多项研究提高了图像处理算法、接口速度和处理硬件性能。Doan等[70]利用小波分析实现了液滴中细胞形态区分,该方法分选精度可达90%,液滴分选通量约为10个/s。Watterson等[69]也开发了一种基于小波的图像分析方法来测量液滴的光密度,指示液滴中细菌的数量,该方法被成功应用于分析患者样本中的抗生素耐药性,并揭示了21个细菌种群。Anagnostidis等[50]开发了在深度学习引导下的IBDS系统,证明了深度神经网络可以准确地对单个哺乳动物细胞和多细胞球体的存在和数量进行实时液滴成像分析。这种方法还能够从含有不同类型和大小对象的混合物中识别出特定对象,可用于快速揭示细胞和多细胞结构的异质性。
3 应用领域
3.1 酶的定向进化与新酶挖掘
酶是自然界存在的最重要的生物催化剂,经过自然界数千年的自然进化已被应用于各个领域[71-72]。但是天然酶往往无法满足工业需求,所以人工选择和筛选变得越来越重要[24,73]。定向进化是在实验室条件下模拟“达尔文进化”的原理,快速进化出具有目标性能的突变酶,为酶进化提供了强大的工具[74-77]。但是定向进化面临的最大问题是传统的微孔板筛选方法无法满足庞大的库容量筛选的需求[78],同时工业和制药领域对一些新型的、性能更优的微生物催化剂的需求也持续快速增长[79]。所以酶的定向进化和新酶的挖掘直接受益于液滴微流控的发展,为酶反应提供了单独的反应环境和更大的筛选容量。
我们对近五年利用液滴分选系统成功实现定向进化以及新酶挖掘的案例进行了简单的总结(表2)。

表2 近五年微流控分选装置成功应用的案例Table 2 Cases of successful application of microfluidic sorting devices in the past five years
Ma等[17]利用双色荧光的FADS系统将酯酶对S-布洛芬的对映选择性提高700倍左右。Tan等[88]在红海环境样本中成功挖掘到了3种新的脂肪酶。Zurek等[83]开发的AADS液滴分选器已成功用于胺脱氢酶的定向进化,使其转化率提高了3.28倍。随后,Zachos等[87]开发的AADS液滴分选设备使葡萄糖脱氢酶的催化速度和效率提高至少10倍。但是统计的10个案例中有8个应用了FADS系统,说明尽管研究人员已经开发出了多种微流控分选设备,目前针对酶进化和新酶挖掘的方法仍然以FADS分选系统为主。
除了酶工程领域外,微流控分选技术在微生物挖掘和定向进化方向也具有巨大的应用空间[89],比如Qiao等[85]从环境样本中利用FADS系统分选出了可降解塑料的Kineococcus endophyticusUn-5和Staphylococcus epidermidisUn-C2-8菌株。Xu等[86]开发出了一套新的转录相关的FADS系统,并从原油中筛选出了10种产生更多鼠李糖脂的微生物,它们产生的鼠李糖脂比铜绿假单胞菌PAO1模型多54%~208%。Bowman等[90]利用FADS分选系统从溶脂雅罗菌转座子突变体库中,在菌株培养的早期鉴定出了衣康酸生产力提高的菌株。
3.2 细胞的分选与分离
病原微生物的快速灵敏检测在食品工业、医学等众多领域至关重要。例如在药物实验室中,医疗产品的污染可能会给患者带来严重的健康风险,如败血症[91-93]。微流控筛选设备可以极大地帮助研究人员从复杂环境中分离病原体,Li等[94]利用声电泳分选方法,通过在微通道上施加强烈的声波,流动的颗粒会根据它们的大小进行分类,成功地分选了大肠杆菌和人类血细胞的混合物,得到的含有细菌的溶液显示出超过96%的细菌纯度(低于4%的血细胞)。Ohlsson等[95]又优化了声电泳分选方法,使得细菌回收率高达99.7%,或血细胞去除率高可达99.99%。此外,Hyman等[96]基于环介导的等温扩增技术,开发了一种单细胞转录谱分析和分选的系统(single-cell nucleic acid profiling in droplet,SNAPD),可用于量化不同的细胞异质种群中的类型,检测到频率低至0.1%的罕见细胞,并使用微流体分选富集特异性的细胞类型(图4)。

图4 SNAPD工作流程图[96]Fig. 4 Schematic of the SNAPD workflow[96]
3.3 单细胞分析及药物筛选
单细胞技术对免疫学领域有着重要的影响。它能够阐明免疫信号传导和免疫细胞迁移的动力学和逻辑,促进抗体筛选,并允许对B细胞和T细胞库进行大规模并行分析。基于微流体的技术实现的高时空控制使得对免疫信号、细胞迁移和细胞间相互作用的理解增加了一个强大的手段[97]。Mazutis等[98]开发了首套可应用于单细胞分析及抗体筛选的液滴微流控分选系统。他们将单个小鼠杂交瘤细胞、荧光探针和包被抗小鼠IgG抗体的单个微珠共包裹在50 pL液滴中,仅在15min后检测分泌的抗体,分选速率约为200 Hz(图5)。Shembekar等[97]研发了一套基于双色荧光策略的微流控分选平台,并引入了液滴捕捉与成像技术,不仅可以定性地对表达的抗体进行分类,还可以定量地对特异性抗体结合以及与天然细胞表面受体的结合进行分类。除了抗体筛选之外,Baranova等[99]还基于单细胞共培养微生物组以及乳液中的报告荧光病原体,使用荧光激活的细胞分选来选择无报告液滴,开发了一组革兰氏阴性菌大肠杆菌的报告菌株,以提供用于精确监测抗菌活性的活体生物传感器,可以有效地用于抗生素/益生菌的发现、环境监测和生物学合成。

图5 应用微流控分选设备进行抗体筛选的流程图[98]Fig. 5 The scheme of antibody screening using microfluidic sorting device[98]
4 总结与展望
微流控技术的快速发展为细胞及液滴的分选提供了强大的技术支撑。该技术在提高分析率的同时显著减少了样本分析量,从而能够在大容量突变库或者微生物群体中快速识别出罕见的或者活性提升的靶标。而微流控分选装置主要包括液滴的生成、孵育、操作与分选,经过近些年的发展,前三个步骤已相对成熟且已有商业化的装置,因此最主要的限速步骤是液滴的分选。
FADS具有更高的筛选速度(kHz水平)和最高的灵敏度(nmol/L级别),是目前发展最成熟以及应用最广泛的微流控分选系统。如果能够找到合适的荧光探针或荧光耦联反应实现基因型与表型的耦联,FADS依旧是所有分选方法的首要选择。AADS的检测灵敏度虽然低于FADS,但AADS系统不需要激光器和光电倍增管,因此其装置比FADS更简单、更便宜,在检测灵敏度符合要求的情况下,AADS会是较不错的选择。当然也有将FADS与AADS进行结合,开发出的FAADS(fluorescence and AADS)系统,既可以获得荧光值,也可以获得光密度值,可以为研究提供更多的信息[100]。
无标记的分选设备因其不需要特定的荧光探针、能够保证细胞及反应的完整度等优势而受到越来越多的关注,也为研究者提供了更多的选择空间。但是该类分选设备所面临的共性问题是分选效率与检测灵敏度较低。MADS是探测化学物质的一种很有价值的工具,检测的范围扩大到只要能够利用ESI电离的分子,而利用FADS与AADS均是无法实现的。对于筛选化学反应,检测质量变化的能力比光谱变化更适用。RADS是无损伤的分析方法,有助于与细胞中DNA、RNA、蛋白质和代谢产物的下游提取进行无缝整合,以进行进一步分析。NMR-ADS可以提供更全面的信息,但是目前还未实现分选。然而,RADS与NMR-ADS均需要特殊的技术来建立分选系统。对于基于电化学的分选方法,也没有标准化的分选装置,甚至可能需要根据各种电化学特性进行定制。
尽管目前已经开发出了多种微流控分选装置,但是真正商业化的设备却很少。首先,不同的生物学应用需要不同的检测方法,很难开发出一个通用的微流控分选设备,同时市场有限,集成化的设备商业化也很难。其次,微流控分选设备需要高精细的元件,搭建平台也需要实验室有一定的基础。此外,微流控分选设备的整个流程十分依赖人为操作且流程较复杂,也进一步限制了该类系统的通用性。未来还需要在这一方向进一步改进与努力,从而提高商业性的微流控分选设备的通用性。
总之,本文从信号的检测方法方向综述了微流控分选设备的发展情况与应用情况。尽管FADS仍然是细胞分选的首要选择,但是许多研究开发出了多种微流控分选设备,也进一步扩大了微流控分选设备的应用范围。其超高的筛选通量与独立的反应环境为不同领域(包括蛋白质工程、抗体筛选、不同种类细胞的分选及临床方向)的研究提供了新的技术平台。随着更多新技术的发展,比如人工智能、生物打印技术等的发展,也会为微流控分选设备赋予更多应用。

