基于网络药理学和GEO数据集的翻白草治疗2型糖尿病分子机制探讨
何旭,马鑫彦,赵薇,张印江,鲁碧楠*,庞宗然*
1.中央民族大学 药学院,北京 100081;
2.民族医药教育部重点实验室,北京 100081;
3.大理白族自治州人民医院 药剂科,云南 大理 671000
全球疾病负担数据显示,全球约有4.62 亿人患2 型糖尿病(T2DM),相当于世界人口的6.28%,预计2030 年,全球T2DM 患病率将达到7.08%,T2DM 已成为全球健康领域的一种公共卫生负担[1-2]。近30 年来,我国糖尿病患病率明显上升,2015—2017 年我国18 岁以上人群糖尿病患病率上升至11.2%,T2DM 患者占糖尿病人群的90%以上[3-4]。糖尿病发病率高、合并症多、用药周期长及传统降糖药物的不良反应等问题给糖尿病的防治带来巨大的挑战。
翻白草Potentilla discolorBge.因叶片面青背白而得名,为蔷薇科(Rosaceae)委陵菜属植物翻白草的带根全草,其味甘、微苦,性平,归肝、胃、大肠经。翻白草是凉山彝族人民长期使用的一种药物,彝族语称为“期涛景”,彝族医将其用于治疗疟疾、痢疾、风湿痛和月经不调等[5]。现代药理研究表明,翻白草具有降血糖、调血脂、抗氧化、抗菌、抗病毒、抗炎镇痛、抗肿瘤等多种活性[6-10]。Meta分析结果表明,翻白草提取物能够显著降低T2DM 小鼠的血糖水平及血清中胆固醇(TC)和三酰甘油(TG)的含量[11]。翻白草总黄酮可以显著改善T2DM db/db 小鼠糖脂代谢紊乱和胰岛素抵抗,减轻肝脏和胰腺组织的病理损伤,通过降低血清中空腹血糖(FBG)、糖化血清蛋白(GSP)、TC、TG、空腹血胰岛素(FINS)、丙二醛(MDA)水平,提高高密度脂蛋白胆固醇(HDL-C)、超氧化物歧化酶(SOD)水平,提高肝脏组织磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)信号通路中胰岛素受体底物-1(IRS-1)、葡萄糖转运体4(GLUT4)蛋白表达水平和p-PI3K/PI3K、p-Akt/Akt,发挥防治T2DM作用[12]。此外,翻白草水提物能够降低高脂饮食和链脲佐菌素诱导的T2DM 小鼠肝脏中磷酸烯醇丙酮酸羧激酶(PEPCK)和葡萄糖-6-磷酸酶(G6Pase)mRNA 水平,增加糖原合酶激酶3β(GSK3β)的磷酸化,通过调节糖异生和糖原合成来改善肝葡萄糖稳态[13]。民间偏方中翻白草代茶饮能够降低血糖,目前已有翻白草治疗T2DM的临床报道,30~100 g·d-1开水冲泡代茶饮,能够取得较好的治疗效果,显著降低T2DM 患者的空腹血糖和餐后2 h血糖水平[14-15]。但目前尚缺乏对翻白草治疗T2DM 作用机制的全面和系统的研究。鉴于此,本研究基于网络药理学结合GEO 数据集探讨翻白草治疗T2DM 的分子机制,为翻白草的临床应用提供更多的理论依据。
1 资料与方法
1.1 T2DM GSE系列获取
在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中,以“type-2 diabetes mellitus”“DM2”“T2DM” 词条进行检索,来源选择“Homo sapiens”,系列类型选择“Expression profiling by array”,获取符合条件的GSE系列。
1.2 T2DM差异基因分析
使 用R 4.2.1(https://www.r-project.org/)中GEOquery程序包对基因芯片数据进行下载,提取表达矩阵,对原始数据进行log2转化,采用normalizeBetweenArrays 函数对数据进行归一化处理后提取临床信息。
使用FactoMineR 和factoextra包对正常对照组和T2DM 组数据进行主成分分析(PCA),使用limma程序包对两组进行差异基因分析,界定条件为|log2FC|>1(FC为差异倍数)且P<0.05,绘制火山图。
1.3 翻白草作用靶点预测
在中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)中检索翻白草化学成分[16],在SwissADME 数据库中根据化学结构,结合口服生物利用度和类药性五原则对各成分进行筛 选[17],在SwissTargetPrediction 数据库(http://swisstargetprediction.ch/)中选择种属为“Homo sapiens”,预测各成分的可能作用靶点[18]。在微生信在线平台获取T2DM 差异基因和药物作用靶点的交集,即为翻白草治疗T2DM的潜在作用靶点。
1.4 生物信息学分析
取T2DM 差异基因和翻白草作用靶点的交集,用clusterProfiler、ggplot2、ggthemes、enrichplot 包,以P<0.05 作基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路分析。采用Cytoscape 3.9.1(https://cytoscape.org/)构建化学成分-靶点-通路网络。
1.5 潜在作用靶点验证
根据KEGG 通路分析结果,确定潜在作用靶点及靶点所对应的翻白草化学成分。PDB 数据库(https://www.rcsb.org/)下载潜在作用靶点的3D 结构,PyMol 2.5 软件(https://pymol.org/2/)对其进行去水和去残基处理,PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载化学成分的2D 结构并在Chem3D 软件中转化为3D 结构后,以潜在作用靶点作为受体,化学成分作为配体,经AutoDockTools 1.5.6 软件(https://ccsb.scripps.edu/mgltools/)进行分子对接。
2 结果
2.1 T2DM差异基因分析
选择GSE7014 表达芯片数据,该芯片集包含6个正常样本和20个T2DM样本,由PCA结果(图1A)可知,正常组和T2DM 组显示出较好的组内重复性和组间区分度。T2DM 差异基因分析结果见火山图(图1B),共有差异基因658 个,其中445 个为表达上调基因,213个为表达下调基因。

图1 T2DM GSE7014表达芯片数据分析
2.2 翻白草治疗T2DM的潜在作用靶点
TCMSP 数据库检索到翻白草化学成分20 个,各成分通过SwissADME筛选和SwissTargetPrediction靶点预测,共纳入靶点785 个(表1),去除重复靶点411个,得到药物作用靶点374个。药物作用靶点与T2DM 差异基因取交集,得到翻白草治疗T2DM的潜在作用靶点17 个,其中9 个表达水平上调,8个表达水平下调(表2)。
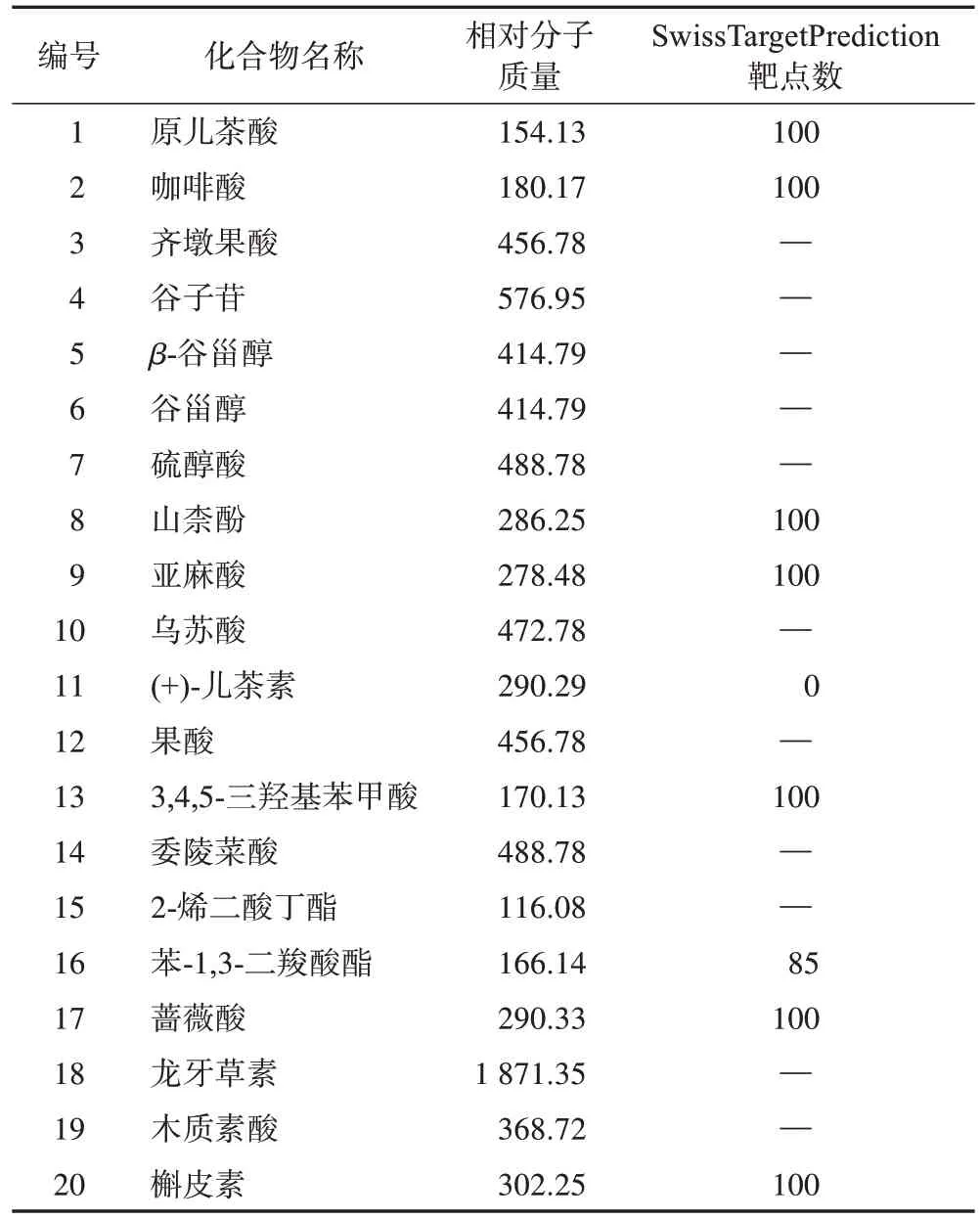
表1 翻白草中20 个化学成分经SwissADME 筛选和SwissTargetPrediction预测结果
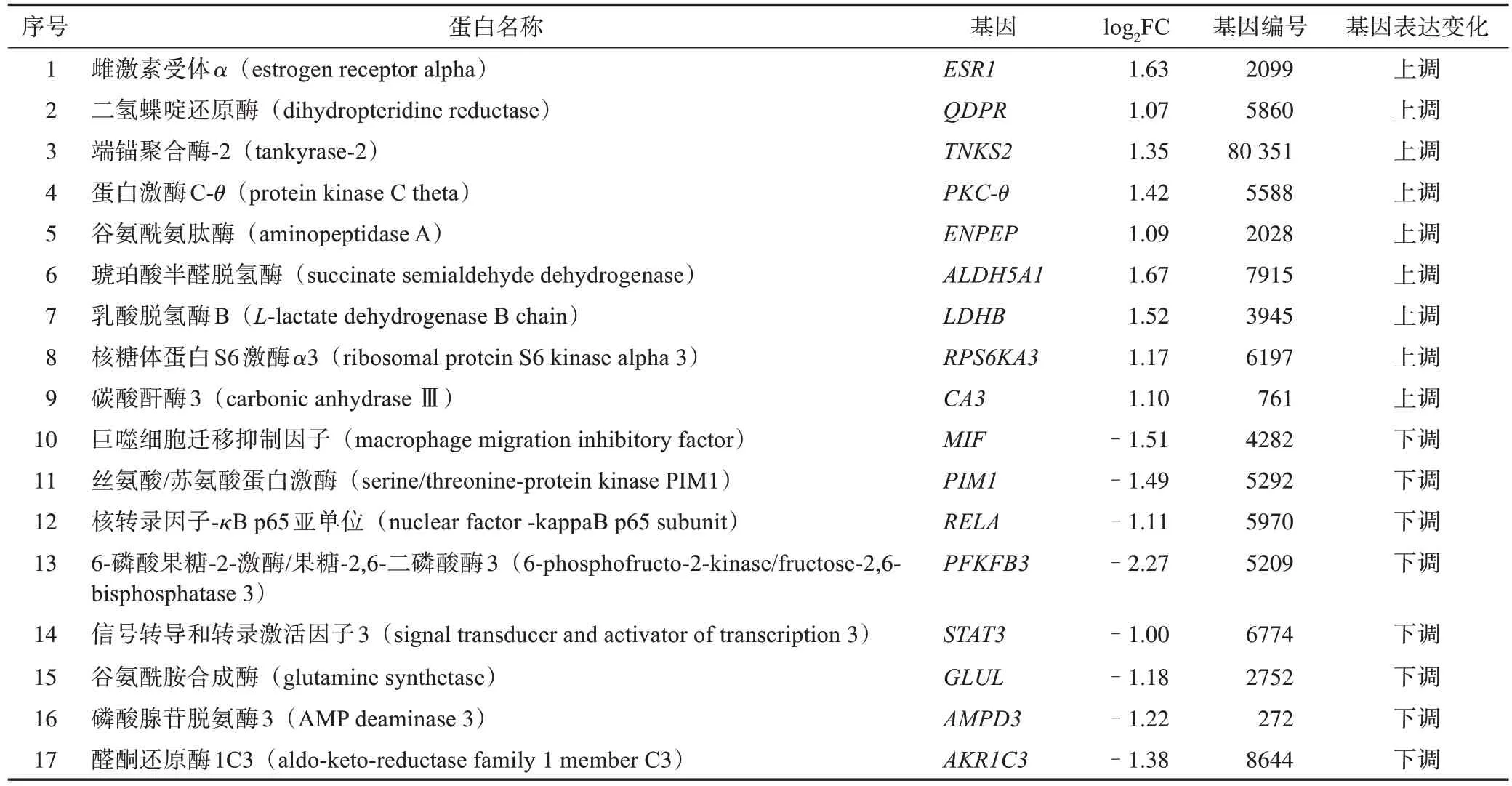
表2 翻白草治疗T2DM潜在靶点信息
2.3 富集分析与靶点-化学成分-通路分析
2.3.1 富集分析结果 对17 个潜在作用靶点进行GO 富集分析,以P<0.05 为界定条件,选取生物过程、细胞组分和分子功能各自的前5 项,用R 软件相应程序包进行富集分析(表3),细胞组分没有富集到显著差异的结果。涉及的生物过程主要有细胞内受体信号通路、DNA 结合转录因子活性的调节、DNA 结合转录因子活性的正向调节、细胞氨基酸分解代谢过程、端粒封顶的正向调节。分子功能主要有氧化还原酶活性 [作用于以烟酰胺腺嘌呤二核苷酸(NAD)或烟酰胺腺嘌呤二核苷酸磷酸(NADP)为受体的供体的醛或氧基团]、结合转录共激活剂、氧化还原酶活性(作用于供体的醛或氧基团)、核受体活性和配体活化转录因子活性。
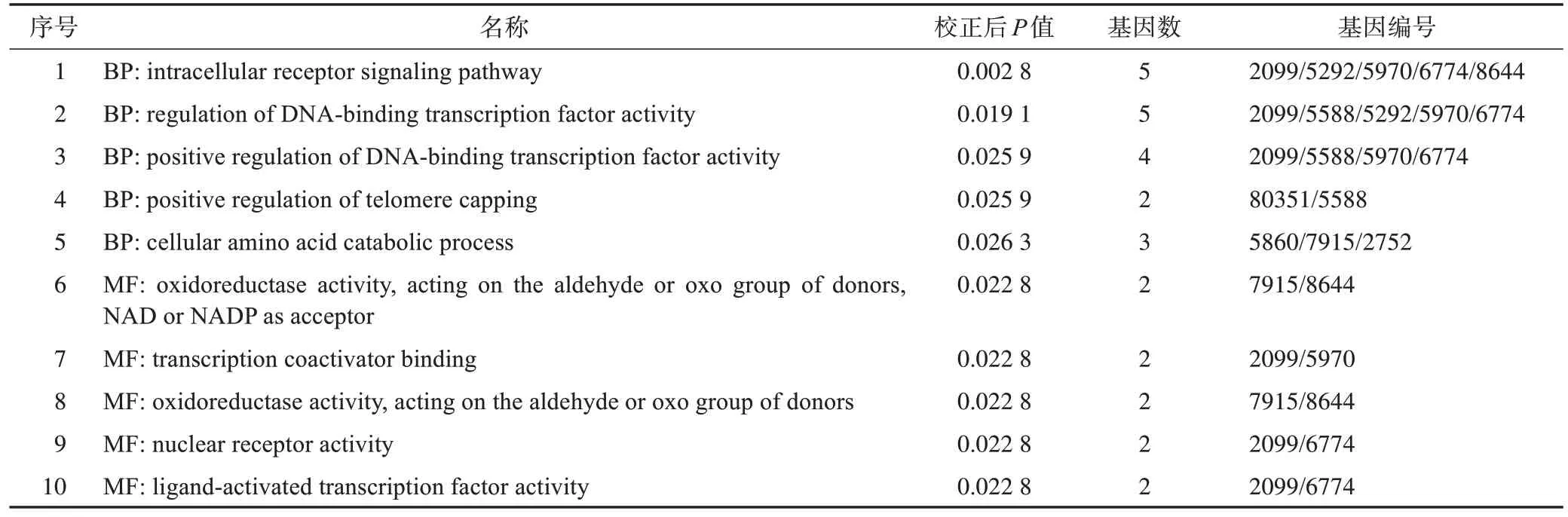
表3 翻白草治疗T2DM靶点的GO富集分析
KEGG 通路分析结果表明,P<0.05 的通路共有12 条,选取前8 条通路(P<0.01)作分析,其中与T2DM 关系密切的有胰岛素抵抗通路、缺氧诱导因子1(HIF-1)信号通路和脂肪细胞因子信号通路,参与的基因有PKC-θ、RELA、RPS6KA3、STAT3、LDHB和PFKFB3(表4)。

表4 翻白草治疗T2DM靶点的KEGG通路分析
2.3.2 化学成分-靶点-通路分析 翻白草治疗T2DM 的主要成分有原儿茶酸、咖啡酸、山柰酚、3,4,5-三羟基苯甲酸、罗索酸等,通过作用于PKC-θ、RELA、RPS6KA3、STAT3、LDHB、PFKFB3 等靶点来发挥治疗作用。构建化学成分-靶点-通路网络,见图2。

图2 翻白草治疗T2DM靶点的化学成分-靶点-通路网络
2.4 分子对接验证
将靶点作为受体,与之对应的翻白草化学成分作为配体进行分子对接,根据亲和力大小,选取与PKC-θ、RELA、RPS6KA3、STAT3、LDHB、PFKFB3结合性能最强的治疗T2DM 的化学成分,作分子对接模式图(图3)。
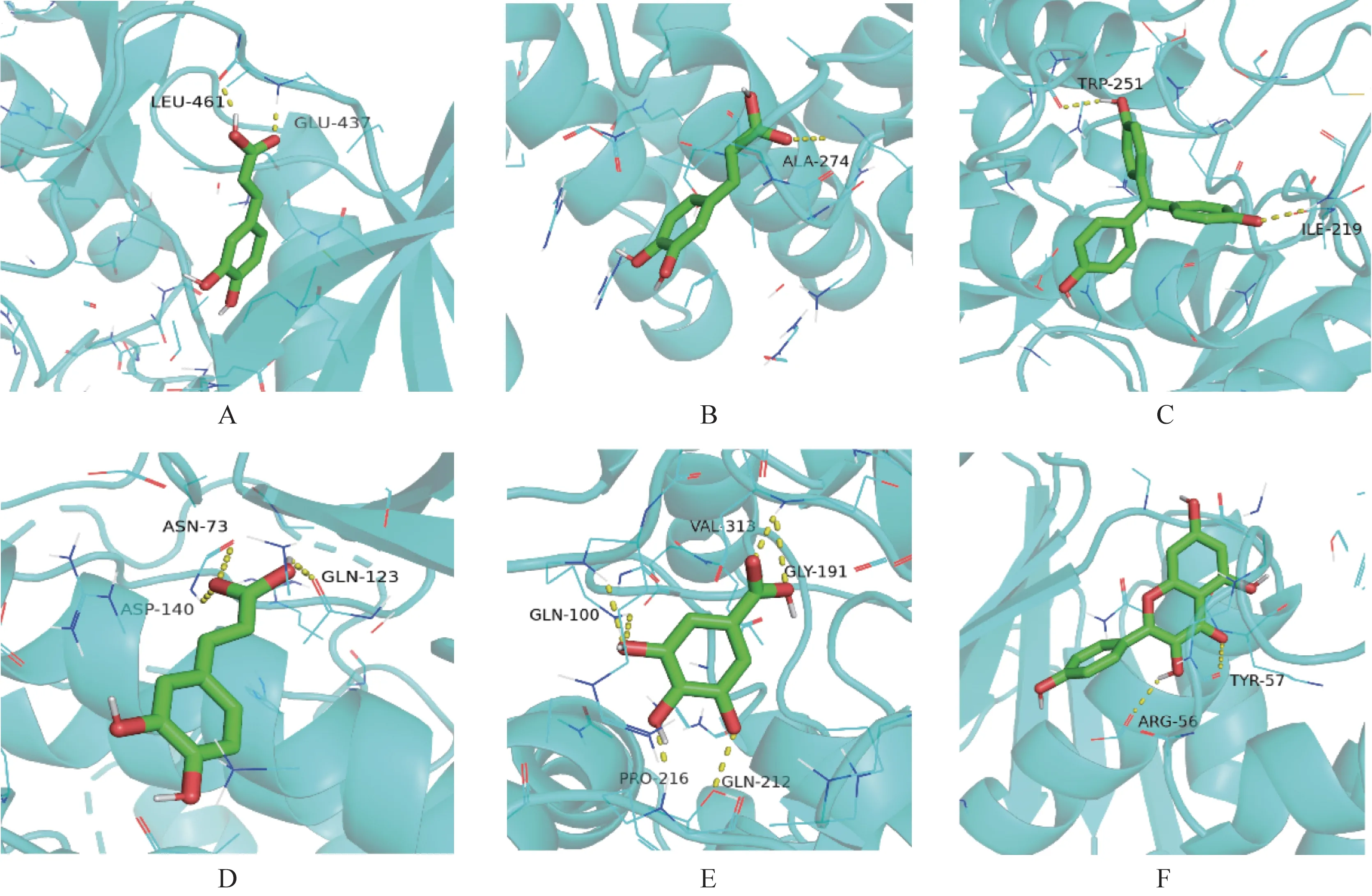
图3 翻白草治疗T2DM靶点与化学成分分子对接模式
3 讨论
网络药理学能够揭示药物化学成分-靶点-通路的整体调节机制,对药物与疾病的相关性进行预测,明确药物治疗疾病的分子机制。与已报道的翻白草抗糖尿病的网络药理学研究方法相比[19],本研究方法的不同之处在于借助GEO 数据库检索出T2DM 基因芯片的GSE 系列,利用R 软件统计出健康人群和T2DM 患者的差异基因,并对化学成分和潜在靶点进行分子对接验证。本研究结果表明,翻白草治疗T2DM 的可能有效成分有咖啡酸、罗索酸、山柰酚、原儿茶酸和3,4,5-三羟基苯甲酸等,分别作用于PKC-θ、RELA、RPS6KA3、STAT3、LDHB、PFKFB3等靶点,通过调控胰岛素抵抗通路、脂肪细胞因子信号通路和HIF-1信号通路来发挥治疗T2DM作用。
胰岛素抵抗是T2DM 的关键致病因素,表现为胰岛素靶向组织对胰岛素生理水平的反应性降低,机制与外周组织中异位脂肪堆积、内质网应激、炎症、活性氧水平、肠道微生物群紊乱、脂肪因子调节失调等相关[20-21]。PKC 家族由3 个不同的群体组成,即常规的(α、βⅠ、βⅡ、γ)、新颖的(δ、ε、η、θ)和非典型的(ζ、λ)。PKC 是丝氨酸/苏氨酸激酶,通过抑制胰岛素受体底物的丝氨酸磷酸化,导致胰岛素信号通路中断,从而导致胰岛素抵抗[22]。PKC-θ分布在免疫系统中,可以促进免疫细胞分泌白细胞介素-10(IL-10)。IL-10在糖尿病发展中表现出关键作用,敲除PKC-θ可减少小鼠体内IL-10的分泌,减少胰岛β细胞质量和胰岛素分泌[23]。肝脏PKC-ε和骨骼肌PKC-θ活性增加,可使TG和二酰甘油含量显著升高,进而引起肝脏和肌肉胰岛素抵抗[24]。RPS6KA3 是与胰岛素抵抗相关的hsa-miR-33a-5p 的靶基因[25],核糖体S6 激酶(RSK)是参与信号转导的蛋白激酶家族。在正常组大鼠和糖尿病组大鼠中,胰岛素能够显著增加各组大鼠后肢骨骼肌中细胞外调节激酶2(ERK2)、p90核糖体S6激酶(RPS6KA3 或RSK2)、Akt 和p70S6 激酶(p70S6k)的活性,与正常大鼠相比,糖尿病大鼠的RSK2 表达和胰岛素刺激的RSK2活性显著升高[26]。S-烯丙基半胱氨酸可以通过调节MEK1/2-ERK1/2-RSK2 信号通路发挥对链脲佐菌素-烟酰胺诱导的大鼠糖尿病肾病的改善作用[27]。
糖脂代谢紊乱是T2DM 发展的重要原因[28],STAT3 是T2DM 的关键转录因子,miR-125a-5p 作为糖脂代谢的调节剂,通过靶向STAT3调控SREBP-1c和PI3k/Akt 通路来抑制肝脏脂质生成和糖异生,提高糖原合成[29-30]。LDHB 是调节SCL2a6 下游乳酸代谢的因子,控制着乳酸和丙酮酸之间的转化,在血糖控制不良的糖尿病患者中,LDHB和PGK1的表达都是上调的[31],SLC2a6 通过靶向LDHB 调节糖酵解,因此SLC2a6-LDHB轴可作为治疗糖尿病相关肌肉萎缩的潜在靶点[32]。PFKFB3介导的糖酵解,对缺血肢体具有显著的保护作用[33]。HIF1-PFKFB3 途径与糖尿病胰岛病理学密切相关,PFKFB3 驱动糖酵解会损害神经元的抗氧化能力,导致神经元丢失和反应性胶质细胞增生,HIF1-PFKFB3 信号通路是糖尿病视网膜病变中多种细胞类型中普遍存在的病理成分,基于该通路靶向的代谢干预点值得在糖尿病视网膜病变中进一步考虑[34-35]。RELA 也被称为p65,是构成NF-κB 转录因子家族的5 种成分之一,诱导p65 NF-κB 和STAT3 的去磷酸化和脱乙酰化,能够减少高葡萄糖引起的氧化应激,细胞凋亡,炎症反应和上皮到间充质转移的进展[36],抑制p65 NF-κB在体内和体外的磷酸化,可以有效缓解db/db小鼠的肾损伤[37]。
作为资源丰富、成分多样、药理作用明确的民族药物,彝族药翻白草具有良好的开发应用前景。本研究通过网络药理学结合GEO 数据集探讨了翻白草治疗T2DM 的潜在靶点和可能作用机制,揭示翻白草是通过多成分-多靶点-多通路协同发挥作用的,从理论层面预测翻白草治疗T2DM 的可能分子机制,后续将采用体内实验进行深入研究。

