调强放射治疗局部晚期鼻咽癌489例远期预后影响因素及晚期安全性研究
胡丹,陈志杰,林燕彬,黎荣光,张汉雄
作者单位:梅州市人民医院头颈放疗科,广东 梅州514031
鼻咽癌是临床常见恶性肿瘤之一,世界范围内每年新发病例超过8万例,且多发于我国南方地区,整体病死率(0.7/10万)亦高于全球平均水平[1]。近年来,调强放射治疗(intensity modulated radiotherapy,IMRT)已成为初治局部晚期鼻咽癌主要治疗手段,而5年总生存(OS)率被证实可超过75%[2-3];但对于初治局部晚期鼻咽癌接受IMRT治疗后远期预后影响因素及晚期损伤研究相对较少,且不同研究间结论差异较大[4-5]。本研究通过评价IMRT一线治疗局部晚期鼻咽癌远期预后影响因素及安全性,旨在为后续优化鼻咽癌临床治疗方案提供更多参考。
1 资料与方法
1.1 一般资料 回顾性纳入2012年1月至2017年12月于梅州市人民医院行IMRT的局部晚期鼻咽癌病人共489例。纳入标准:①病理组织学检查确诊鼻咽癌;②符合美国癌症联合委员会第八版临床分期Ⅲ期及ⅣA期标准;③初次接受治疗;④完成全程IMRT;⑤临床资料完整。排除标准:①复发或转移病例;②合并第二原发肿瘤;③无法耐受放化疗;④拒绝治疗或随访。本研究经梅州市人民医院医学伦理委员会审核批准(批号:梅市伦审2019-C-87)
1.2 方法
1.2.1 治疗方案 鼻咽癌IMRT的体位固定为自然仰卧体位下,以头颈肩一体热塑面罩固定头颈部。定位完成后行CT扫描,扫描范围自头顶皮肤开始向下扫描至气管分叉水平,扫描层厚3 mm。根据国际辐射单位和测量委员会相关报告标准勾画靶区及危及组织器官[6],根据电子鼻咽喉镜、鼻咽+颈部增强磁共振等检查资料将鼻咽部肿瘤和区域转移淋巴结分别确定为鼻咽大体肿瘤体积和颈部转移淋巴结大体肿瘤体积,外扩3 mm确定为鼻咽计划肿瘤体积(PTVnx)和颈部转移淋巴结计划肿瘤体积(PTVnd);PTVnx和PTVnd处方剂量为70~74 Gy/30~33 F,应覆盖≥99%靶体积,且>110%处方剂量体积<20%。根据美国放射肿瘤协作组标准确定危及器官限定剂量。化疗方案是以铂类为基础的单药同期化疗或联合其他化疗药物。
1.2.2 随访情况 随访截止时间为2022年3月,采用门诊复查或电话沟通方式完成随访。治疗结束后前36个月每3个月复查1次,之后每6个月复查1次;记录局部区域控制、无复发生存(recurrence-free survival,DFS)率及OS数据,其中DFS指治疗开始至出现疾病复发或任何原因导致死亡的时间;OS指治疗开始至任何原因导致死亡或随访截止时间;晚期(放疗结束3个月以后)安全性评估依据美国肿瘤放射协作组晚期放射损伤分级标准[7]。
1.3 统计学方法 选择SPSS 22.0软件处理数据;单因素分析比较采用χ2检验,以例(%)表示;多因素分析采用Cox回归模型;采用行Kaplan-Meier法计算5年局部区域控制率、DFS率及OS率;P<0.05为差异有统计学意义。
2 结果
2.1 随访生存情况和复发转移情况分析 中位随访时间为90.0(8.0~110.0)个月,5年局部区域控制率为92.64%(453/489),5年DFS率为84.05%(411/489),5年OS率为91.00%(445/489)。随访过程中死亡65例,其中因局部区域复发死亡25例,因远处转移死亡35例,因其他事件死亡5例。随访过程中出现骨转移14例,肺转移7例,肝转移6例,淋巴结转移6例,多器官组织转移24例。
2.2 晚期损伤情况分析 489例病人晚期出现口干、听力下降、皮肤软组织纤维化、吞咽困难、放射性脑损伤、视力下降例数分别为71例,68例,81例,10例,16例,1例,中位发生时间分别为放疗结束后4(3.0~5.0)个月,6.5(4.0~9.0)个月,11.5(7.0~16.0)个月,9.5(6.0~13.0)个月,20.0(11.0~29.0)个月,19.3(13.0~25.5)个月。其中3~4级不良反应包括:3级皮肤及皮下软组织萎缩6例,3级放射性脑损伤3例,3级视力下降1例。3~4级晚期损伤发生率为2.04%(10/489)。
2.3 IMRT一线治疗局部晚期鼻咽癌预后影响因素单因素分析 临床分期均与5年局部区域控制率有关(P<0.05);性别、EB DNA拷贝数、临床分期、N分期均与5年DFS率有关(P<0.05);年龄、EB DNA拷贝数、临床分期及N分期均与5年OS率有关(P<0.05)。见表1。

表1 调强放射治疗局部晚期鼻咽癌489例预后影响因素单因素分析/例(%)
2.4 IMRT一线治疗局部晚期鼻咽癌预后影响因素多因素分析 Cox模型多因素分析结果显示,临床分期是5年局部区域控制率独立影响因素(P<0.05);性别、年龄、吸烟和EB DNA拷贝数均是5年DFS率独立影响因素(P<0.05);年龄、N分期和EB DNA拷贝数均是IMRT一线治疗局部晚期鼻咽癌病人5年OS率独立影响因素(P<0.05)。见表2,3。

表2 调强放射治疗局部晚期鼻咽癌489例预后影响因素的Cox模型自变量和因变量的分组及赋值
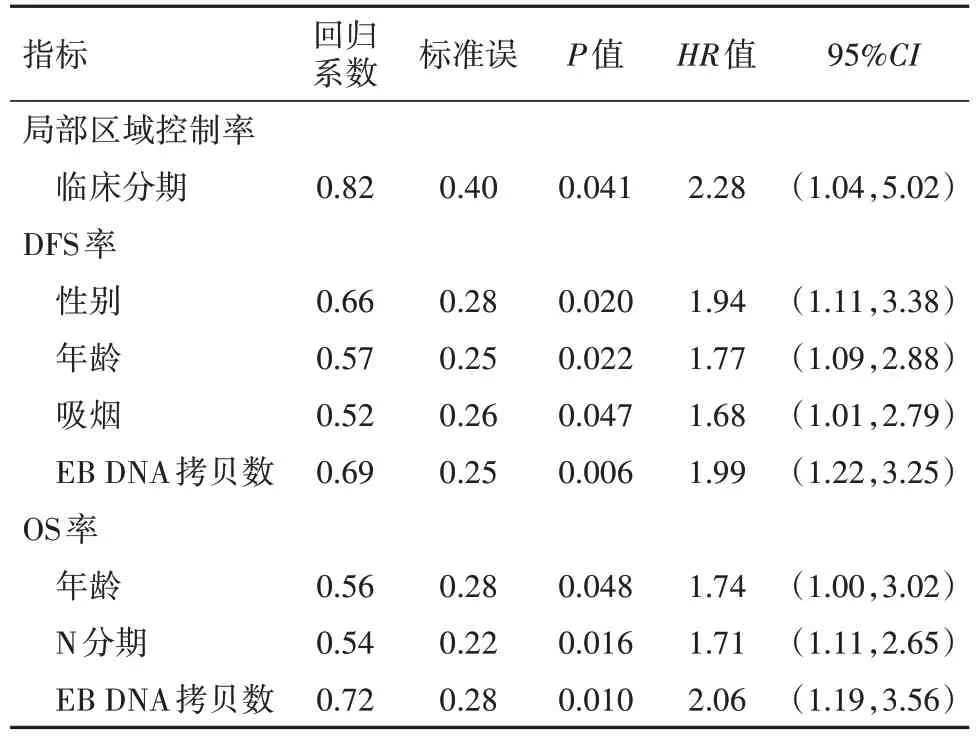
表3 调强放射治疗局部晚期鼻咽癌489例预后影响因素多因素分析
3 讨论
IMRT治疗初治局部晚期鼻咽癌已被证实在疗效及安全性方面优于常规放疗技术,同时随着IMRT技术不断普及,病人生存时间显著延长[8];但对于接受IMRT治疗初治局部晚期鼻咽癌病人随访生存及不良反应发生情况,发现预后不良因素,为后续对鼻咽癌一线治疗方案制定提供更多依据仍有较大的研究意义[9]。本次研究489例病人中位随访时间为90.0(8.0~110.0)个月,结果显示5年局部区域控制率为92.64%(453/489),5年DFS率为84.05%(411/489),5年OS率为91.00%(445/489),进一步证实IMRT在初治局部晚期鼻咽癌病人治疗中的重要价值。
中山大学肿瘤防治中心报道回顾分析868例鼻咽癌同步化疗调强放射治疗临床资料,结果显示病人5年无局部复发生存率和无进展生存率分别为91.8%、77.0%[10],这与本研究结果较为接近;但与部分大样本回顾性研究相比,本研究一线IMRT治疗后5年OS率更低[11-12],笔者认为可能原因包括:本研究中虽然入组均为Ⅲ期和ⅣA期的局部晚期鼻咽癌病人,但是入组病例中N2~N3期鼻咽癌占比更高;本地区鼻咽癌预防及筛查意识相较于广东其他高发地区往往不足,故晚期人群占比较高。
本研究纳入489例病人治疗失败及死亡主要原因为远处转移;已有研究提示,尽管IMRT技术可在一定程度上提高鼻咽癌局部控制率,但在预防远处转移发生方面作用局限[13]。有报道证实,同步放化疗可显著提高晚期鼻咽癌局部区域控制率、OS率及DFS率[14-15]。本次研究结果中单因素分析及多因素分析均未证实这一结论,笔者认为这可能与本研究单纯放疗和放化综合治疗病例数相差较大有关,后续仍有待更为严谨及大样本研究确证。
已有研究认为局部晚期鼻咽癌病人N分期可能与远处转移有关,但亦有不同观点[10,16];故如何准确预测局部晚期鼻咽癌远处转移发生风险仍有待进一步研究证实。本次研究结果中,EBV DNA拷贝数是影响局部晚期鼻咽癌病人OS率和DFS率独立影响因素,与既往研究结果一致[17]。有研究表明,EBV DNA拷贝数的高低对治疗方案的强度选择及病人的预后评价有一定的临床指导意义[18]。
本研究单因素和多因素分析结果提示,性别是影响局部晚期鼻咽癌病人5年DFS率的独立影响因素。以往研究对于性别是否是局部晚期鼻咽癌病人预后的影响并无统一定论。有报道认为,性别可独立预测鼻咽癌病人局部复发风险,另有研究认为45岁以内男性更易发生远处转移[19];上述结果提示局部晚期鼻咽癌病情进展可能与男女基因及激素分泌水平有关。
本研究结果中局部晚期鼻咽癌病人一线接受IMRT资料后随访5年晚期损伤以1~2级为主,尤以听力下降、皮肤软组织纤维化及口干等最为常见。既往研究结果提示,生存5年以上鼻咽癌病人中接近85%存在程度不一晚期损伤,口干、听力下降及皮肤损伤发生率与本研究结果相符[20]。有报道认为,放疗晚期损伤与鼻咽癌分期有关,绝大部分见于Ⅲ~Ⅳ期[21],这可能与这此类人群正常组织接受放疗剂量较高有关。相较于传统三维适形放疗,IMRT通过计算机优化算法,剂量分布于靶区适形度获得极大改善,对靶区给予足够剂量照射的同时,降低周围正常组织的照射剂量,这对于在保证疗效的同时减轻放射性损伤具有重要意义。临床实践中笔者认为对于鼻咽癌病人放疗计划应该尽可能降低唾液腺和咽缩肌的照射剂量和范围,降低晚期口干和吞咽困难发生风险,同时可采用含盐和小苏打的漱口液以缓解口干症状;通过持续颈部运动锻炼以预防或改善皮肤软组织纤维化;考虑到鼻咽癌放疗难以避开颞叶下极、脑干及颈段脊髓,放射性脑损伤、听力及视力下降等问题严重困扰着病人,故提高靶区适形度将是后续探索的重点方向[22]。本研究局限:属于单中心回顾性报道,所得结论存在选择偏倚可能;整体随访时间还有待进一步延长,评估更远生存预后及潜在影响因素。
综上所述,IMRT一线治疗局部晚期鼻咽癌远期预后与多种因素有关,包括性别、年龄、EBV DNA拷贝数及分期情况,而随访晚期损伤以1~2级为主。

