依洛尤单抗联合阿托伐他汀对冠心病病人炎性因子及斑块结构稳定性的影响
马翔宇
冠心病是因冠状动脉粥样硬化所致心肌缺血缺氧或心肌坏死的心脏病,高脂血症特别是低密度脂蛋白胆固醇(LDL-C)异常升高是冠心病发生发展的独立危险因素[1]。对于冠心病病人,他汀类药物是各国指南的推荐用药,但即使是规律治疗(或高强度他汀治疗),仍有超过30%病人血脂不能达标[2],可能与他汀类药物长期服用会特异性升高体内前蛋白转化酶枯草溶菌Kexin9(PCSK9)水平有关[3-4]。依洛尤单抗是新一代PCSK9抑制剂,能通过抑制PCSK9蛋白结合LDL-C受体,提高血清LDL-C清除率,且有良好的安全性[5]。冠状动脉斑块破裂是导致急性心肌梗死的主要原因,与炎症细胞浸润、薄纤维帽、大脂内核、高LDL-C等因素有关[6]。抑制炎症浸润、调节LDL-C水平是逆转斑块结构、提高其稳定性的关键[7-8]。依洛尤单抗降低LDL-C水平效果明显,但是否可以通过抑制炎症浸润改善冠状动脉斑块结构稳定性,目前尚缺乏足够文献报道。本研究以炎性因子、斑块稳定性为切入点,分析依洛尤单抗联合阿托伐他汀在冠心病病人中的应用效果及可能作用机制。
1 资料与方法
1.1 一般资料
选取2019年7月—2021年6月郑州市第七人民医院心内科收治的冠心病病人114例为研究对象,男68例,女46例。采用随机数字表法分为观察组和对照组,各57例,两组病人性别、年龄、病程、体质指数(BMI)、纽约心脏病协会(NYHA)心功能分级、合并疾病等比较,差异均无统计学意义(P>0.05),详见表1。本研究经医院伦理委员会批准。

表1 两组病人一般资料比较
1.2 诊断标准
符合2017欧洲心脏病学会与欧洲心胸外科学会冠心病诊断标准[9]:1)冠状动脉局部狭窄程度≥50%;2)伴有反复疼痛、心前区不适、心绞痛发作等症状;3)休息时心电图有明显心肌缺血表现或二阶梯双倍运动测验阳性。
1.3 纳入标准
1)符合冠心病诊断标准;2)年龄56~75岁;3)病程3~15年;4)NYHA心功能分级Ⅱ级或Ⅲ级;5)病人或家属知情同意并签署知情同意书。
1.4 排除标准
1)合并严重肝肾功能障碍者;2)合并严重心律失常者;3)合并恶性肿瘤者;4)合并凝血功能障碍者;5)对本次研究药物过敏者。
1.5 剔除脱落标准
1)因依从性差自动退出者;2)治疗过程中出现严重不良反应中断试验者;3)病例资料缺失者。
1.6 治疗方法
所有病人均根据《冠心病康复与二级预防中国专家共识》[10],给予常规生活指导及康复训练,包括戒烟限酒、饮食和营养指导、康复运动(有氧、阻抗、柔韧性运动)、控制体重、保证睡眠等。
1.6.1 对照组
给予抗血小板药物、β受体阻滞剂、他汀类药物治疗。口服阿司匹林(石药集团欧意药业有限公司生产,国药准字H13023636,规格:每片50 mg),每次100 mg,每日1次;口服酒石酸美托洛尔(江苏美通制药有限公司生产,国药准字H32025117,规格:每片25 mg),每次25 mg,每日2次;口服硝基地平(石药集团欧意药业有限公司生产,国药准字H13012315,规格:每片10 mg),每次10 mg,每日2次;口服阿托伐他汀(辉瑞制药有限公司生产,国药准字H20051408,规格:每片20 mg),每次20 mg,每日1次。连续治疗3个月。
1.6.2 观察组
在对照组基础上联合应用依洛尤单抗(美国Amgen Manufacturing Limited生产,注册证号S20180021,规格:每支140 mg),皮下注射,每次140 mg,每周2次,连续治疗3个月。
1.7 观察指标
1.7.1 血脂水平
分别于治疗前后采集病人空腹静脉血4 mL,3 000 r/min离心10 min(离心半径10 cm)取血清,采用7600型全自动生化分析仪(日本日立)检测总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、LDL-C。检测方法:氧化酶法,试剂均购自北京晶美生物工程有限公司。
1.7.2 炎性因子
分别于治疗前后采集病人空腹静脉血4 mL,3 000 r/min离心10 min(离心半径10 cm)取血清,采用全自动生化分析仪检测血清C-反应蛋白(CRP)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)含量。检测方法:酶联免疫吸附法,试验均购自北京晶美生物工程有限公司。
1.7.3 斑块结构
分别于治疗前后采用POLARIS血管内超声系统(美国波士顿科学IVUS)检测动脉粥样硬化斑块总体积(TAV)、最小管腔面积(MLA)、最少纤维帽厚度、最大脂质弧度。
1.7.4 心血管事件
统计治疗期间两组非致命性心肌梗死、心力衰竭、心绞痛发生率。
1.8 统计学处理
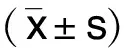
2 结 果
2.1 试验完成情况
试验过程中,观察组中途退出1例,对照组中途退出2例,中断试验1例。最终完成试验110例,其中观察组56例,对照组54例。
2.2 两组治疗前后血脂水平比较
两组治疗前血脂水平比较差异均无统计学意义(P>0.05)。两组治疗后TC、TG、LDL-C低于治疗前(P<0.05),HDL-C高于治疗前(P<0.05),且观察组治疗后TC、TG、LDL-C低于对照组,HDL-C高于对照组,差异均有统计学意义(P<0.05)。详见表2。
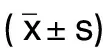
表2 两组治疗前后血脂水平比较 单位:mmol/L
2.3 两组治疗前后炎性因子水平比较
两组治疗前CRP、IL-6、TNF-α、IL-10水平比较差异均无统计学意义(P>0.05)。两组治疗后血清CRP、IL-6、TNF-α低于治疗前,IL-10高于治疗前,差异均有统计学意义(P<0.05);观察组治疗后血清CRP、IL-6、TNF-α低于对照组,IL-10高于对照组,差异均有统计学意义(P<0.05)。详见表3。
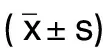
表3 两组治疗前后炎性因子水平比较
2.4 两组治疗前后斑块结构变化比较
两组治疗前斑块总体积、最小管腔面积、最小纤维帽厚度、最大脂质弧度比较差异均无统计学意义(P>0.05)。两组治疗后斑块总体积、最大脂质弧度低于治疗前(P<0.05),最小管腔面积、最小纤维帽厚度高于治疗前(P<0.05);观察组治疗后斑块总体积、最大脂质弧度低于对照组(P<0.05),最小管腔面积、最小纤维帽厚度高于对照组(P<0.05)。详见表4。
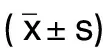
表4 两组治疗前后斑块结构变化比较
2.5 两组主要心血管事件发生情况比较
观察组主要心血管事件发生率为7.14%,低于对照组的22.22%,差异有统计学意义(P<0.05)。详见表5。

表5 两组主要心血管事件发生情况比较 单位:例(%)
3 讨 论
我国现有冠心病病人约为1 100万例,随着老龄化进程的加快,冠心病患病率和死亡率呈逐年升高的趋势,已成为我国重大公共卫生问题[11]。血脂代谢异常是冠心病发生发展的独立危险因素,LDL-C水平升高在血脂代谢异常中占据核心位置[12]。2020年《超高危动脉粥样硬化性心血管疾病病人血脂管理中国专家共识》[13]指出,对于超高危动脉粥样硬化性心血管疾病,控制LDL-C目标值(<1.4 mmol/L)能够使病人临床获益。他汀类药物是治疗LDL-C升高等血脂异常Ⅰ类推荐药物,LDL-C每降低1 mmol/L,能够使病人5年主要心血管事件降低21%[14-15]。但仍有部分病人未实现理想的LDL-C达标率,即便是高强度他汀类药物治疗,LDL-C达标率也仅为30%~40%,而且有易发肝毒性、肌肉毒性的风险[16-17]。
PCSK9是一种主要经肝脏分泌的丝氨酸前蛋白转化酶,能够竞争性地结合LDL-C受体,导致外周血LDL-C升高[18]。他汀类药物均可导致PCSK9升高,且呈剂量时间依赖性关系,也有研究认为与他汀类药物逃逸现象、6%原则有关[19]。依洛尤单抗是PCSK9抑制剂,可通过抑制PCSK9水平、阻断PCSK9与LDL-C受体结合等途径,降低血清LDL-C水平。而且依洛尤单抗可致PCSK9功能缺失性突变,能维持LDL-C终身性低水平[20]。依洛尤单抗、他汀类药物均有抑制LDL-C升高的作用,同时依洛尤单抗还可通过抑制PCSK9升高、降低他汀类药物大剂量使用风险等途径增强降脂效果。本研究结果显示,观察组治疗后TC、TG、LDL-C低于对照组,HDL-C高于对照组,与雒芳芳等[21]研究结果基本一致,说明依洛尤单抗联合阿托伐他汀改善冠心病病人血脂水平效果明显。
冠状动脉粥样硬化是冠心病发病的病理学基础,慢性炎症反应参与并加重了动脉粥样硬化斑块形成过程[22]。CRP作为一种急性期炎症反应蛋白,可通过促进单核细胞趋化蛋白-1介导的趋化反应、激活血管平滑细胞转录因子等多种途径,促进动脉粥样硬化斑块形成。IL-6可通过诱导单核细胞趋化蛋白-1合成、刺激基质降解酶表达、损伤血管内皮功能等途径,加速动脉粥样硬化的进展。TNF-α可通过诱导炎性因子产生、损伤血管内皮细胞等途径导致动脉粥样硬化[23]。IL-10为一种抗炎因子,可通过抗炎、抑制血管平滑肌细胞增生等途径,参与抗动脉粥样硬化进程[24]。相关研究表明,冠心病病人血清CRP、IL-6、TNF-α明显升高,IL-10明显降低,且与冠心病病变程度明显相关[25-26]。阿托伐他汀联合阿司匹林有拮抗炎性反应、抑制冠状动脉粥样硬化的作用[27]。PCSK9可通过Toll样受体4(TLR4)/核因子-κB(NF-κB)信号通路,激活CRP、IL-6、TNF-α等多种炎性因子的表达,参与动脉粥样硬化进程[28-29]。依洛尤单抗为PCSK9抑制剂,可通过下调PCSK9的表达、抑制PCSK9的功能等途径拮抗冠心病慢性炎症浸润程度[30]。Kong等[31]研究证实,相较于阿托伐他汀,依洛尤单抗更能降解动脉粥样硬化模型兔炎症反应,抑制兔动脉粥样硬化斑块进程。本研究结果显示,观察组血清CRP、IL-6、TNF-α水平低于对照组,IL-10高于对照组。林智海等[32]将依洛尤单抗应用于急性冠脉综合征病人,表明依洛尤单抗可降低CRP、IL-6、TNF-α炎性因子水平,说明依洛尤单抗能够抑制冠心病慢性炎症浸润程度。
逆转冠状动脉斑块进程、改善斑块结构稳定是冠心病防治的关键靶点和终极目标[33]。他汀类药物剂量每增加1倍,只能降低6%LDL-C水平,而且我国人群难以耐受高强度他汀类药物治疗,也就是说,他汀类药物改善冠状动脉斑块结构已到一个“瓶颈期”[34]。依洛尤单抗是新一代降脂药物,可通过逆向转运胆固醇、降低PCSK9残余风险、抑制PCSK9功能等多种途径,逆转动脉粥样硬化斑块进程[35]。Yano等[36]研究报道,依洛尤单抗联合他汀类药物能够增加急性冠脉综合征病人最小纤维帽厚度。陈卫海等[37]研究报道,依洛尤单抗联合阿托伐他汀更能缩小冠心病病人冠状动脉斑块总体积,增加最小管腔面积。本研究结果显示,观察组治疗后斑块总体积、最大脂质弧度低于对照组,最小管腔面积、最小纤维帽厚度高于对照组。
本研究结果表明,依洛尤单抗联合阿托伐他汀治疗冠心病病人,可通过调整血脂水平、抑制炎症反应等途径,达成逆转冠状动脉斑块进程、稳定斑块结构、预防心血管事件发生的目的。需要指出的是,冠心病冠状动脉斑块稳定或逆转是一个漫长的过程,本研究样本对象源自同一所医院,随访时间较短,且尚未对斑块性质和成分进行研究,可能会造成结论的偏倚。需要后续扩大样本、延长治疗和随访时间,以进一步验证依洛尤单抗对冠心病斑块结构及稳定性的影响。

