水源性致病微生物检测中水样前处理方法研究进展
吴 妍,张 晓,张 良,张 岚
(中国疾病预防控制中心环境与健康相关产品安全所,传染病溯源预警与智能决策全国重点实验室, 北京 100050)
水是人类赖以生存的物质,但水中存在的各类污染源会损害人和其他动物的健康[1]。同时,水也是传染病传播流行的重要途径之一。研究[2]表明,水中的微生物尤其是致病微生物是介水传染病传播的重要因素,主要包括细菌(霍乱弧菌、大肠埃希氏菌、弯曲杆菌和沙门菌等)、病毒(诺如病毒、肠道病毒、甲型肝炎病毒和轮状病毒等)和原虫(隐孢子虫、贾第鞭毛虫、溶组织内阿米巴虫和圆孢子虫等)。根据美国疾病预防控制中心疫情报告系统的数据,美国在1971年—2020年因饮用水中致病微生物(包括14种细菌、3种病毒和5种原虫)污染共引起675起疫情,累计造成497 140人患病,276人死亡[3]。历史上,霍乱弧菌曾引发多次世界范围内的霍乱大流行[4-5];由沙门菌、志贺菌、大肠埃希氏菌等引起的细菌性腹泻在发展中国家也十分常见[6-7];此外,过去各国研究者对军团菌的研究都聚焦在喷泉水和空调冷却水上,但近年来饮用水系统被军团菌污染的事件也多有发生[8-10],2020年美国疾病预防控制中心办公楼因在供水系统中发现军团菌而被封闭[11]。因此,通过水质检测对环境水体及饮用水中的致病微生物开展风险排查至关重要。
目前,水中致病微生物的标准检测方法基本都基于培养法进行检测[12-13]。但是某些因素可能会导致培养法细胞计数不完全,如微生物受到非致命性的伤害、微生物不可培养、生长温度不适宜、生长周期不满足、超过非自养的存在时间等[14-15]。近年来,国内外基于不同的检测原理研发了多种更加便捷快速的检测技术,如环介导等温扩增技术(LAMP)[16]、基于三磷酸腺苷(ATP)的生物荧光检测[17]、荧光定量聚合酶链式反应(qPCR)[18-19]等。其中,分子生物学技术因具有高特异性和快速检测的特点而逐渐得到广泛应用,这些方法可快速对多种致病微生物进行高通量检测,但在水体中的应用主要受限于3个因素:(1)水体中致病微生物存在水平较低;(2)存在抑制分子生物技术(如PCR)的干扰物质(如盐度、腐植酸);(3)游离核酸(死细胞释放的核酸)的持久性较好,导致在随后的分子检测方法中出现假阳性信号。因此,为了对水源性致病微生物进行更为准确灵敏的分析,采取适宜的前处理方法,对其进行有效地富集和净化是非常有必要的。目前,国内外仅对水体中肠道病毒的富集浓缩方法有相关报道[20-21],但对致病微生物富集浓缩方法相关研究进展的总结分析较少。本文总结了水体致病微生物前处理方法的最新研究进展,分析了不同方法的优缺点和应用特点,以期为致病微生物高效便捷的方法研究与应用提供理论基础和科学依据。
1 富集培养法
富集培养法是采用培养的方法对水样中目标微生物进行增殖,以达到富集的目的。根据微生物呼吸类型,富集培养法可分为好氧培养与厌氧培养。但是大多数微生物(大多数细菌、霉菌、放线菌等)需要有氧条件下进行培养,培养的方法主要有:(1)固体培养法——在培养基表面(如斜面与平板表面)完成微生物增殖培养;(2)液体培养法——把微生物接种到液体培养基中进行增殖培养[22]。Wang等[23]开发了经过10~24 h培养后用PCR检测水中大肠埃希氏菌和肠球菌的方法,检出限可达到0.2 MPN/mL。Strakova等[24]通过一种基于离心、细菌运动和选择性培养条件的新型培养方法,对废水和地表水中的耐热弯曲杆菌进行分离,在44%的样品中检出弯曲杆菌阳性。从现有的研究[25-27]来看,富集培养法在致病菌的富集浓缩中应用较多,对病毒和原虫的富集浓缩常采用的是鸡胚及鸡胚器官培养和细胞培养的体外培养模型,但这种方法目前主要应用于药物的开发,在水体中的应用较少。
鉴于细菌培养过程中大部分选择性培养基只能培养特定的目标菌株,无法满足多种致病菌高通量检测的需求,开发多重选择性培养液以实现多种致病菌的同时培养,目前成为了一个新的研究热点。Suo等[28]开发了一种可以同时培养大肠埃希氏菌O157:H7、沙门菌属和单核细胞增生李斯特氏菌3种致病菌的SEL (Salmonella,E.coliO157:H7 andL.monocytogenes)培养液,在1~100 CFU/mL接种浓度下,3种目标菌株经过1 h非选择性恢复期,在37 ℃选择性培养20 h后均可富集到1×108~1×109CFU/mL。Qu等[29]开发了一种可以同时培养沙门菌、金黄色葡萄球菌、大肠埃希氏菌O157:H7和单核细胞增生李斯特菌的SSEL (Salmonella,Staphylococcusaureus,E.coliO157:H7 andL.monocytogenes)培养液,在10~100 CFU/mL接种浓度下,4种目标菌体37 ℃培养18 h后均可富集到1×105CFU/mL。
富集培养法的优点是可以选择性培养目标菌株,同时可排除死菌和其他杂质的干扰(如非腐殖质生物、腐殖质等),但该方法培养过程耗时且只适用于可培养的细菌或真菌的富集,限制了其在致病微生物检测前处理过程中的研究和应用。
2 离心法
基于离心的前处理方法是利用离心力将大小、形状、密度和介质黏度不同的颗粒从液体介质中分离出来,是分子生物学实验室中最常用的技术之一[30],主要包括直接离心法和密度梯度离心法。
2.1 直接离心法
直接离心法是直接对水中的微生物进行离心,通过将大部分微生物沉降于管底来达到分离及富集浓缩的目的。根据目标微生物的大小不同可选择不同的离心条件。原虫体积较大,直径>3 μm,选用的离心力一般为500~2 000g;细菌直径一般为0.5~10 μm,常用的离心力为3 000~12 000g;病毒直径一般为0.01~0.1 μm,常用的离心力为90 800~171 000g[31]。Maal等[32]以8 000g离心10 min后提取DNA的方法对伊朗伊斯法罕南部污水处理厂的进水水样进行大肠埃希氏菌菌株的分离鉴定。《生活饮用水标准检验方法 第12部分:微生物指标》(GB/T 5750.12—2023)[33]采用Filta-Max Xpress快速方法对饮用水中贾第鞭毛虫/隐孢子虫进行测定时,采用的分离条件是2 000g离心15 min。Ahmed等[34]对澳大利亚布里斯班某城市污水处理厂的进水水样进行小鼠肝炎病毒测定时采用的分离条件是以100 000g在4 ℃下离心1 h,之后提取RNA并结合实时qPCR(RT-qPCR)完成检测,回收率为33.5%±12.1%。
直接离心法的优点主要体现在以下几个方面:①方法成本只涉及离心机的初始投资,使用中不需要化学试剂或其他昂贵的消耗品;②速度快,可以在相对较短的时间内完成大体积水样的处理;③方法操作简单、技术要求低,操作过程中不会引入其他物质、试剂,对目标微生物影响较小。然而,直接离心法也存在不足之处:①在富集目标微生物的同时会对其他颗粒进行富集,特别是对于浑浊度高的水样,容易对后续操作(如核酸提取、PCR检测等)造成影响;②离心后倾倒上清液时易造成目标微生物损失。
2.2 密度梯度离心法
密度梯度离心法是用一定的惰性介质(蔗糖、甘油等)在离心管内形成连续或不连续的密度梯度,根据微生物在密度梯度液中的比重不同,通过离心力的作用使目标微生物分离的一种技术。Garrison等[35]在弗吉尼亚州诺福克的拉斐特河和海湾流淌的水中加入大肠埃希氏菌和鞭毛虫后,采用蔗糖密度梯度离心法实现了对两种微生物的富集。Chesnot等[36]采用不同惰性介质的密度梯度离心法实现了浑浊水样中隐孢子虫卵囊的富集,已发布的GB/T 5750.12—2023中两虫检测也新增了密度梯度法。Hinzke等[37]使用蔗糖密度梯度离心法根据微生物大小从海水中富集了细菌共生体。
密度梯度离心法的优点是:①分离效果好,可一次获得杂质较少的目标微生物;②适用范围广,既能分离沉降系数不同的颗粒,又能分离密度不同的颗粒。该法存在的局限性是:①成本昂贵;②需要制备惰性介质溶液;③操作复杂,不易掌握。
3 过滤法
过滤技术是以压力作为推动力的一种膜分离技术,膜孔径为(<2 nm)~(>20 μm)。其分离机理主要有两种:(1)机械筛分,通过膜截留比膜孔径大或与其孔径相当的微生物颗粒;(2)吸附截留,当微生物穿过膜表面进入膜内部时,利用膜自身的物理化学性质和静电引力使微生物沉积在膜孔侧壁或膜内部基质上[38]。根据膜孔径大小,过滤技术可被分为微滤、超滤、纳滤和反渗透,在微生物前处理过程中主要采用微滤和超滤技术。
3.1 微滤法
3.1.1 传统微滤法
微滤是在压力驱动下利用孔径为0.05~10 μm的微孔膜截留直径在0.1~10 μm的颗粒,多用于悬浮物、细菌及大尺寸胶体的膜分离过程[39]。Shrestha等[40]采用0.40 μm聚碳酸酯过滤器和qPCR检测技术相结合的方法对芝加哥8处海滩水样中的肠球菌和大肠埃希氏菌进行了检测。Haugland等[41]用0.40 μm孔径的聚碳酸酯过滤器对美国密歇根州休闲水域水样进行过滤后,分别通过培养和qPCR技术对大肠埃希氏菌进行了检测。Wolf-Baca等[42]用0.20 μm孔径的混合纤维素酯膜过滤器过滤水样,提取DNA后用qPCR检测到了热水中的嗜肺军团菌和大肠埃希氏菌。在过去的研究中,常用的滤膜主要包括混合纤维素酯膜、醋酸纤维素膜、硝酸纤维素膜和聚碳酸酯膜,表1描述了不同材质和孔径的微孔滤膜的截留效果,每种滤膜做5次平行试验。根据表1所示结果,0.22 μm孔径的混合纤维素酯膜截留效果最好。
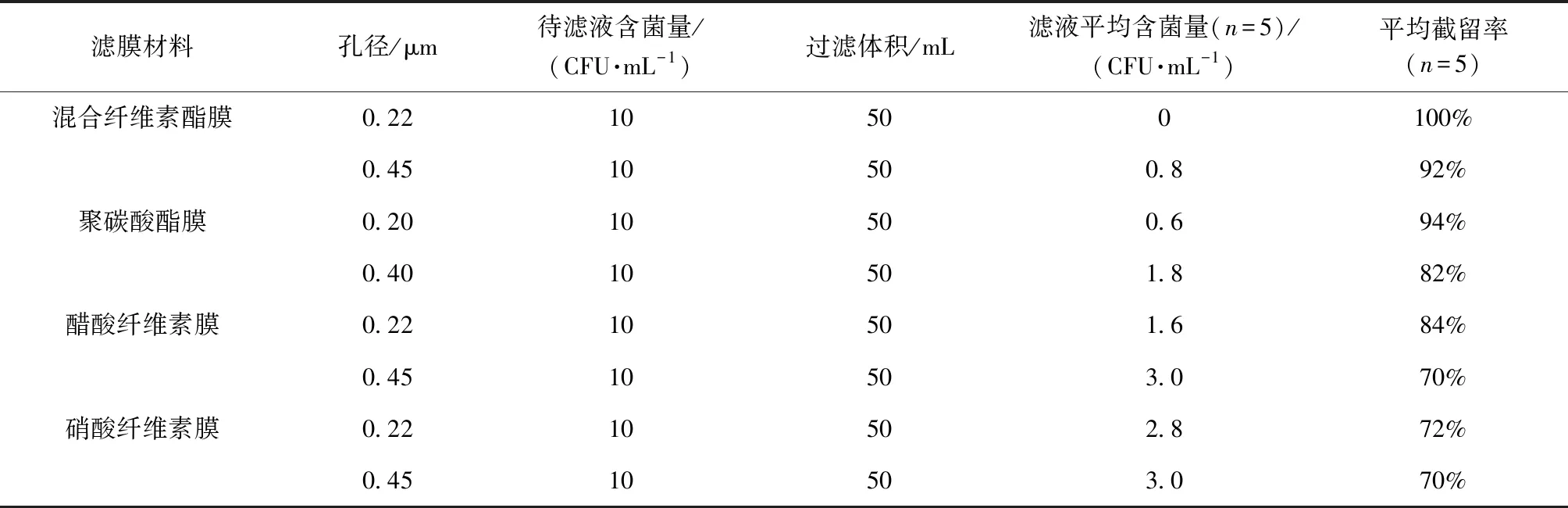
表1 4种滤膜截留效果统计分析[43]
3.1.2 改性微滤法
传统的微滤技术因为膜孔径较大,只适用于去除体积较大的致病微生物(如致病菌、原虫),不适用于去除病毒。基于吸附-洗脱原理利用电正性或电负性膜则可以通过电荷相互作用将病毒颗粒吸附到过滤介质中,然后通过调整溶液的pH将病毒洗脱下来。该方法已被广泛用于富集来自水环境的各种病毒[44-45]。
(1)电正性膜过滤法
电正性膜过滤法是依赖水中病毒颗粒固有的负电荷来实现病毒的富集。电正性膜过滤器主要包括玻璃/纤维素过滤器(1MDS)和纳米氧化铝/玻璃过滤器(NanoCeram)。Soto-Beltran等[46]分别采用NanoCeram和1MDS从处理的污水中回收脊髓灰质炎病毒,NanoCeram方法的病毒回收率为57%,1MDS方法的病毒回收率为23%。Ikner等[47]采用NanoCeram过滤器与超滤相结合的方法对水中的埃可病毒1、柯萨奇病毒B5、脊髓灰质炎病毒1、腺病毒2和大肠埃希氏菌噬菌体MS2进行富集,回收率分别为83%、77%、66%、14%和56%。电正性过滤器的价格昂贵,其优点是操作简便,无需进行预处理,且滤芯的选择性多,在大多数情况下能够过滤大量水体(>1 000 L)而不会堵塞,浑浊度较高的水样除外。
(2)电负性膜过滤法
病毒在天然水体中通常带负电,但在阳离子如Mg2+和Al3+存在或酸性条件下,其净电荷变为正电荷时,可利用静电作用将病毒吸附在电负性膜上,随后通过洗脱获得病毒颗粒[48]。Haramoto等[49]开发了一种结合Al3+或Mg2+使用电负性过滤器的方法,并成功从250~500 mL 超纯水、瓶装水、自来水、河水和池塘水中富集人类诺如病毒,回收率分别为186%、167%、80%、15%和39%。Victoria等[50]使用电负性膜过滤与qPCR检测相结合的方法,实现了在不同环境水体中对人类星状病毒和诺如病毒的富集。电负性膜过滤法的优点在于其价格低廉;然而该方法在过滤前需要对水样或过滤器进行预处理,不适用于大体积水样的过滤和常规监测。
3.1.3 小结
微滤法可根据不同目标微生物选择不同类型的滤膜以实现非浑浊水体的快速富集。传统微滤法适用于原虫、致病菌的富集,但其存在膜堵塞的风险,不能直接用于大体积、浑浊水样中微生物的分离,在过滤前可使用大孔径滤膜或纱布对浑浊水样进行预过滤以去除粗颗粒,避免堵塞。改性微滤法适用于水中病毒的富集,其中电正性膜过滤价格昂贵,但可直接用于大体积水样的过滤,电负性膜过滤价格低廉,但其在过滤前需对水样或过滤器进行预处理。
3.2 超滤法
超滤是一种基于粒度排斥原理实现在大体积水样中同时富集多种致病微生物的前处理技术,主要包括死端超滤和错流超滤两种方式[51]。该方法于20世纪70年代作为一种富集水中病毒的方法首次被提出[52-53]。超滤膜的平均孔径在0.001~1.000 μm[54]。在过去10年里,已有大量研究[55-57]证明超滤是一种富集饮用水和水源水中致病微生物的强大技术。
3.2.1 死端超滤法
死端超滤是将水置于膜的上游,在压力差的推动下使大于膜孔的致病微生物被膜截留的一种方法。Mull等[58]利用死端超滤法对40 L平均浑浊度为18 NTU的湖水中的多种微生物进行富集,其中,大肠埃希氏菌和肠球菌的平均回收率分别为81%和85%。Inkinen等[59]对芬兰5个不同的饮用水分配系统的108个水样采用死端超滤法浓缩后再进行核酸提取,使用PCR检测到古菌群落的存在。Pascual-Benito等[60]采用死端超滤法对西班牙加泰罗尼亚两个供水中心的水样进行粪便指示生物(FIO)和病原体富集,平均回收率为43.8%±17.5%。死端超滤法可以对大体积水样中的致病微生物进行回收,但是随着过滤时间的延长,被截留物质将在膜表面富集,过滤阻力增加,在操作压力不变的情况下,膜的渗透速率将下降。因此,死端超滤法只能间歇进行,必须周期性地清除膜表面的污染物层或更换膜。
3.2.2 错流超滤法
错流超滤是指在错流过滤过程中,膜表面同时受到两个力的作用,即垂直于膜表面的力与平行于膜表面的力[61]。与死端超滤法相比,错流超滤法膜表面污染相对较轻,膜通量更稳定,可以实现过滤过程的连续运行。Gibson等[62]为了对加纳南部农村社区饮用水源的微生物质量进行更广泛的评估,采用了错流超滤和qPCR相结合的方法对100 L地下水、饮用水和地表水样品进行测定,地下水和地表水中大肠埃希氏菌的回收率分别为34%~67%和(<1%)~(>120%)。Kahler等[63]使用错流超滤法从地下水和地表水中富集了大肠埃希氏菌、产气荚膜梭菌、微小隐孢子虫、埃可病毒以及噬菌体,结果表明5种肠道致病微生物的平均超滤回收率为66%~95%。Ryu等[64]采用错流超滤和qPCR相结合的方法对德克萨斯州3个匿名废水处理厂的94个水样中的细菌(总大肠菌群、粪大肠菌群和大肠杆菌)、原虫(隐孢子虫和贾第鞭毛虫)和病毒(男性特异性噬菌体、体细胞噬菌体和人腺病毒)进行检测,该方法检出限为0.004 PFU/mL。
3.2.3 小结
超滤法的优点主要是其对细菌细胞压力小,从而有利于保持细胞完整状态。同时,尽管超滤膜的孔径小于微滤膜孔径,但错流超滤法在运行时平行于膜面的切向力可以把膜面的截留物冲刷掉,不易造成过滤器堵塞。因此,该方法在处理低质量水方面具有潜在的应用价值。该方法的局限性主要在于超滤过程中水体基质的诸多组分易和目标微生物一同被富集,影响后续检测,如腐植酸和富里酸会抑制后续 PCR的检测[65]。
4 磁性分离法
磁性分离是以磁性或可磁化的材料作为吸附剂的一种分离富集技术。大多数应用于分离的磁性材料具有超顺磁性,即在通常情况下没有磁力,在外加磁场下可表现出磁性。在没有磁场的情况下可以充分地分散在溶液中,与目标物结合,之后在外加磁场下聚集于容器一侧,通过弃去溶液和重复洗涤来最大限度地去除抑制物。磁性材料只是载体,只有对磁性纳米材料(magnetic nanoparticles,MNPs)进行表面修饰,使其具有抗体、抗生素(万古霉素、达托霉素等)和化合物等识别基团才能捕获目标微生物。
4.1 免疫磁分离法
免疫磁分离是指用抗体修饰MNPs,基于抗体-抗原相互作用从水体中选择性捕获目标微生物。Guven等[66]用IgE标记的免疫磁珠分离水样中的大肠埃希氏菌,结合免疫分析技术进行检测,检出限为8 CFU/mL。Huy等[67]用蛋白A偶联壳聚糖修饰的Fe3O4磁性颗粒结合IgG抗体从浓度低至10 CFU/mL水样中分离出了霍乱弧菌。我国施行的《生活饮用水标准检验方法 第12部分:微生物指标》(GB/T 5750.12—2023)规定采用免疫磁分离荧光抗体法测定生活饮用水及其水源水中的贾第鞭毛虫孢囊和隐孢子虫卵囊。Villamizar-Gallardo等[68]使用抗轮状病毒单克隆抗体功能化氟MNPs实现了对水中轮状病毒的富集。
4.2 基于抗生素修饰的磁性分离法
一些抗菌物质能够抗菌是因为能与致病菌表面的一些生物结构相互结合,利用这一特点将其与磁性粒子结合可以起到捕获细菌的作用。Meng等[69]用万古霉素修饰的MNPs捕获水、牛奶和果汁饮料中的金黄色葡萄球菌,结合流式细胞仪,检出限为33 CFU/mL。Ding等[70]用抗菌肽功能化MNPs在较低质量浓度下(0.1 mg/mL)实现了对致病性革兰氏阴性杆菌的半选择性捕获,在较高质量浓度下(0.5 mg/mL)实现了对自来水和娱乐用水中大肠埃希氏菌的高效捕获,捕获效率大于97%。
4.3 其他
除了基于抗体和抗生素修饰的分离磁珠之外,还有一些其他经过化合物改性的磁珠被用于致病菌、病毒分离。Zhan等[71]制备了一种新型的胺功能化磁性Fe3O4-SiO2-NH2纳米粒子,可捕获水中的病毒(脊髓灰质炎病毒1)和致病菌(金黄色葡萄球菌、大肠埃希氏菌O157:H7、铜绿假单胞菌、沙门菌和枯草杆菌),回收率为92%~96.3%。Huang等[72]报道了用胺基修饰的硅包Fe3O4MNPs分离水和饮料中的大肠埃希氏菌、沙门菌、金黄色葡萄球菌等多种革兰氏阴性菌和革兰氏阳性菌,平均回收率达到了88.5%~99.1%。Bohara等[73]用功能化铁酸钴纳米颗粒基于疏水作用捕获水样中的革兰氏阴性菌(大肠埃希氏菌)和革兰氏阳性菌(金黄色葡萄球菌),平均回收率分别为65%和95%。虽然这些化合物修饰的MNPs无法特异性地区分某个特定的种属或者菌株,但这种广泛性是抗体和抗生素等识别片段无法比拟的,因此,这类磁珠的研究与开发也会是未来的热点方向之一。
以上各种磁性分离方法的优缺点汇总如表2所示。总的来说,磁性分离在致病菌和病毒前处理方面具有很大优势,可以快速有效地去除干扰物的同时富集目标微生物,无论是与分子检测方法还是其他检测方法结合都具有巨大的潜力,但局限在于其在水中原虫的富集应用较少,此外,影响其稳定性因素多。

表2 各种磁性分离方法的优缺点汇总
5 讨论
近年来,由水源性致病微生物引发的水媒传染病吸引了各国研究者的注意,水体受到致病微生物污染的相关报道显示,提高水体中致病微生物的检测能力对水源性疫情暴发早期预警具有积极作用。然而,一般情况下环境水体中致病微生物含量较低,且环境水体基质复杂,因此,为了保证对水源性致病微生物灵敏、准确的检测效果,必须进行充分的样品前处理以富集水体中的目标微生物。
本文综述了近年来各种水体中致病微生物前处理方法的研究进展,为选择富集目标微生物的最佳方法提供依据。以上各种方法的优缺点及适用范围如表3所示。(1)离心法和过滤法是根据微生物的物理特性,非特异性地富集致病微生物,适用范围较广泛。直接离心法和密度梯度离心法均适用于小体积水体中致病微生物的富集;对于过滤法,传统微滤和改性微滤分别适用于非浑浊水样中致病菌、原虫和病毒的富集,超滤法适用于大体积水体中致病菌、原虫、病毒的同时富集。(2)富集培养法和磁性分离法是根据微生物的生物特性,特异性地富集致病微生物。其中富集培养法适用于水体中特定可培养致病菌的富集;根据修饰材料的不同,磁性分离法可分为免疫磁分离和基于抗生素/化合物修饰的磁性分离等,免疫磁分离法适用于小体积水体中特定目标微生物的富集,基于抗生素修饰的磁性分离法适用于小体积水体中多种致病菌的富集,基于化合物修饰的磁分离法则适用于小体积水体中多种致病菌、病毒的富集。

表3 水体致病微生物前处理方法的优缺点及其适用范围
6 结论
(1)水体致病微生物污染可对人类和动物造成危害,引发介水传染病,而水体中致病微生物浓度低、基质复杂,对水样进行充分的前处理可以提高水体中致病微生物的检测能力。
(2)从现有研究来看,常用的前处理方法主要包括富集培养法、离心法、过滤法、磁性分离法等。
(3)各种水样前处理方法各有特点,在应用过程中可根据不同方法的优缺点和适用范围针对性进行选择。
(4)基于现有前处理方法的不足,未来研发的重点应该是在最大可能排除杂质干扰的基础上努力减少前处理过程中目标微生物的损失,如开发水体杂质去除方法、开展水体中致病微生物的二次富集等,为实现水源性致病微生物高效、快速的检测及水源性疫情暴发早期预警提供基础。