小麦- 赤霉病菌互作研究进展
程怡璠,沈会权,张英虎,徐 肖,杨红燕,汪 强,梁志浩,薛 松,于文青,郭爱奎
(江苏沿海地区农业科学研究所,江苏 盐城 224002)
小麦是世界上种植面积最大的粮食作物,种植面积为2.2 亿hm2,年产量超过7 亿t,为全世界25 亿人口提供了约20%的能量和蛋白质[1]。随着气候环境的变化,小麦的生产受到越来越多的非生物以及生物胁迫的影响,其中由禾谷镰刀菌(Fusarium graminearum)等真菌引起的小麦赤霉病(Fasuriumhead blight)是威胁小麦生产的主要病害之一。近年来,因全球气候变暖、轮作制度等影响,小麦赤霉病在全球小麦种植区流行发生,导致小麦产量下降,同时小麦籽粒受到赤霉病菌产生的真菌毒素的污染,严重威胁人类和牲畜的健康。我国长江中下游地区高温高湿的环境使小麦赤霉病频发。赤霉病的抗性是淮南地区小麦品种审定的重要评定标准之一:对赤霉病高感的参试品种施行一票否定制[2]。目前生产应用的主栽小麦品种对赤霉病的抗性不稳定。现采用的防治措施仍以化学防治为主,虽然该防治方法快速有效,但存在过度使用化学药剂的情况,对生态环境的影响和人类健康提出了很大的挑战。因此,分析小麦- 赤霉病菌互作机制,发掘小麦抗性基因,解析抗性机理,并应用于小麦抗赤霉病育种,才是解决小麦安全生产行之有效的办法。
小麦赤霉病的肆虐引起了全球小麦育种家的广泛关注,育种家们通过综合应用多学科技术来对抗小麦赤霉病。小麦全基因组测序的完成[3],极大地促进了对控制病原菌生长发育的因素、与寄主抗性相关的基因或染色体区域以及更有效地改良寄主抗性新方法的研究,为所有研究人员提供了一个深入分析六倍体小麦基因的好机会,小麦赤霉病的基础应用研究、小麦- 赤霉病菌的互作研究都取得了重要进展。本文主要对近年来小麦赤霉病菌的致病机制和小麦- 赤霉病菌互作的分子机制进行总结,并对未来小麦抗赤霉病育种方面的难点问题进行讨论,以期为今后的小麦抗赤霉病育种奠定基础。
1 小麦赤霉病的流行特点和危害
小麦赤霉病是小麦最严重的病害之一,在全球普遍发生,被称为小麦的“癌症”,危及小麦的产量和品质,产生的毒素进一步危害人畜健康,对粮食安全和食品安全影响极大。近年来,气候变暖和耕作制度的变化导致小麦赤霉病在全球尤其是我国的发生范围不断扩大,特别在我国最大的小麦主产区黄淮麦区,小麦赤霉病呈常发态势,危害日趋严重[1]。
1.1 小麦赤霉病的流行特点
小麦赤霉病俗称麦穗枯、烂麦头、红麦头,在小麦开花期侵染小麦穗部,盛花期连续的高温高湿可能会造成小麦赤霉病的流行[2]。小穗被赤霉病菌侵染后,连续36 h 暴露在25 ℃的环境下,其侵染的症状会在2 d 左右出现,而在18~20 ℃的条件下症状会在3~5 d 首次出现,在15 ℃以下的侵染则可以忽略不计[4]。小麦赤霉病菌主要侵染小麦的穗部和籽粒,在田间接种1 周后的小穗会首先产生褐色的水渍状斑纹,后期穗部会出现漂白的表型,若在湿度较大的情况下,颖壳会出现粉红色的真菌[1],同时籽粒发育会受到影响,病粒会脱色、皱缩、有粉红色真菌、灌浆不完全。
1.2 小麦赤霉病的流行地区
小麦赤霉病最早于1884 年在英国被记载[5]。Chester 等将赤霉病描述为19 世纪90 年代初影响印第安纳州和俄亥俄州小麦生产的一种突出病害[6-7]。第1 次有记录的大规模小麦赤霉病的暴发是在1914 年的日本[8]。在1917 年的美国,小麦赤霉病蔓延了31 个州,造成了约544 306 t 的损失[9]。20 世纪70 年代,小麦赤霉病主要发生在阿根廷、美国、巴西、中国和日本。此后,全球几乎每年都会发生小麦赤霉病流行[1]。
历史上,我国的小麦生产曾遭受赤霉病的严重打击,自1950 年来,我国暴发过30 次小麦赤霉病疫情[1],每次都有超过1/10 面积的小麦受到影响。我国经常发生小麦赤霉病的地区是长江中下游地区和黑龙江省东部。近几年,受气候变暖和耕作制度等影响,小麦赤霉病的发生越来越严重,受灾地区包括主要的小麦产区黄淮河流域[1],并且已经蔓延到了更远的北部和西部。
1.3 小麦赤霉病的危害
赤霉病严重威胁小麦安全生产,一般流行年份可引起5%~10%的产量损失,大流行年份可导致部分田块绝收[10]。小麦赤霉病的流行除了会导致小麦产量的下降,病粒的籽粒中含有的由赤霉病菌产生的主要毒素——脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),还会严重影响食品安全。人类或牲畜食用含有该毒素的病粒加工而成的食物,会引起呕吐等中毒现象,还会造成免疫下降,甚至致畸致癌。这使得这些病粒不适合人类食用,也不适合作为牲畜饲料使用。为了保护消费者免受DON 毒素中毒的影响,许多国家都发布了法规,规定了用于人类食品和动物饲料的成品小麦中允许的DON 水平。我国的卫生和标准管理部门规定,小麦中DON 含量超过1 mg/kg、小麦赤霉病病粒含量超过4%时禁止食用[10]。研究表明,赤霉病发病级别在1 级以上,籽粒中的DON 就会严重超标。按国家标准,可供安全食用的小麦病粒率应低于2.58%,这比国家标准中4%的病粒率要低很多。所以,一般认为赤霉病发生会造成严重减产,而实际上当病粒率达到一定比例时,收获的小麦已经不能作为粮食食用,这不是简单的减产问题,可以认为是绝收[10]。
2 小麦赤霉病菌的致病机制
2.1 小麦赤霉病菌
多种镰刀菌(也称镰孢菌)都会引起小麦赤霉病。Parry 报道在欧洲引起小麦赤霉病的镰刀菌有17 个[11]。20 世纪50 年代,著名植病学家俞大绂先生从长江流域的小麦种子上分离获得4 个镰刀菌的菌种,分别是禾谷镰刀菌(Fusarium graminearum)、黄色镰刀菌(Fusarium culmorum)、串珠镰刀菌(Fusarium moniliforme) 和燕麦镰刀菌(Fusarium avenaceum)[12]。20 世纪80 年代,我国小麦赤霉病攻关协作组对22 个省市的致病镰刀菌样本进行了形态学鉴定,共鉴定出27 个包括变种的镰刀菌[13]。地域不同,所存在的镰刀菌的种类不同,我国普遍认为禾谷镰刀菌是引起小麦赤霉病的主要致病种[12]。但2004 年国外学者发现生物学分类划分为一个种的禾谷镰刀菌其实是一个进化的族群,这个族群有清晰的系统发育生物学“种”的界限,且具有明显的地理分布[14],被分为了9 个种(部分见表1)[15],其中过去提到的禾谷镰刀菌现在只是作为其中一个广泛分布的种名。有研究表明,在亚洲流行的亚洲镰刀菌是引起我国麦类作物赤霉病的优势种群[15-16]。
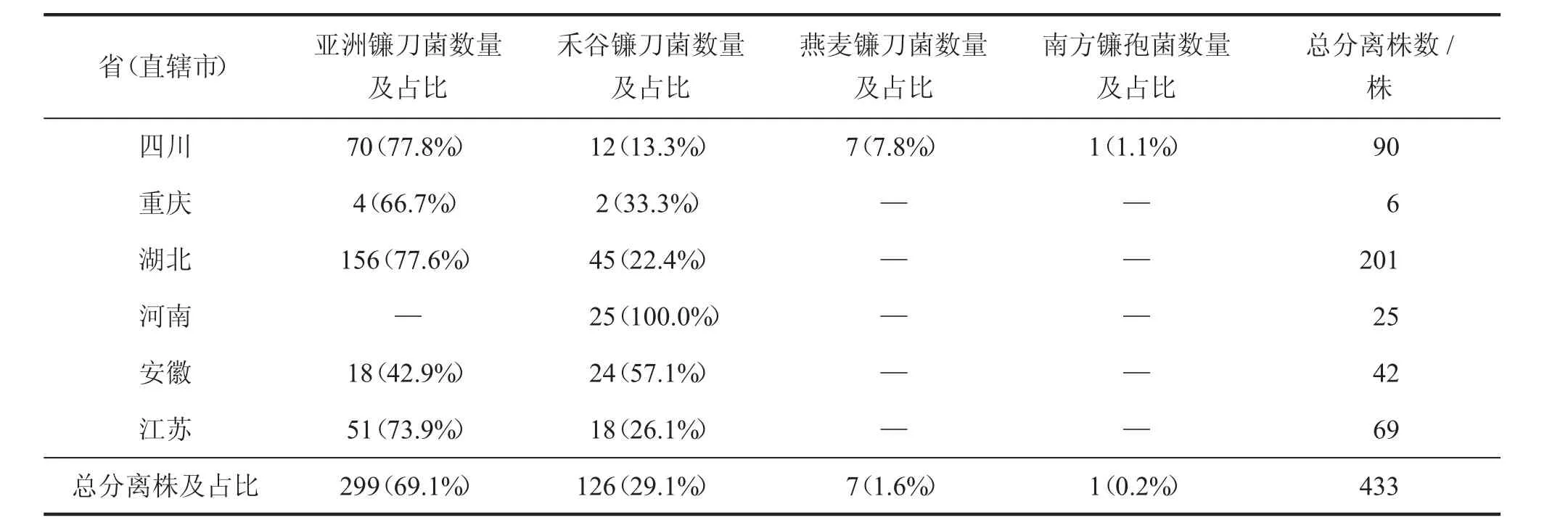
表1 部分省(直辖市)镰刀菌种的分布与检测[15]
2.2 小麦赤霉病菌的致病机制
小麦赤霉病菌在玉米、麦类作物等收获后的秸秆上以子囊壳形式越冬和越夏,次年小麦扬花期时,在高温、高湿环境下释放大量的子囊孢子,初步侵染小麦的穗部组织,其中菌源量、环境湿度、环境温度与发病程度密切相关[17]。禾谷镰刀菌为半活体寄生型病原菌[18],在其侵染植物的早期需要活体组织,即为活体营养阶段,随后切换到腐生营养阶段,而从活体寄生到腐生转换的时间点,大概是在侵染后的48 h[19]。
在大田条件下,空气传播的孢子落在开花的小穗上引起小麦赤霉病,开花的小穗为镰刀菌提供了接触主要穿透部位的机会。只有在开放的小花中镰刀菌才能接触到发育中的颖果以及内稃和外稃的正面,而这些部位更容易受到镰刀菌的侵染[20]。大多数镰刀菌会通过气孔等自然的开口,或者较短的侵染菌丝穿透小麦的细胞壁进入小麦的外壳[21],但也有可能在小麦颖片上进行初步侵染[22]。Kang 等研究认为,禾谷镰刀菌以直接侵入的方式穿透表皮细胞进入寄主组织内[23]。苏培森等通过扫描电子显微镜在抗病和感病品种的颖壳和叶片中分析禾谷镰刀菌的侵染模式,发现在接种12 h 后感病品种的颖壳表面已经形成菌丝[24]。Pritsch 等认为,镰刀菌是在气孔开口处对小麦进行侵染,他们在小麦开花期使用喷雾接种赤霉病菌后,将感病材料Wheaton 和抗病材料苏麦3 号取颖片样本在扫描电子显微镜(SEM)和光学显微镜下进行观察,发现颖片背面在接种后6~12 h 萌发禾谷镰刀菌的大分生孢子;在12~24 h 就已经很明显地看到菌丝,且初生菌丝均匀细长,最初不分支,频繁地接触气孔,由此Pritsch 等认为禾谷镰刀菌穿透事件可能通过这些气孔等开口发生;在48~76 h,加厚的分支菌丝呈珊瑚状结构,主要沿着气孔进行发育[25]。Pritsch 等在同一时间间隔(48~76 h)取样的颖片中,用扫描电镜在角质层下观察到类似的加厚菌丝,同时可以看见在颖片表面分生孢子梗发育中的大分生孢子,表明禾谷镰刀菌在这些组织上很快完成了一个无性循环[25]。
DON 是真核生物蛋白质合成的抑制剂,也是植物重要的毒力因子,它的产生使得镰刀菌能够从受感染的小花传播到小麦穗轴[26]。Tri5基因是DON 毒素生物合成所必需的,是DON 生物合成第一步的关键酶,在感染的早期阶段,它在侵染垫中表达[22]。有研究表明,Tri5缺失突变体限制了镰刀菌对相邻小花的感染[18],使得症状仅发生在接种的小穗处。这表明DON 在最初的侵染过程中不是必需的,但对病原菌在穗部的扩展却非常重要。
镰刀菌毒素DON 同时会诱导小麦产生过氧化氢(H2O2)、细胞程序性死亡和防御反应[27]。在镰刀菌侵染小麦时,活性氧(reactive oxygen species,ROS)可以使得细胞程序性死亡,利于镰刀菌在死体营养阶段的繁殖,同时会使小麦的防御反应启动。DON 在毒素体结构中合成,然而,关于毒素体形成的机理和毒素体的成分尚未完全揭示。Tang 等研究确定了毒素体2 个新的组分,即肌动蛋白戴帽蛋白(CAPs)FgCapA 和FgCapB,这2 个CAPs 在禾谷镰刀菌中形成异源二聚体,并且能够与FgMyo1和Tri1互作,肌动蛋白CAPs 与毒素体的形成有关,对禾谷镰刀菌的生长发育和毒力起关键作用[28]。
3 小麦赤霉病的抗性基因
3.1 小麦赤霉病抗性数量性状基因座/基因定位
大量研究证明,小麦赤霉病的抗性是数量性状,由多基因控制[10]。目前,研究者们已通过连锁作图和关联作图检测到432 个数量性状基因座(quantitative trait locus,QTL),分布在小麦的所有染色体上[1]。Ma等根据现有的标记信息确定,除了24 个QTL 不能定位到特定染色体区域、10 个定位到外源染色体外,其余的QTL 定位到了44 个染色体区域,但大多数QTL 仍需要验证[1]。随着抗源鉴定规模不断扩大,且小麦赤霉病的抗性遗传结构较复杂,更多抗性QTL 有待被发现,许多基因都可以赋予小麦赤霉病抗性,但可能作用较小。
目前在所有小麦染色体上均有赤霉病抗性QTL被定位,已命名的小麦抗赤霉病的基因只有7 个,即Fhb1—Fhb7(表2)。除报道的已克隆的基因Fhb1和Fhb7外,其他基因已被定位在染色体上。小麦基因组的完善、蛋白组学和代谢组学及生物信息学的发展和应用,为鉴定候选基因和克隆基因提供了机遇。

表2 文献正式命名的小麦抗赤霉病基因
3.2 小麦赤霉病抗性基因克隆和分子机制
位于小麦3B 染色体短臂的Fhb1一直是国内外公认抗性最稳定、效应最大的主效QTL,在苏麦3 号、望水白、宁7840 等抗源品种中广泛存在,在育种上也得到一定的应用[10]。已报道的Fhb1候选基因有2个。首先是Rawat 等在2016 年报道了Fhb1基因克隆的结果,通过突变分析、基因沉默和转基因过表达试验,认为Fhb1区域的PFT(pore-forming toxin-like)基因具有赤霉病抗性,可能是Fhb1基因的候选基因[29]。PFT基因编码1 种具有2 个凝集素结构域和1个ETX/MTX2(产气荚膜梭菌ε毒素/球形芽孢杆菌灭蚊毒素)毒素结构域的嵌合凝集素。植物凝集素是一组不同来源的异质蛋白质,可与碳水化合物可逆结合,在植物防御昆虫、线虫、细菌、真菌和病毒中发挥作用,且ETX/MTX2 蛋白被证明是强有力的细菌毒素,在宿主的细胞膜上形成通道,导致其死亡。对PFT 蛋白三级结构的模拟表明,它可能参与真菌特异性碳水化合物的识别,并对真菌产生毒性。Rewat等采用定向诱导基因组局部突变技术(Targeting Induced Local Lesions In Genomes,TILLING)、RNAi诱导的基因沉默技术和转基因技术验证PFT功能,认为小麦中的一种蛋白质(Hfr2)与PFT 蛋白相似,这种蛋白可增加寄主的膜通透性,如果预测的PFT蛋白与抗真菌凝集素和ETX/MTX2 蛋白具有相似的功能,则PFT可能通过与真菌壁相互作用来阻止真菌生长[29]。
2019 年,分别有2 个团队同时报道了Fhb1的另一个候选基因HRC/His。Su 等证明了一个编码组氨酸钙结合蛋白(Histidine-rich calcium-binding protein)的TaHRC是Fhb1介导的对小麦赤霉病抗性的关键决定因素[30]。该研究通过在近等基因系和重组自交系中进行验证,认为HRC为Fhb1的候选基因并继续研究其功能。该研究在序列比对中发现,TaHRC-R与TaHRC-S相比,TaHRC-R在相应的第二内含子和第三外显子处有较大的缺失,去除了保守的剪接受体位点(AG)、翻译起始密码子(ATG)和ORF 中额外的22 bp 下游序列,并使用RNAi、CRISPR-Cas9(clustered regularly interspaced palindromic repeats-CRISPR-associated proteins system,常间回文重复序列丛集- 常间回文重复序列丛集关联蛋白)敲除、单倍型分析、关联分析、亚细胞定位等方法验证其功能,认为Fhb1是一个感病基因,TaHRC基因编码一种赋予赤霉病感病性的核蛋白,部分序列的缺失导致小麦易感性降低,间接提高了抗病性。对该基因的进化和单倍型的分析进一步表明,TaHRC-R等位基因具有单一起源,最有可能起源于携带大红袍单倍型的品系。与此同时,Li 等也认为His(TaHRC)即为Fhb1[31]。2 个团队的研究都对导致Fhb1抗性的候选基因达成一致,但他们对致病等位基因的结论却截然不同。Li 等认为His基因中的部分序列缺失产生了新的基因变体,这个新等位变异是功能获得性突变,造成了小麦对赤霉病的抗性,将His序列转化到小麦和拟南芥中进行功能验证,表现出了对禾谷镰刀菌抗性增强[31]。研究表明,该基因的同源基因在植物中的翻译产物具有很好的保守性,可能是植物生长发育所必需的[31]。这2 个团队在对Fhb1的抗性候选基因上达成了一致,但对于其致病等位基因的结论不同,也都没有对其机制进行解析。有专家评论认为,可能是由基因的显性负效应(dominant-negative effect)引起,或者可能与Pm21类似,由基因簇共同起作用[39]。
第2 个被克隆的小麦赤霉病抗性基因是Fhb7。2020 年Wang 等成功克隆了来源于长穗偃麦草的抗赤霉病主效基因Fhb7,揭示了其抗病分子机理和遗传机理,并成功应用于小麦[38]。该团队首先进行了小麦近源物种长穗偃麦草的基因组组装,基于组装的参考基因组信息和之前研究的结果进行了抗赤霉病主效基因Fhb7的精细定位。通过构建抗病亲本的物理图谱获得了候选基因,使用表达特征、突变体验证、VIGS 基因沉默和转基因实验验证功能后确定其就是Fhb7。Fhb7是一种谷胱甘肽转移酶(gluthanione S-transferase,GST),GST 可以打开DON毒素的环氧基团,并催化其形成谷胱甘肽化合物,产生解毒效应,从而赋予小麦对赤霉病的抗性。该团队认为Fhb7是由内生真菌基因水平转移获得,Fhb7对单端孢霉烯家族具有解毒的功能,并在不同的抗病与感病材料中进行了叶片、颖壳及穗部的抗性比较,验证了Fhb7的功能。研究发现,Fhb7具有广谱抗性,包括镰刀菌种属禾谷镰刀菌、亚洲镰刀菌以及小麦茎基腐病害。该团队在育种利用方面,创制了小麦- 长穗偃麦草抗赤霉病的易位系,该易位系农艺性状优良,后创制出更短片段的易位系,并应用于后续育种工作。
4 小麦-赤霉病菌互作的分子机制
过去几年,在禾谷镰刀菌中发现了许多与镰刀菌侵染小麦过程有关的重要基因,包括一些效应因子基因,但鉴定出的禾谷镰孢菌分泌产生的、直接作用于寄主植物细胞并导致病害发生的毒力分子仍然很少。其中FGL1编码一种分泌型脂肪酶,在侵染小麦穗部的过程中,可以释放游离脂肪酸来抑制与先天免疫相关的胼胝质的形成,突变的FGL1镰刀菌菌株对小麦和玉米的致病力降低[40]。此外,FgNahG编码一种分泌型水杨酸羟化酶,可以将水杨酸转化为邻苯二酚。FgNahG缺失突变体菌株的毒力降低,重新将FgNahG导入缺失突变体菌株导致该菌株恢复了野生型的表型[41]。2019 年Jia 等鉴定出了一种非核糖体八肽,认为它是禾谷镰刀菌侵染小麦芽鞘所必需的毒力因子[42]。该研究发现,植物病原真菌禾谷镰刀菌在侵染小麦期间,特异诱导次生代谢基因簇fg3_54 表达,合成一个以前未知的线性非核糖体八肽- 镰孢菌素A(fusaoctaxin A),赋予镰刀菌菌丝在小麦组织内从一个细胞穿壁入侵到旁邻细胞并扩展的能力[42]。
Jiang 等的研究从另一个角度揭示了小麦与赤霉病菌间的互作分子机制[43]。该研究从50 个禾谷镰刀菌孤儿分泌蛋白(orphan secreted protein,OSP)中发现了一个重要毒力因子Osp24;尽管Osp24 对禾谷镰刀菌的生长和初始穿透力是没有影响的,但它在禾谷镰刀菌侵染小麦穗轴组织的过程中起着至关重要的作用;Osp24 在小麦赤霉病发病过程中特异性表达,其短暂表达可抑制细胞死亡;经试验验证,Osp24 被转运到植物细胞中,其中8 个半胱氨酸基团中的2 个是其功能所必需的。试验筛选到小麦SNF1(Sucrose non fermenting1,蔗糖非发酵相关蛋白1)激酶TaSnRK1α 和Osp24 互作,并证明在TaSnRK1α过表达或沉默的转基因植物中,Osp24 对小麦赤霉病抗性有着重要的作用。Osp24 通过促进TaSnRK1α与泛素-26S 蛋白酶体的关联,加速TaSnRK1α的降解。实验同时证明,TaSnRK1α还与TaFROG互作,其中TaFROG是一种由DON 诱导的小麦孤儿蛋白。在机制解析中,TaFROG与Osp24 竞争与TaSnRKα在同一区域结合,如果TaFROG与TaSnRKα结合,则保护了TaSnRKα不被降解。TaFROG的过表达稳定了TaSnRK1α,并增加了小麦赤霉病抗性。综上所述,Osp24 通过与TaFROG竞争结合TaSnRK1α而发挥细胞质效应蛋白的功能,证明了宿主和病原真菌的孤儿蛋白在相互作用过程中的反作用。
Wang 等克隆了长穗偃麦草中的抗赤霉病基因Fhb7。该团队通过基因克隆、寄主基因组测序及比对发现,二倍体长穗偃麦草早期可能与(香柱真菌属) 形成共生体,通过基因水平转移将中Fhb7的DNA 整合到长穗偃麦草基因组中,从而进化出抗镰刀菌属病原菌侵染的功能。该发现首次提供了真核生物间核基因组DNA 水平转移的功能性证据[38]。尽管上述研究对小麦和赤霉病菌的互作进行了解析,但小麦和真菌互作之间的复杂性仍需进一步探索。
5 展望
小麦是异源六倍体,本身基因组庞大且复杂,同时小麦赤霉病的抗性是数量性状,由多基因控制,且环境因素影响巨大,小麦与真菌互作同样具有复杂性,这些因素造成了研究者对小麦抗赤霉病机制的了解还十分有限。现在田间生产上小麦赤霉病的防治以化控为主,但实践表明,化学防治会使赤霉病菌产生抗药性。此外,也有关于小麦赤霉病菌拮抗菌株的研究[44],尽管生物防治是更为环保的一种方法,但现在生物防治还未应用于生产。因此,选育抗赤霉病的品种仍是最绿色环保且有效的抗赤霉病措施。目前的栽培小麦只有极少数品种对赤霉病的抗性为高抗,研究小麦和赤霉病菌的互作机制显得尤为重要。尽管小麦抗赤霉病基因的研究在近年来有所突破,但其机制有待进一步研究,未来小麦和赤霉病菌互作的研究将是工作的重点。
小麦中命名的抗赤霉病基因只有7 个,近年来小麦抗赤霉病基因Fhb1和Fhb7的相继克隆,给小麦赤霉病育种家们提供了很好的参考,但小麦赤霉病的抗性机制及赤霉病菌与小麦互作等问题仍需进一步探讨。Jiang 等通过在禾谷镰刀菌中寻找孤儿蛋白Osp24,以与小麦SNF1 相关激酶TaSnRK1α互作来探究小麦和赤霉病菌之间的关系,在机制研究上为研究者提供了新的互作关键途径和研究思路[43]。Fhb1候选基因已经克隆,也进行了相应的功能验证,但抗病机制仍需进一步研究。来自于长穗偃麦草的抗赤霉病基因Fhb7是通过基因水平转移的天然“转基因”方式进入宿主,同样给学者提供了新的思路来研究小麦与真菌之间复杂的互作关系。研究小麦- 赤霉病菌的互作在小麦抗赤霉病育种工作中至关重要,通过在育种工作中应用该互作机制中的相关基因和蛋白,有利于培育出对赤霉病具有稳定抗性且丰产高质的小麦品种。

