发酵饲料对产蛋番鸭体组织脂肪含量和脂肪代谢相关基因表达及盲肠微生物的影响
任善茂,陶勇,江慧,王健
发酵饲料对产蛋番鸭体组织脂肪含量和脂肪代谢相关基因表达及盲肠微生物的影响
任善茂,陶勇,江慧,王健*
(江苏农牧科技职业学院动物科技学院,江苏 泰州 225300)
选用750只健康的37周龄产蛋期黑羽番鸭,随机均分为5组,每组5个重复,对照组饲喂基础饲粮,试验组分别饲喂添加2%、4%、6%和8%发酵饲料的饲粮,预试期7 d,正试期37 d,探究发酵饲料对产蛋番鸭生产性能、体组织脂肪含量、脂肪代谢相关基因表达和盲肠微生物的影响。结果表明:不同水平发酵饲料组产蛋番鸭的产蛋率、平均蛋质量、平均日产蛋质量、料蛋比差异均无统计学意义(>0.05),但日粮中添加4%、6%和8%发酵饲料显著(<0.05)降低了破(软)蛋率;不同水平发酵饲料组产蛋番鸭肝脏、胸肌和腿肌中的脂肪含量差异均无统计学意义(>0.05);2%和4%发酵饲料组产蛋番鸭肝脏和及8%发酵饲料组产蛋番鸭肝脏基因表达量均显著(<0.05)高于对照组的,4%、6%和8%发酵饲料组产蛋番鸭腹脂基因表达量显著(<0.05)低于对照组的,腹脂基因表达量相比对照组的有增加趋势(=0.07);4%发酵饲料组Sobs指数显著(<0.05)高于6%发酵饲料组的,且4%发酵饲料组的Shannon指数显著(<0.05)高于其他各组的;添加8%发酵饲料显著(<0.05)降低了unclassified_o_Bacteroidales的相对丰度,添加4%发酵饲料显著(<0.05)提高了norank_f_Oscillospiraceae的相对丰度。可见,饲粮中适量添加发酵饲料,能降低产蛋番鸭破(软)蛋率,调节鸭脂肪合成相关基因的表达水平,提高肠道菌群的多样性并在属水平改善肠道菌群结构,产蛋番鸭日粮中混合发酵饲料适宜添加水平为4%。
黑羽番鸭;发酵饲料;生产性能;脂肪;基因表达;盲肠微生物
发酵是降解植物来源饲料中抗营养因子以及毒素的有效手段,也是提高植物性饲料营养价值、改善饲料适口性以及提高饲料抗氧化能力的既便宜又简单的方法[1]。发酵饲料是利用微生物如细菌或霉菌降解饲粮中的大分子有机物质以及抗营养因子,从而得到易消化吸收的小分子营养物质以及酶、微生物等活性代谢物质的饲料[2]。面对抗生素饲料添加剂的禁用,发酵饲料作为一种替代物在动物饲粮中的使用具有巨大的潜力。研究表明,发酵饲料具有提高家禽免疫能力[3–4]、改善肠道菌群[5–6]和饲料转化效率[3–4,6]及动物生产性能[3–6]等功效。
产蛋鸭体内脂类代谢旺盛,脂肪在体内的沉积与其繁殖性能、饲料利用率以及鸭肉嫩度及风味等均有关。肠道是鸭营养物质消化与吸收,以及免疫的重要部位,而肠道微生物则保证了以上作用的发挥。对鼠、猪肠道菌群与健康的研究[7]已发现,其体脂肪含量与肠道菌群的组成密切相关。而发酵饲料对于蛋鸭脂类代谢及肠道微生物的影响可获信息非常有限。笔者以黑羽番鸭产蛋鸭为试验动物,研究发酵饲料对其生产性能、体组织脂肪含量、脂肪代谢相关基因表达以及盲肠微生物的影响,以期为发酵饲料在产蛋番鸭生产中的应用提供依据。
1 材料与方法
1.1 供试材料
供试产蛋黑羽番鸭来自国家级水禽基因库(江苏)。发酵饲料是以乳酸杆菌、枯草芽孢杆菌、酵母菌通过固态发酵玉米、豆粕、麸皮等的混合物生产制得。发酵饲料的pH为4.29,水分为42.78%。发酵饲料基于干物质的营养水平:粗蛋白19.98%(粗蛋白中酸溶蛋白占28.16%),粗纤维5.48%,粗灰分6.67%,粗脂肪3.48%,总酸3.50%,蛋氨酸0.19%,赖氨酸0.99%,总磷0.25%。
1.2 试验设计
选择健康、体质量(2.30 kg左右)相近的750只37周龄产蛋期黑羽番鸭,将之随机均分为5组,每组5个重复,各重复30只。对照组饲喂基础饲粮,各试验组分别饲喂主要营养成分含量基本一致,发酵饲料添加量不同(2%、4%、6%和8%)的试验饲粮。试验各组饲粮组成及营养水平见表1。按照发酵饲料添加量各组分别记为F0、F2、F4、F6和F8。饲养试验预试期7 d,正试期37 d。
1.3 动物饲养管理
饲养试验在江苏现代畜牧科技示范园进行。试验开始前对试验鸭舍、所用设备和器械进行彻底的清洗消毒。试验中产蛋番鸭均在同一栋鸭舍内以重复为单位单笼饲养。自由采食,乳头式饮水器自由饮水,自然采光并保持室内通风,室内相对湿度保持在65%左右。每天定时饲喂2次,定时捡蛋2次,保持笼舍的干净整洁,及时打扫卫生。试验期间每日2次观察产蛋鸭的采食情况与健康情况。

表1 各试验组饲粮组成及营养水平(风干基础)
预混料由扬州市扬大饲料厂提供。
1.4 测定指标及方法
1.4.1生产性能测定
试验期间每天定时收集各重复的鸭蛋,并记录蛋的数量、质量和破(软)蛋数,以周统计各组各重复饲料饲喂量,每天记录各组各重复死亡或淘汰的鸭数。计算平均日采食量、平均日产蛋质量、料蛋比、产蛋率、破(软)蛋率等。
1.4.2样品采集
试验结束,每重复选取2只鸭单独称质量后颈部放血处死。开腹后迅速采集肝脏和腹脂样,分装于2 mL冻存管中,立即放于液氮罐中快速冷冻并于–80 ℃保存,用于基因表达的测定;采集鸭盲肠内容物于无菌管中,立即置于液氮中快速冷冻,以备微生物多样性测定;采集肝脏、左侧胸肌和腿肌样品放于封口袋中,于–20 ℃的冰箱中保存,以备检测脂肪含量。
1.4.3粗脂肪含量的测定
将肝脏、胸肌和腿肌解冻后制备成风干样品,再将样品研细,然后按照GB 5009.6—2016《食品安全国家标准食品中脂肪的测定》中的索氏提取法测定样品中脂肪的含量。每个样品重复3次。结果以风干样中的脂肪含量表示。
1.4.4脂肪代谢相关基因表达水平测定
为了解脂肪代谢相关基因的表达水平,测定肝脏和腹脂脂肪酸合成酶基因()、脂蛋白脂肪酶基因()、脂肪组织甘油三酯水解酶基因()、过氧化物酶增殖物激活受体基因()的表达水平。采用TRI zol® Plus RNA Purification Kit试剂(Invitrogen,货号12183)提取肝脏和脂肪组织总RNA。使用商业试剂盒Super Script™ Ⅲ First–Strand Synthesis Super Mix for qRT–PCR(Invitrogen,货号11752–050)将总RNA逆转录为cDNA。以β–肌动蛋白基因()为内标,使用商业试剂盒Power SYBR® Green PCR Master Mix(Roche,货号4913914001),采用qRT–PCR法(Quantstudio多重实时荧光定量PCR仪,Life Technologies)定量分析目标基因和内标基因。引物序列见表2。PCR反应体系包括cDNA 1.0 µL、SDW 8.0 µL、Power SYBR® Green Master Mix 10.0 µL、Forward Primer (10 µmol/L) 0.5 µL、Reverse Primer(10 µmol/L) 0.5 µL,总体积为20 µL。PCR反应每个样品重复3次。PCR热循环过程为95 ℃预变性1 min;PCR扩增40个循环阶段为95 ℃变性15S,63 ℃退火和延伸25 s;溶解曲线阶段为55℃逐渐升温到95 ℃。结果以各基因的相对表达量表示,采用2△△法计算。

表2 实时PCR引物和条件
1.4.5盲肠内容物微生物的测定
盲肠内容物微生物测定委托上海美吉生物医药科技有限公司完成。测序后进行生物信息分析,对序列进行操作分类单元(OTU)聚类,并进行物种注释、相对丰度分析及微生物α多样性指数计算。详细过程参见牟怡晓等[8]的方法。
1.5 数据统计分析
运用SPSS 20.0进行单因素方差分析,选用Duncan法进行多重比较。方差非齐性或非正态分布的显著性分析,采用非参数检验Kruskal–Wallis单因素ANOVA(样本)检验方法。
2 结果与分析
2.1 发酵饲料对产蛋番鸭生产性能的影响
由表3可知,饲喂不同水平发酵饲料后产蛋番鸭的产蛋率、平均蛋质量、平均日产蛋质量和料蛋比各组间的差异均无统计学意义(>0.05);与对照组相比,4%、6%和8%发酵饲料组破(软)蛋率显著(<0.05)降低。

表3 饲喂不同水平发酵饲料的产蛋番鸭的生产性能
同列不同字母示组间差异有统计学意义(<0.05)。
2.2 发酵饲料对产蛋番鸭肝脏和肌内脂肪含量的影响
由表4可知,饲喂不同水平发酵饲料后产蛋番鸭的肝脏、胸肌和腿肌脂肪含量各组间的差异均无统计学意义(>0.05)。
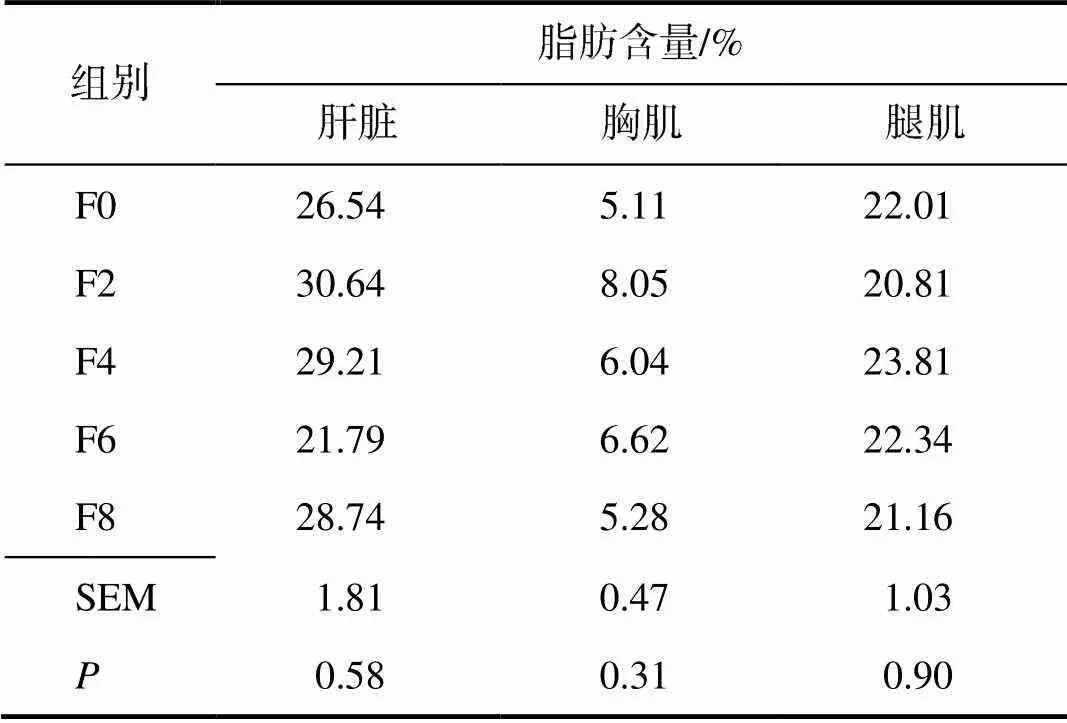
表4 饲喂不同水平发酵饲料的产蛋番鸭肝脏和肌内脂肪含量
2.3 发酵饲料对产蛋番鸭脂肪代谢相关基因表达的影响
由表5可知:与对照组相比,2%和4%发酵饲料组产蛋番鸭肝脏基因的相对表达量均显著(0.05)增加,8%发酵饲料组产蛋番鸭肝脏基因的相对表达量显著(<0.05)增加,发酵饲料组产蛋番鸭肝脏基因的表达量无显著(>0.05)变化;4%、6%和8%发酵饲料添加组产蛋番鸭腹脂基因的相对表达量显著(<0.05)降低,发酵饲料组产蛋番鸭腹脂和基因的相对表达量均未有显著(>0.05)变化,但腹脂基因的相对表达量有增加的趋势(=0.07)。

表5 饲喂不同水平发酵饲料的产蛋番鸭肝脏和腹脂脂肪代谢相关基因的表达水平
同列不同字母示组间差异有统计学意义(<0.05)。
2.4 发酵饲料对产蛋番鸭盲肠微生物的影响
从表6可知,4%发酵饲料组产蛋番鸭盲肠内容物微生物Sobs指数显著(<0.05)高于6%添加组的,且Shannon指数显著(<0.05)高于其他各组的;Simpson、Ace指数和Chao指数各组间差异均无统计学意义(>0.05)。
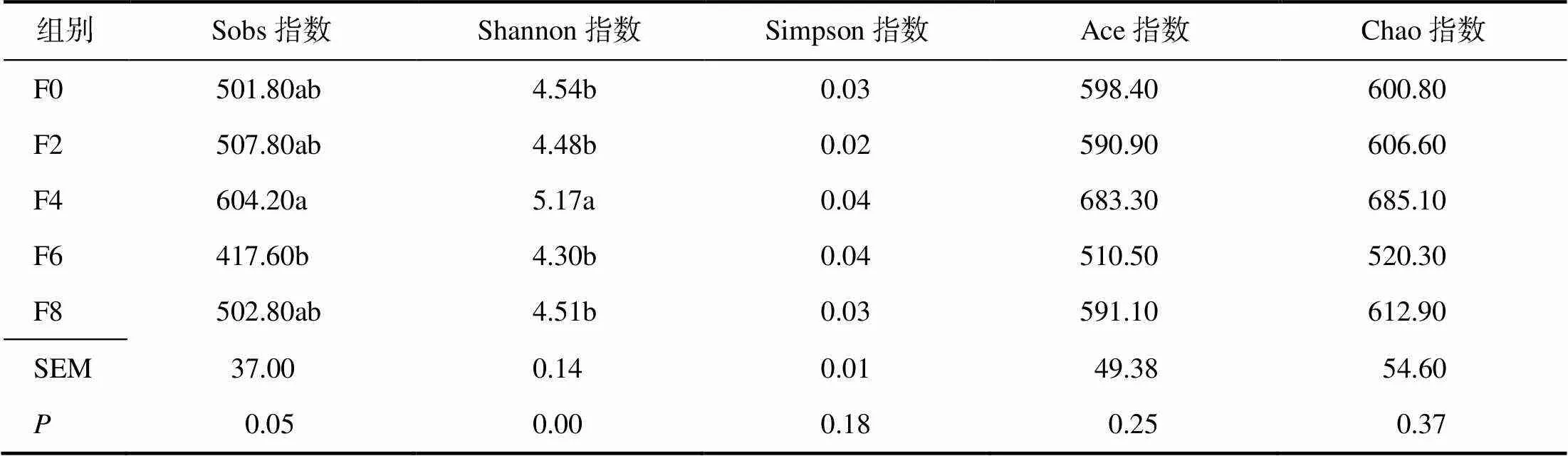
表6 饲喂不同水平发酵饲料的产蛋番鸭盲肠内容物菌群的α多样性指数
同列不同字母示组间差异有统计学意义(<0.05)。
由图1可知,从门水平上分析,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、脱铁杆菌门(Deferribacterota)等4大类细菌为各组产蛋番鸭盲肠内容物中相对丰度较高的菌门,且以厚壁菌门和拟杆菌门占比最高。经统计分析各试验组在各菌门水平上的差异均无统计学意义(>0.05)。由图2可知,属水平上,拟杆菌属()、理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)、罕见小球菌属()以及粘螺旋菌属()为各组产蛋番鸭盲肠内容物占比较高菌属。试验各组产蛋番鸭盲肠内容物差异菌属的相对丰度见表7。由表7可知,与对照组相比,添加2%和8%发酵饲料后显著(<0.05)降低了unclassified_o__ Bacteroidales的相对丰度;添加4%发酵饲料后显著(<0.05)提高了norank_f__Oscillospiraceae的相对丰度;添加2%发酵饲料后显著(<0.05)提高了norank_f__Erysipelotrichaceae的相对丰度。

图1 饲喂不同水平发酵饲料的产蛋番鸭盲肠内容物菌群门的相对丰度

图2 饲喂不同水平发酵饲料的产蛋番鸭盲肠内容物菌群属的相对丰度
同列不同字母示组间差异有统计学意义(<0.05)。
3 结论与讨论
由于发酵底物的种类和质量、发酵技术、饲养管理条件、研究目标以及试验设计等多方面影响,发酵饲料对动物生产性能影响的研究结果并不完全一致[9]。研究表明,发酵饲料对产蛋家禽的生产性能具有积极的效果,其可提高产蛋率[10]和日产蛋重[4,6],降低料蛋比[4,6,10]。本研究中,添加发酵饲料仅改善了产蛋后期番鸭的破(软)蛋率,但未影响其他生产性能指标。发酵饲料对破(软)蛋率的改善作用可能是由于发酵饲料中低的pH值(4.29)有利于降低胃肠道酸度,从而更有利于钙的利用,因而改善了蛋壳的质量,降低了鸭蛋的破(软)蛋率。
微生物发酵饲料含有益生菌以及发酵底物产生的多种活性代谢物,如功能性低聚糖、有机酸、小肽、磷酸胆碱、左旋肉碱等,从而可改变动物体的脂质代谢[11]。周露[12]在文昌鸡基础饲粮中添加30%的发酵混合饲料,降低了文昌鸡的肝脂率。陈丽艳[13]在肉仔鸡饲粮中添加不同含量的乳酸杆菌培养物,当添加量达0.3%和0.5%时显著降低了肉仔鸡肝脂率。以上研究表明,发酵饲料和乳酸杆菌培养物可降低肝脂率和腹脂率。本研究中,添加发酵饲料后产蛋番鸭肝脂率未有显著变化,这可能与发酵饲料用量、发酵饲料中益生菌的活菌数及种类等因素有关。
梁天柱等[14]给广西三黄鸡饲喂添加10%混菌发酵的混合饲料(菌种为双歧杆菌、乳酸菌、芽孢杆菌、光合细菌、酵母菌等,底物为喷浆玉米皮、玉米粉、大豆粕等)的饲粮显著提高了其腿肌肌内脂肪含量。王朝阳等[15]给黄羽肉鸡基础饲粮添加5%和8%发酵棉粕,提高了肉鸡胸肌和腿肌脂肪含量。ZHAO等[16]研究发现,添加丁酸梭菌提高了试验42 d时肉仔鸡胸肌和腿肌肌内脂肪含量,而添加屎肠球菌却未产生影响。本研究中,不同水平发酵饲料未对产蛋番鸭肌内脂肪含量产生显著影响,这与LIU等[17]在北京母鸭基础饲料中添加0.3%发酵银杏叶(凝结芽孢杆菌发酵)的试验结果一致。不同试验中发酵饲料对肌内脂肪含量影响的差异可能与发酵底物、发酵饲料添加水平以及发酵用菌种等不同有关。
本研究中,发酵饲料对脂肪代谢相关基因表达的影响与发酵饲料用量有关。添加4%发酵饲料后产蛋番鸭肝脏、、基因的相对表达量均显著增加,而腹脂基因的相对表达量显著下降,表明4%发酵饲料提高了产蛋鸭肝脏脂肪合成相关基因的表达。聂存喜等[18]给黄羽肉鸡饲喂酵母发酵棉粕,也观察到64日龄黄羽肉鸡肝脏的表达显著上升。周露[12]给文昌鸡饲喂0%~30%发酵饲料却未影响脂肪组织基因的相对表达量。朱年华等[19]和LIU等[17]分别给肉仔鸡和母鸭饲喂乳酸菌混合发酵液和发酵银杏叶后,前者显著降低了和基因的相对表达量,后者显著降低了基因的相对表达量。由上可见,发酵饲料对脂肪代谢相关基因表达量的影响并无一致的结论,其结果与发酵饲料作用的动物生理阶段、发酵底物、发酵用微生物种类及数量等有关。对脂肪合成相关基因表达具有调控作用的发酵饲料可能是通过发酵饲料中的微生物(如乳酸杆菌类[11]),及发酵底物中的化合物(如黄酮类物质[14])对脂肪代谢相关基因的表达进行调控,从而调节脂肪酸合成与分解的速度。本研究中4%发酵饲料组产蛋番鸭脂肪合成相关基因表达量的提高,一方面可能与发酵饲料的使用有关;另一方面也可能与在饲粮中添加了较高的饲用油脂有关。饲粮中脂肪含量在一定范围内增加可以提高脂肪合成酶相关基因,如[20]和[21]的表达水平。本研究中,发酵饲料使用后脂肪合成相关基因表达量提高了,但是肝脏和肌内脂肪含量却未发生变化,这是否表明发酵饲料仅在转录水平对脂肪代谢相关基因进行调控,而对其蛋白质的翻译没有影响,这仍有待进一步研究。
通过营养结构或饲料组成改变肠道菌群是家禽生产中针对肠道微生物的有效疗法[22–23]。本研究中,4%发酵饲料组产蛋番鸭盲肠微生物的Shannon指数显著高于其他各组的,表明添加发酵饲料改善了产蛋番鸭盲肠微生物的多样性;4%发酵饲料组产蛋番鸭盲肠内容物中norank_f__Oscillospiraceae的相对丰度显著高于其他各组的,norank_f__Oscillo- spiraceae出现于食草动物的肠道,可高效利用植物叶子和根中的碳水化合物和低聚糖[24],这表明发酵饲料可提高产蛋番鸭盲肠对碳水化合物和低聚糖的利用能力。4%发酵饲料组鸭脂肪合成相关基因表达量的增加可能也与发酵饲料使用后norank_f__ Oscillospiraceae相对丰度的提高有关。发酵饲料对鸭肠道微生物的改善作用,一方面可能直接得益于发酵饲料中的有益微生物,如乳酸菌、芽孢杆菌等;另一方面可能得益于发酵过程中产生的微生物代谢产物或菌体成分等,这些因子使得发酵饲料可能具有“后生元”特性[25]。本研究中,当发酵饲料添加比例达到8%时显著降低了unclassified_o_Bacteroi- dales的相对丰度。田威龙等[26]研究发现,属水平unclassified_o_Bacteroidales在高饲料转化率组猪中富集,可作为潜在的生物标志物。这表明发酵饲料的添加量高达一定水平后,由于微生物与宿主之间对营养物质的竞争增加可能会导致饲料转化效率降低。
综上所述,饲粮中适量添加发酵饲料,能降低产蛋番鸭破(软)蛋率,调节产蛋番鸭脂肪合成相关基因表达水平,提高肠道菌群的多样性并在属水平改善肠道菌群结构。在本研究条件下,产蛋番鸭日粮中发酵饲料适宜添加水平为4%。
[1] SUGIHARTO S,TURRINI Y,ISROLI I,et al.Fermented feed as a potential source of natural antioxidants for broiler chickens:a mini review[J]. Agriculturae Conspectus Scientificus,2019,84(4):313–318.
[2] MISSOTTEN J A,MICHIELS J,DEGROOTE J,et al.Fermented liquid feed for pigs:an ancient technique for the future[J].Journal of Animal Science and Biotech- nology,2015,6(1):4.
[3] ZHU F H,ZHANG B B,LI J,et al.Effects of fermented feed on growth performance,immune response,and antioxidant capacity in laying hen chicks and the underlying molecular mechanism involving nuclear factor-κB [J].Poultry Science,2020,99(5):2573–2580.
[4] 阮栋,刘建高,陈伟,等.发酵饲料对蛋鸭产蛋性能、蛋品质、肠道消化酶活性及免疫功能的影响[J].动物营养学报,2019,31(12):5740–5749.
[5] YAN J S,ZHOU B,XI Y M,et al.Fermented feed regulates growth performance and the cecal microbiota community in geese[J].Poultry Science,2019,98(10):4673–4684.
[6] ENGBERG R M,HAMMERSHØJ M,JOHANSEN N F,et al.Fermented feed for laying hens:effects on egg production,egg quality,plumage condition and compo- sition and activity of the intestinal microflora[J].British Poultry Science,2009,50(2):228–239.
[7] GUO X,XIA X,TANG R,et al.Development of a real-time PCR method for Firmicutes and Bacteroidetes in faeces and its application to quantify intestinal population of obese and lean pigs[J].Letters in Applied Microbiology,2008,47(5):367–373.
[8] 牟怡晓,张欢,马聪慧,等.不同添加量枸杞副产物对柠条锦鸡儿发酵特性及微生物多样性的影响[J].动物营养学报,2021,33(9):5152–5161.
[9] XU B C,LI Z,WANG C,et al.Effects of fermented feed supplementation on pig growth performance:ameta-analysis[J].Animal Feed Science and Technology,2020,259:114315.
[10] XU F Z,LI L M,LIU H J,et al.Effects of fermented soybean meal on performance,serum biochemical parameters and intestinal morphology of laying hens[J].Journal of Animal and Veterinary Advances,2012,11(5):649–654.
[11] 赵茂臻,梁曦,张喆,等.植物乳杆菌F3–2联合甘露低聚糖通过上调短链脂肪酸水平抑制PPARγ改善小鼠肥胖[J].食品与发酵工业,2021,47(23):78–82.
[12] 周露.发酵饲料对育肥期文昌鸡脂肪代谢的影响[D].海口:海南大学,2020.
[13] 陈丽艳.乳酸杆菌制剂对肉仔鸡脂肪和蛋白质代谢的影响[J].黑龙江畜牧兽医,2007(1):47–48.
[14] 梁天柱,梁光哲,梁志东,等.发酵饲料对广西三黄鸡生长性能、屠宰性能和肉品质的影响[J].饲料研究,2021,44(4):26–30.
[15] 王朝阳,孙焕林,冯江鑫,等.枯草芽孢杆菌发酵棉粕对黄羽肉鸡屠宰性能和肉品质的影响[J].黑龙江畜牧兽医,2016(15):102–104.
[16] ZHAO X,GUO Y M,GUO S S,et al.Effects ofandon growth performance,lipid metabolism,and cecal microbiota of broiler chickens[J].Applied Microbiology and Biotechnology,2013,97(14):6477–6488.
[17] LIU X Y,CAO G J,ZHOU J L,et al.The effects of-fermented and non-fermentedon abdominal fat deposition and meat quality of Peking duck[J].Poultry Science,2017,96(7):2264–2273.
[18] 聂存喜,张文举,刘艳丰,等.酵母菌发酵棉粕对黄羽肉鸡肌肉主要脂肪酸组成的影响[J].中国家禽,2015,37(7):25–28.
[19] 朱年华,张日俊,张保全,等.乳酸杆菌培养物对肉鸡脂肪代谢相关基因表达的影响研究[C]//中国畜牧兽医学会动物营养学分会.第六次全国饲料营养学术研讨会论文集.杨凌:中国畜牧兽医学会动物营养学分会,2010:549.
[20] 葛晓可,李璐,马晓娇,等.不同油脂水平日粮添加胆汁酸对肉鸡肝脏及其脂代谢的影响[J].江苏农业科学,2019,47(21):236–241.
[21] VIDAL-PUIG A,JIMENEX-LIÑAN M,LOWELL B B,et al.Regulation of PPAR gamma gene expression by nutrition and obesity in rodents[J].Journal of Clinical Investication,1996,97(11):2553–2561.
[22] 朱春红,陶志云,刘宏祥,等.鸭不同肠段内菌群结构分析与拟杆菌分布研究[J].畜牧兽医学报,2020,51(12):3001–3012.
[23] YANG H,LYU W T,LU L Z,et al.Biogeography of microbiome and short-chain fatty acids in the gastrointestinal tract of duck[J].Poultry Science,2020,99(8):4016–4027.
[24] HUANG C,GE F,YAO X X,et al.Microbiome and metabolomics reveal the effects of different feeding systems on the growth and ruminal development of yaks[J].Frontiers in Microbiology,2021,12:682989.
[25] SZMIGIEL I,KONKOL D,KORCZYŃSKI M,et al.Changes in the microbial composition of the cecum and histomorphometric analysis of its epithelium in broilers fed with feed mixture containing fermented rapeseed meal[J].Microorganisms,2021,9(2):360.
[26] 田威龙,司景磊,莫家远,等.基于16S rRNA测序探究杜洛克猪饲料利用率与肠道菌群的关系[J].中国畜牧杂志,2021,57(6):146–153.
Effects of fermented feed on body tissue fat content, fat metabolism-related gene expression and cecal microbiota of laying muscovy ducks
REN Shanmao,TAO Yong,JIANG Hui,WANG Jian*
(College of Animal Science and Technology, Jiangsu Agri-animal Husbandry Vocational College, Taizhou, Jiangsu 225300, China)
A total of 750 37-week-old black-feathered muscovy ducks of laying period were randomly and evenly divided into 5 groups with 5 replicates in each group. Ducks in the control group were fed the basal diet, and ducks in the experimental groups were fed the diet supplemented with 2%, 4%, 6% and 8% fermented feed, respectively. The pre-trial period was 7 days, and the trial period was 37 days. The effects of fermented feed on production performance, body fat content, fat metabolism-related gene expression and cecal microbiota of laying muscovy ducks were explored. The results showed that there were no statistically significance in egg production rate, average egg mass, daily egg mass and feed-to-egg ratio between the different levels of fermented feed groups(>0.05), but addition of 4%, 6% and 8% fermented feed to the diet significantly(<0.05) reduced broken(soft) rate of the laying muscovy ducks. There were no statistically significance in fat contents in liver, breast muscle and leg muscle of ducks with different levels of fermented feed(>0.05). Compared with the control group,andgenes expression in the liver of the ducks within the 2% and 4% fermented feed groups andgene expression in the liver of the duck within the 8% fermented feed group were significantly higher than those within the control group(<0.05);gene expression in the abdominal fat of the ducks within the 4%, 6% and 8% fermented feed groups was significantly lower than that within the control group(<0.05); andgene expression in abdominal fat tended to increase(=0.07). Sobs index of the 4% fermented feed group was significantly higher than that of the 6% group(<0.05), and Shannon index of the 4% fermented feed group was significantly higher than that of other groups(<0.05). 8% fermented feed significantly decreased the relative abundance of unclassified_o_Bacteroidales (<0.05), and 4% fermented feed significantly increased the relative abundance of norank_f_Oscillospiraceae (<0.05). In conclusion, fermented feed couldimprove broken(soft) rate and regulate the expression of fat synthesis-related genes. Meanwhile it could increase the diversity of intestinal microbiota and improve the structure of intestinal microbiota at the genus level. The optimal addition level of fermented feed in the diet was 4%.
black-feathered muscovy duck; fermented feed; production performance; fat; gene expression; cecal microbiota
S834.5
A
1007–1032(2023)05–0588–08
任善茂,陶勇,江慧,王健.发酵饲料对产蛋番鸭体组织脂肪含量和脂肪代谢相关基因表达及盲肠微生物的影响[J].湖南农业大学学报(自然科学版),2023,49(5):588–595.
REN S M,TAO Y,JIANG H,WANG J.Effects of fermented feed on body tissue fat content, fat metabolism-related gene expression and cecal microbiota of laying muscovy ducks[J].Journal of Hunan Agricultural University(Natural Sciences),2023,49(5):588–595.
http://xb.hunau.edu.cn

2022–05–12
2023–10–20
江苏省农业科技自主创新资金项目(CX(18)1004);泰州市科技支撑计划(农业)项目(TN201918)
任善茂(1976—),女,江苏海安人,博士研究生,副教授,主要从事猪禽营养与饲粮资源开发研究,124604031@qq.com;*通信作者,王健,教授,主要从事家禽的遗传育种与繁殖研究,tzwjian@126.com
10.13331/j.cnki.jhau.2023.05.013
责任编辑:邹慧玲
英文编辑:柳正

