电针对术后认知功能障碍模型大鼠炎症反应和铁死亡影响的研究
秦晓宇,张斌森,张笑佳,逯晓婷,刘鸿鑫,王春爱
1.730030 甘肃省兰州市,甘肃中医药大学第一临床医学院
2.200120 上海市,同济大学附属东方医院麻醉科
3.730030 甘肃省兰州市,甘肃省中医方药挖掘与创新转化重点实验室
4.730030 甘肃省兰州市,甘肃省中药新产品创制工程实验室
5.730030 甘肃省兰州市,甘肃中医药大学针灸推拿学院
6.730050 甘肃省兰州市,甘肃省中医院麻醉疼痛医学中心
7.730050 甘肃省兰州市,甘肃省中西医结合麻醉临床医学研究中心
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是一种术后常见的神经系统并发症。数据显示,60 岁以上非心脏手术患者POCD 发生率高达56%,且随年龄的增长逐渐增高[1-2]。POCD 严重影响了患者的术后康复和生活质量,增加了患者的经济负担以及疾病的发病率和死亡率[3]。目前,国际和国内多学科专家共识指出,降低POCD 发生的主要措施仍以围手术期预防为主[4-5]。POCD 药物治疗本身存在不良反应,和麻醉药物作用还可能增加手术风险。研究表明,电针对POCD 患者认知功能改善疗效确切,且不良反应更少,成本更低[6],然而具体机制尚不明确。铁死亡是一种新发现的铁依赖性程序性细胞死亡方式,参与诱导POCD 神经损伤并诱发炎症反应[7]。炎症是导致POCD 的重要病理因素,麻醉/手术后促炎和抗炎细胞因子大量表达,进一步加重神经元细胞死亡[8]。而能否通过电针抑制铁死亡途径及其调控促炎和抗炎细胞因子间的失衡进而减轻POCD 鲜有报道。因此,本研究以老年POCD 大鼠模型为研究对象,观察电针百会、内关穴对术后学习记忆功能、促炎和抗炎细胞因子以及铁死亡的影响。
1 材料与方法
1.1 实验材料
1.1.1 本研究时间为2022年1月—2023年2月。取18~20月龄SPF 级健康雌性SD 大鼠72 只,体质量350~450 g,由甘肃中医药大学动物实验中心提供,许可证号:SCXK(甘)2020-0001。饲养期间大鼠自由摄食水,室内温度22~24 ℃,相对湿度40%~70%,12 h光/暗环境循环。本研究通过甘肃中医药大学实验动物伦理委员会批准(2021-200)。
1.1.2 主要实验仪器和耗材:针灸针(北京科苑达医疗器械有限公司,规格:0.25 mm×25 mm),电子针疗仪(苏州医疗用品厂有限公司),医用缝合针(杭州华威医疗用品有限公司),Morris 水迷宫系统(成都泰盟科技有限公司),离心机(德国Eppendorf 公司),酶标仪(美国Molecular 公司),摇床(美国SCILOGEX 公司),转印槽(美国Bio-Rad 公司),透射电子显微镜(日本日立公司)。
1.1.3 主要药品和试剂:丙泊酚(江苏恩华药业股份有限公司,货号:国药准字H20123138),大鼠肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白介素(interleukin,IL)6、IL-10 酶联免疫吸附试验(ELISA)试剂盒(上海酶联生物科技有限公司),铁含量检测试剂盒(美国Abcam 公司,货号:ab83366),脂质过氧化物(lipid peroxidation,LPO)试剂盒(南京建成生物工程研究所有限公司,货号:A106-1-2),酰基辅酶A 合成酶长链家族成员4(acyl-CoA synthetase long chain family member 4,ACSL4)、铁蛋白重链1(ferritin heavy chain 1,FTH1)、GAPDH 抗体(美国Immunoway公司,货号分别为:YT8070、ab75972、YM3029),溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)抗体(美国Abcam 公司,货号:ab232958)。
1.2 实验方法
1.2.1 实验分组:大鼠适应性喂养1 周后,按照随机数字表法分为3 组:对照组(n=24)、模型组(n=24)和电针组(n=24)。术后观察大鼠并进行行为学检测,根据术后3、7 d 两个观察时间点将每组大鼠分为2 个亚组(对照组术后3 d 亚组、对照组术后7 d 亚组,模型组术后3 d 亚组、模型组术后7 d 亚组,电针组术后3 d亚组、电针组术后7 d 亚组),每组12 只。
1.2.2 POCD 大鼠模型建立:参考文献[9-10]的方法,采用剖腹探查手术建立POCD 模型。对照组捆绑固定和腹腔注射等量0.9%氯化钠溶液,其余组大鼠腹腔注射150 mg/kg 丙泊酚麻醉。待大鼠翻正反射消失、夹尾实验无反应后,剔除腹部毛发,对拟进行手术部位碘伏消毒。用手术刀沿大鼠剑突下方约1 cm 处的腹部正中白线做约3 cm 切口,然后剪开大鼠腹肌和腹膜,暴露腹腔内脏。随后按照肝脏、脾脏、胃、肠道、肾脏顺序依次探查。每次探查时间为3 min,共探查3 次,间隔时间为7 min。在每次探查间隔时间内,从腹腔内取出约10 cm 的小肠,用0.9%氯化钠溶液预浸泡的纱布覆盖,用手指轻微搓揉肠管约3 min,然后将其送回腹腔。整个手术探查时间约为30 min。探查结束后,用4-0 手术缝线逐层缝合肌肉和皮肤,并用无菌辅料覆盖腹部。Morris 水迷宫行为学检测结果与对照组比较差异显著,即为建模成功。
1.2.3 给电针组大鼠穿上自制鼠衣,然后绷带捆绑固定。选取大鼠百会和双侧内关穴,取穴位置参照《实验动物常用穴位名称与定位 第2 部分:大鼠》[11]。一次性无菌针灸针在百会穴位置向后斜刺2 mm,内关穴位置直刺1 mm。在疏密波,20/100 Hz 频率,1 mA 电流强度条件下刺激20~30 min。于造模前2 d 开始干预,1 次/d,连续5 d。对照组和模型组大鼠在电针组大鼠刺激期间做同样捆绑固定。
1.2.4 实验过程中4 只大鼠被排除,包括对照组术后3 d亚组1 只大鼠认知功能训练过程中发现视物不清,模型组术后7 d 亚组、电针组术后3 d 亚组、电针组术后7 d亚组各1只大鼠造模后次日死亡。最终共纳入68只大鼠。
1.2.5 Morris 水迷宫装置检测大鼠行为学表现:术前通过定位航行实验对大鼠进行认知功能训练,将大鼠头朝池壁放入水中,记录大鼠逃避潜伏期。若在120 s 内找到平台,则平台上停留10 s;若在120 s 内未找到平台(潜伏期记为120 s),则引导至平台上并停留15 s。训练共历时5 d,每天定于固定时间段训练4 次(即分别将大鼠从不同象限放入水中),大鼠每两次训练时间间隔为15~20 min。于术后3、7 d 行定位航行实验检测(方法同上)。定位航行实验结束后,撤出平台,将大鼠于同一象限放入水中,行空间探索实验。记录120 s 内大鼠的游泳路径和穿越原平台位置次数。
1.2.6 行为学实验完成后,3%戊巴比妥钠30 mg/kg 腹腔注射麻醉大鼠。待大鼠翻正反射、夹尾反应消失后打开腹腔,暴露腹主动脉,采用无菌采血管取血。将血液室温下静置30 min,于低温离心机中3 000 r/min 离心15 min(离心半径8 cm),取血清于冻存管中。然后断头取脑,于冰上迅速分离海马组织。按照试剂盒说明书逐步操作。使用酶标仪在450 nm 波长下测定吸光度(OD值),根据标准曲线计算血清、海马样品中IL-6、IL-10、TNF-α 的水平。每个亚组取5 只大鼠的海马组织检测IL-6、IL-10、TNF-α。
1.2.7 取大鼠海马组织裂解匀浆,4℃,3 000 r/min 离心20 min(离心半径8 cm),取上清液。应用组织铁含量检测试剂盒检测海马组织中Fe2+的浓度。具体步骤按照试剂盒说明书进行。
1.2.8 取大鼠海马组织,按照试剂盒说明书逐步操作,在586 nm 波长下通过酶标仪测定OD 值,计算各组大鼠LPO 相对含量。
1.2.9 免疫印迹法(Western blot)检测海马ACSL4、LPCAT3 和FTH1 蛋白表达水平:每组选取5 只大鼠,取海马组织100 mg,加入裂解液提取总蛋白,采用BCA 法测定样品蛋白浓度。根据目的蛋白分子量配置相应浓度分离胶。将样品蛋白加入上样孔中(量依据BCA浓度计算所得),以80 V 电压开始电泳,待Marker散开后调至120 V。电泳后,将蛋白转移到聚偏二氟乙烯膜上,置于5%脱脂奶粉中封闭120~150 min。加入稀释好的一抗,4 ℃摇床孵育过夜。加TBST 稀释好的二抗,室温摇床孵育1.5 h。加入ECL 发光液,机器曝光成像,Image J 软件中分析条带灰度值。
1.2.10 透射电镜观察海马区神经细胞超微结构:取灌注后的大鼠海马组织,在2.5%戊二醛中固定过夜。经脱水、包埋后,将样品切成超薄切片(厚度60~80 nm)。用醋酸铀、柠檬酸铅双染色。水洗,充分干燥后在透射电镜下观察细胞超微结构。
1.3 统计学方法
采用GraphPad Prism 8.0 软件进行数据分析。符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Bonferroni 检验。不符合正态分布的计量资料以M(P25,P75)表示,多组间比较采用Kruskal-WallisH检验,组间两两比较采用Dunn's 检验。术前不同时间认知功能训练计量资料多组间比较采用双因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠行为学检测结果
2.1.1 术后3 d、7 d 大鼠组别与时间对大鼠术前认知功能训练逃避潜伏期均不存在交互作用(P交互>0.05),训练时间对逃避潜伏期主效应均显著(P时间<0.05),组别对逃避潜伏期主效应均不显著(P组间>0.05),见表1、表2。

表1 术后3 d 各亚组大鼠术前认知功能训练逃避潜伏期比较(s)Table 1 Comparison of cognitive function training escape latency in 3 d postoperative subgroups
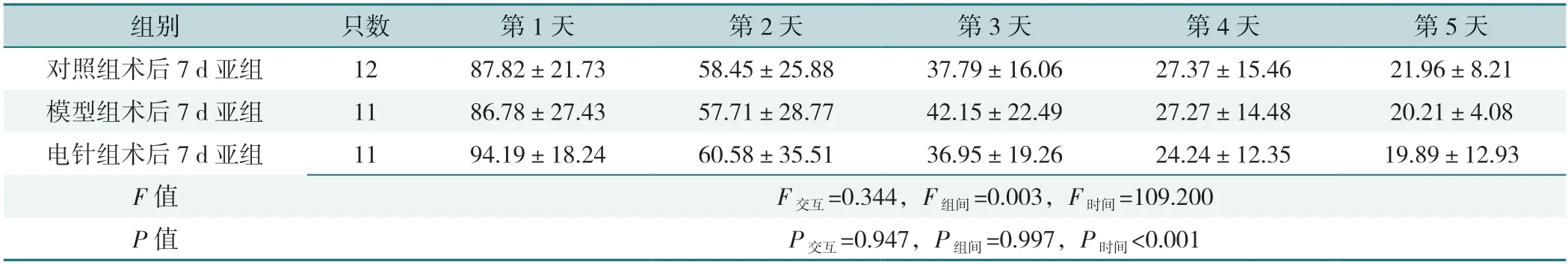
表2 术后7 d 各亚组大鼠术前认知功能训练逃避潜伏期比较(s)Table 2 Comparison of cognitive function training escape latency in 7 d postoperative subgroups
2.1.2 术后3 d 各亚组逃避潜伏期、穿越平台次数、目标象限停留时间比较,差异有统计学意义(P<0.05);其中模型组术后3 d 亚组逃避潜伏期高于对照组术后3 d亚组、电针组术后3 d 亚组,穿越平台次数、目标象限停留时间低于对照组术后3 d亚组、电针组术后3 d亚组,电针组术后3 d 亚组穿越平台次数低于对照组术后3 d亚组,差异有统计学意义(P<0.05)。大鼠术后3 d 平均游泳速度比较,差异无统计学意义(P>0.05),见表3。术后7 d 各亚组逃避潜伏期、穿越平台次数、目标象限停留时间比较,差异有统计学意义(P<0.05);其中模型组术后7 d 亚组逃避潜伏期高于对照组术后7 d 亚组、电针组术后7 d 亚组,穿越平台次数低于对照组术后7 d亚组,目标象限停留时间低于对照组术后7 d 亚组、电针组术后7 d 亚组。大鼠术后7 d 平均游泳速度比较,差异无统计学意义(P>0.05),见表4。

表3 大鼠术后3 d 学习记忆情况比较Table 3 Comparison of learning and memory of rats in 3 d postoperative subgroups
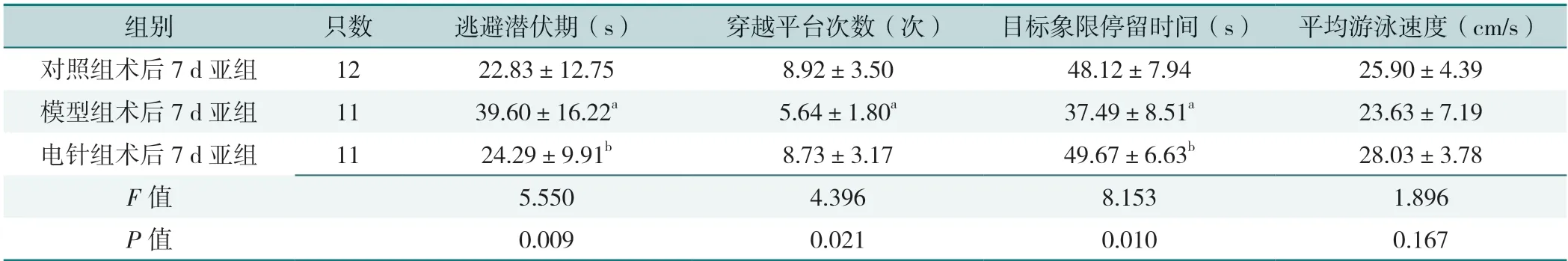
表4 大鼠术后7 d 学习记忆情况比较Table 4 Comparison of learning and memory of rats in 7 d postoperative subgroups
2.2 大鼠术后炎症反应情况
2.2.1 术后3 d 各亚组血清IL-6、TNF-α、IL-10 比较,差异有统计学意义(P<0.05);其中模型组术后3 d 亚组IL-6、TNF-α 高于对照组术后3 d 亚组、电针组术后3 d 亚组,电针组术后3 d 亚组TNF-α 高于对照组术后3 d 亚组,IL-10 高于对照组术后3 d 亚组、模型组术后3 d 亚组,差异有统计学意义(P<0.05),见表5。术后7 d 各亚组血清IL-6、TNF-α、IL-10 含量比较,差异有统计学意义(P<0.05);其中模型组术后7 d亚组IL-6 高于对照组术后7 d 亚组,TNF-α 高于对照组术后7 d 亚组、电针组术后7 d 亚组,电针组术后7 d亚组IL-10 高于对照组术后7 d 亚组、模型组术后7 d亚组,差异有统计学意义(P<0.05),见表6。
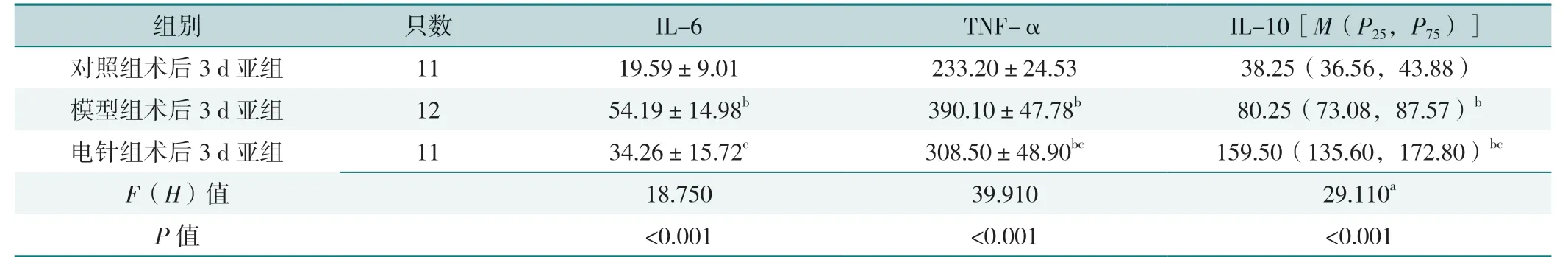
表5 术后3 d 各亚组大鼠血清IL-6、TNF-α 及IL-10 水平比较(pg/mL)Table 5 Comparison of serum IL-6,TNF-α and IL-10 levels in 3 d postoperative subgroups
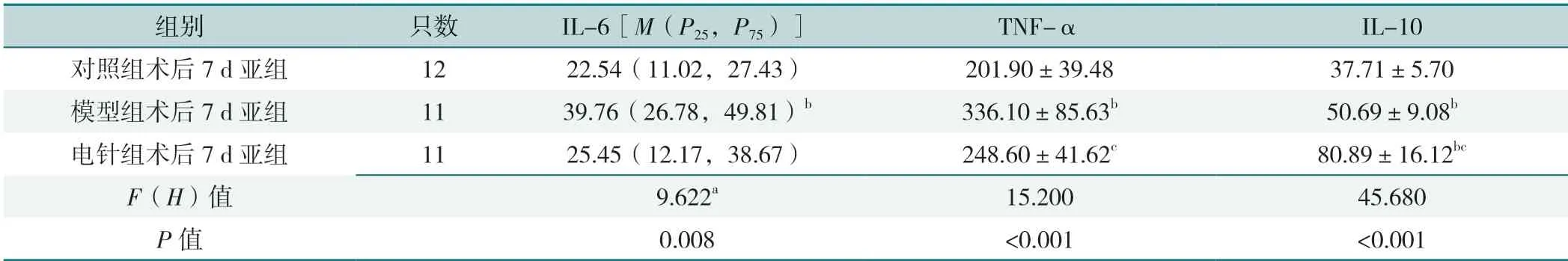
表6 术后7 d 各亚组大鼠血清IL-6、TNF-α 及IL-10 水平比较(pg/mL)Table 6 Comparison of serum IL-6,TNF-α and IL-10 levels in 7 d postoperative subgroups
2.2.2 术后3 d 各亚组海马IL-6、TNF-α、IL-10 比较,差异有统计学意义(P<0.05),其中模型组术后3 d 亚组IL-6、TNF-α 高于对照组术后3 d 亚组、电针组术后3 d 亚组,电针组术后3 d 亚组IL-6、TNF-α 高于对照组术后3 d 亚组,IL-10 高于对照组术后3 d 亚组、模型组术后3 d 亚组,差异有统计学意义(P<0.05),见表7。模型组术后7 d 亚组IL-6、TNF-α 高于对照组术后7 d 亚组、电针组术后7 d 亚组,电针组术后7 d亚组IL-10 高于对照组术后7 d 亚组、模型组术后7 d亚组,差异有统计学意义(P<0.05),见表8。

表7 术后3 d 各亚组大鼠海马IL-6、TNF-α 及IL-10 水平比较(pg/mL)Table 7 Comparison of IL-6,TNF-α and IL-10 levels in hippocampus in 3 d postoperative subgroups
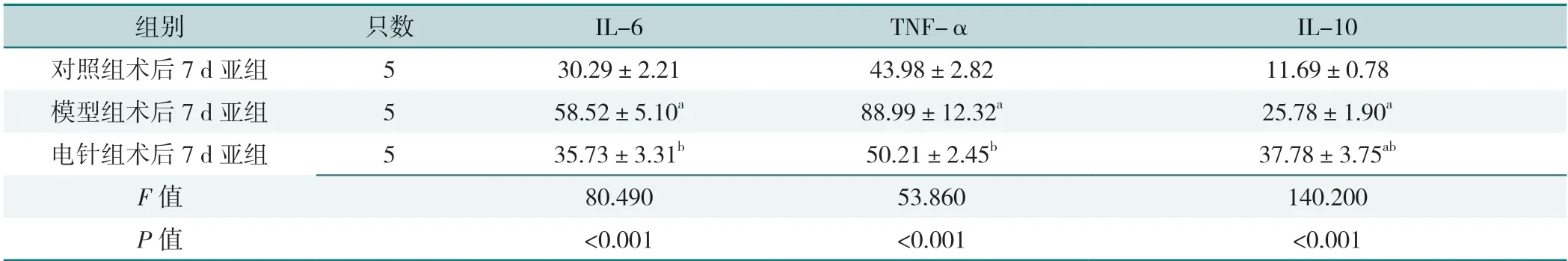
表8 术后7 d 各亚组大鼠海马IL-6、TNF-α 及IL-10 水平比较(pg/mL)Table 8 Comparison of IL-6,TNF-α and IL-10 levels in hippocampus in 7 d postoperative subgroups
2.3 大鼠术后铁死亡指标的检测结果
术后3 d 各亚组大鼠海马Fe2+、LPO、ACSL4、FTH1 和LPCAT3 相对表达量比较,差异有统计学意义(P<0.05);其中模型组术后3 d 亚组Fe2+、LPO、ACSL4、LPCAT3 高于对照组术后3 d 亚组、电针组术后3 d 亚组,电针组术后3 d 亚组高于对照组术后3 d亚组,模型组术后3 d 亚组FTH1 低于对照组术后3 d亚组、电针组术后3 d 亚组,电针组术后3 d 亚组低于对照组术后3 d 亚组,差异有统计学意义(P<0.05),见表9。大鼠术后7 d 各亚组大鼠海马Fe2+、LPO、ACSL4、FTH1 和LPCAT3 相对表达量比较,差异有统计学意义(P<0.05);其中模型组术后7 d 亚组Fe2+、LPO、ACSL4、LPCAT3 高于对照组术后7 d 亚组、电针组术后7 d 亚组,FTH1 低于对照组术后7 d 亚组、电针组术后7 d 亚组,差异有统计学意义(P<0.05),见表10。术后3、7 d 各亚组大鼠ACSL4、FTH1 和LPCAT3蛋白条带图见图1、图2。
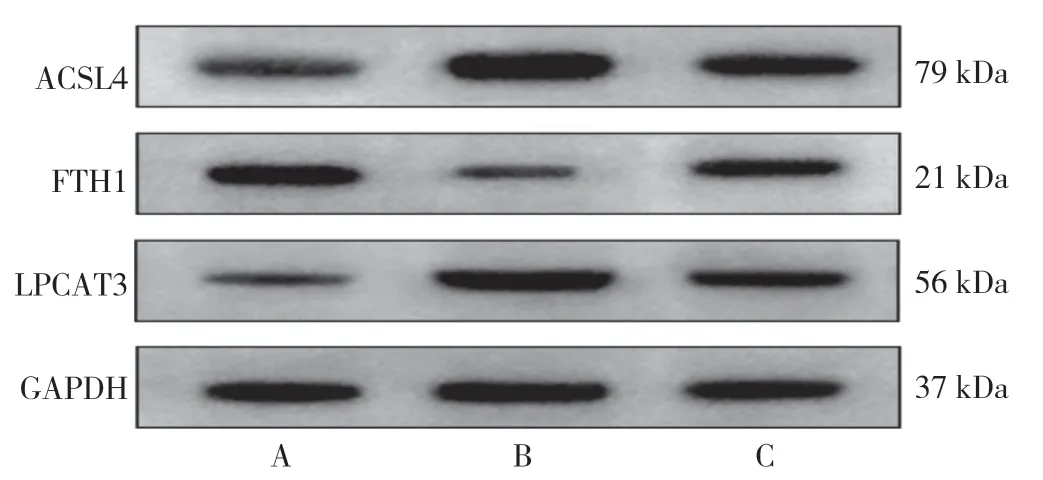
图1 术后3 d 观察亚组大鼠海马ACSL4、FTH1 和LPCAT3 蛋白条带图Figure 1 The protein bands of ACSL4,FTH1 and LPCAT3 in 3 d postoperative subgroups
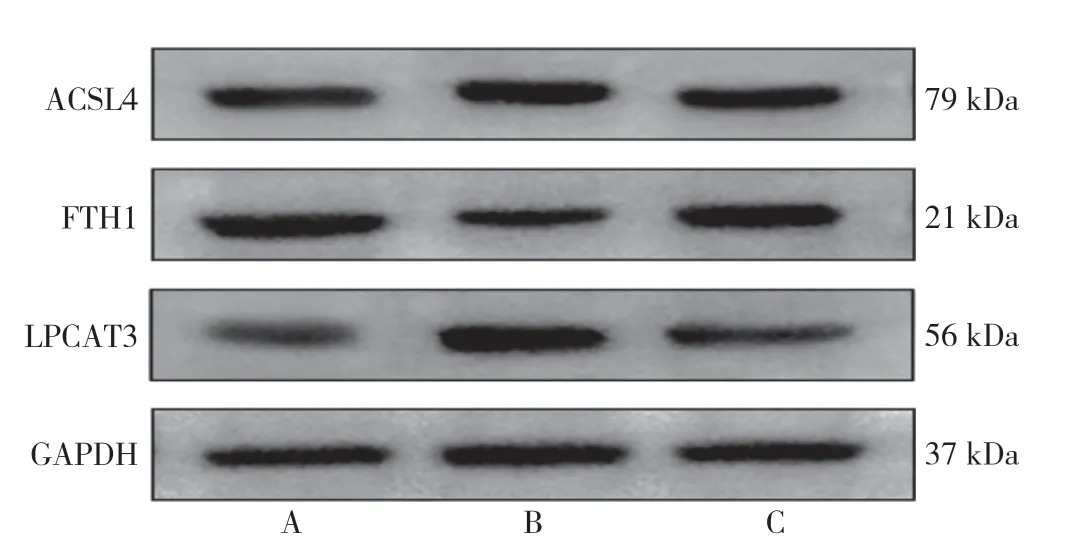
图2 术后7 d 观察亚组大鼠海马ACSL4、FTH1 和LPCAT3 蛋白条带图Figure 2 The protein bands of ACSL4,FTH1 and LPCAT3 in 7 d postoperative subgroups
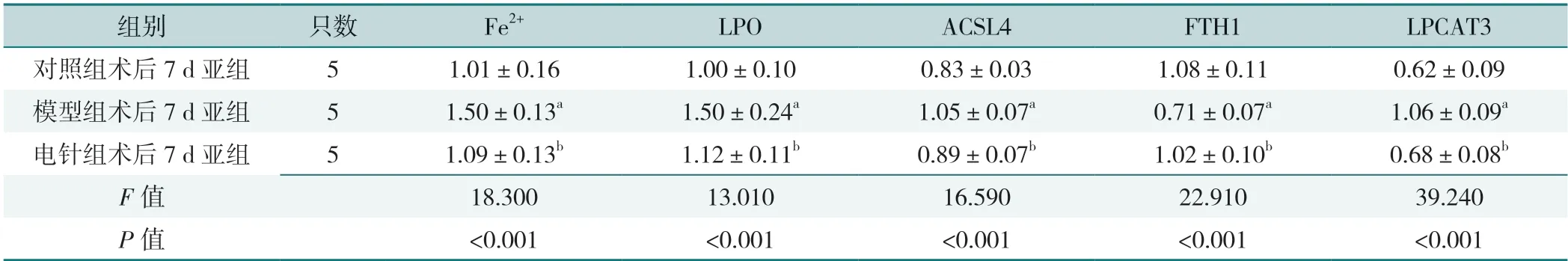
表10 术后7 d 各亚组大鼠海马Fe2+、LPO、ACSL4、FTH1 和LPCAT3 相对表达水平比较Table 10 Comparison of relative expression levels of Fe2+,LPO,ACSL4,FTH1,and LPCAT3 in 7 d postoperative subgroups
2.4 大鼠术后海马组织超微结构变化
对照组术后3 d、7 d 亚组海马组织视野内细胞核形态规则、表面光滑,双核膜结构清晰,核周隙正常,核内染色质未见凝集;胞质内部分线粒体自噬;内质网丰富,未见明显扩张,见图3A、图3 d。模型组术后3、7 d 亚组海马组织视野内细胞核双核膜结构清晰,核周隙未见明显增宽,形态不规则,表面凹凸不平;核内染色质浓缩边集;胞质内少量线粒体膜破裂,膜结构消失;部分内质网明显扩张;并可见部分髓鞘断裂,排列紊乱,见图3B、图3E。电针组术后3、7 d 亚组海马组织视野内细胞核形态规则,表面光滑,双核膜结构清晰,核周隙未见明显增宽,染色质分布较均匀;胞质内部分线粒体膜破裂,嵴结构消失或减少,基质电子密度降低呈空泡化,并可见少量线粒体自噬;部分内质网可见轻度扩张;并可见少量自噬体;胞质内还可见少量电子密度中等的均质性无界膜的脂滴,见图3C、图3F。

图3 大鼠海马组织超微结构Figure 3 Ultrastructure of rat hippocampal tissues
3 讨论
POCD 患者主要症状包括术后精神错乱、焦虑、人格改变以及记忆力和认知能力减退。其属于中医“痴呆”“健忘”“呆病”等范畴,病位在脑,与心肝脾肾紧密相关。“髓减脑衰,神机失用”是其主要病机。因肾精不足、气血亏虚或情志所伤,髓海失充,脑失所养;或瘀血、实邪痹阻脑络,清窍失养,脑髓空虚而发病[12]。
铁死亡是近年来提出的一种以铁依赖性LPO 和脂质活性氧(reactive oxygen species,ROS)堆积为特点的新型细胞死亡方式,其发生主要是由于细胞铁代谢紊乱、氨基酸抗氧化系统不平衡以及LPO 堆积导致的。Fe3+在铁死亡过程中至关重要,铁代谢紊乱会使Fe2+过多的累积在细胞内,Fe2+通过芬顿反应导致ROS 积累,引起细胞氧化应激损伤。FTH 是一种铁载体蛋白,能够将Fe3+转运到细胞内,从而维持细胞内Fe3+的平衡,并具有铁氧化酶活性,以防止铁介导的ROS 产生[13]。研究表明,麻醉/手术后细胞或脑铁含量显著增加,FTH 表达下降,海马神经元细胞活力下降,且伴随着认知功能损伤[14-15]。LPO 积累是细胞发生铁死亡的另一因素,需要多种关键酶的激活,如ACSL4 和LPCAT3[16]。ACSL4 是多不饱和脂肪酸代谢的重要同工酶,决定了细胞铁死亡的敏感性。人神经母细胞瘤细胞经七氟醚处理后,胞内Fe2+和ACSL4 水平明显升高;沉默ACSL4 能够明显抑制七氟醚诱导的细胞铁死亡过程[17]。本研究发现,术后大鼠海马Fe2+、ACSL4 和LPO 水平显著升高,FTH1 水平显著降低;且经电针处理后,海马Fe2+、ACSL4 和LPO 水平显著降低,FTH1 水平显著升高,并伴随着大鼠学习和记忆功能的改善。
线粒体结构和功能的改变亦是细胞发生铁死亡的典型标志。在形态学上,主要表现为线粒体萎缩缺失、双层膜密度增加、嵴减少或消失、外膜破裂等[18]。本研究通过透射电镜观察海马超微结构变化,发现POCD 大鼠海马神经元细胞胞质内线粒体膜破裂,膜结构消失,表明麻醉/手术创伤可导致老年大鼠海马神经元铁代谢紊乱、脂质代谢异常和线粒体结构改变,神经元细胞发生铁死亡,进一步引起认知功能障碍;电针可通过神经元铁死亡途径缓解POCD。
麻醉/手术还会影响炎症细胞因子表达水平。手术后手术部位炎症细胞因子增加,大脑独特的炎症细胞(如小胶质细胞)响应促炎因子而被激活,并促进神经炎症的进展[19]。IL-6 作为免疫系统中重要的信号分子,可以调节神经元和突触功能,包括突触传递和突触可塑性,这是学习和记忆的重要细胞机制[20]。正常情况下,中枢神经系统中的IL-6 表达水平通常较低,但在一些与认知功能和行为学改变相关的中枢神经系统疾病中IL-6 表达水平则明显升高[21]。促炎细胞因子TNF-α 在免疫和炎症以及控制细胞增殖、分化和凋亡中亦起重要作用[22-23]。在炎症反应中,诱导TNF-α可产生多种外源性和内源性信号,刺激其他炎症细胞因子的产生,如IL-1、IL-6、IL-8、集落刺激因子(colony stimulating factor,CSF)、干扰素(interferon,IFN)和转化生长因子(transforming growth factor,TGF)-β。IL-10 是一种细胞因子合成抑制因子(cytokine synthesis inhibitory factor,CSIF),可调节细胞的生长与分化,参与炎性和免疫反应。在炎症和细胞死亡中起核心作用的促炎细胞因子,如IL-1、IL-2、IL-6、IL-8、IL-12、TNF-α 和IFN-γ 的表达均受IL-10 的免疫调节负向调控[24]。POCD 中枢神经炎症假说认为,外周炎症因子的变化可能影响中枢神经系统,随后引起中枢神经系统炎症反应。本研究发现,手术后大鼠血清和海马炎性因子IL-6、IL-10 和TNF-α 水平明显升高,促炎和抗炎细胞因子之间的失衡也是POCD 发展的一个重要病因机制。
电针是将针刺入穴位,并通过针引入电流,从而将电和针结合起来,以增强针刺的强度和效果[25]。本研究团队前期通过系统评价的方法证实,电针可以有效缓解老年患者和胃肠道肿瘤切除患者术后认知功能损伤[6,26]。本研究选取百会和内关穴,设置参数为20/100 Hz 疏密波型,对大鼠进行围术期5 d 的电针刺激,相关结果有效地降低了大鼠术后认知功能损伤。百会穴和内关穴是临床实践中电针预防POCD 最常选择的两个穴位。百会穴为督脉要穴,有疏散风寒、温经通阳、升阳固脱、镇惊息风、清热开窍等作用,为回阳救逆之要穴;内关穴为八脉交会穴之一,手厥阴心包经之络穴,针之可调和阴阳、理气通脉、养心清脑、回阳救逆[27]。
综上所述,神经元细胞铁死亡和炎症细胞因子之间的失衡可能是POCD 发生的重要机制,电针百会穴和内关穴可通过调控神经元细胞铁死亡和炎症细胞因子水平有效缓解POCD。本研究为电针改善POCD 提供了新的思路和方法,但电针的脑保护作用机制仍需要进一步验证和更深入的研究。
作者贡献:秦晓宇、王春爱负责选题,进行研究构思和设计;秦晓宇负责研究的实施和推进,数据收集、统计分析并起草了论文;秦晓宇、张斌森、张笑佳、逯晓婷、刘鸿鑫负责动物实验、数据收集和数据整理;秦晓宇、张斌森、张笑佳负责实验指标检测;王春爱负责文章的质量控制和审查,对文章整体负责。
本文无利益冲突。

