基于深度学习自动勾画在鼻咽癌调强放射治疗计划中的系统性评价研究
赖建军 陈丽婷 胡海丽 蒋璐 高畅 喻冰琪 吴竞 吴稚冰
鼻咽癌在我国的发病率较高,其主要治疗手段为以放射治疗为主的综合治疗,其中的调强放射治疗(Intensity modulated radiotherapy,IMRT)能给予肿瘤靶区更好的适形性和剂量跌落梯度,在更准确地照射肿瘤区域的同时能更好地保护周围危及器官(Organs at risk,OARs),是目前头颈部肿瘤放疗的主流技术方法[1,2]。在进行鼻咽癌IMRT 放疗计划设计时,因头颈部解剖结构复杂且OARs 较多,传统的人工勾画方法不仅耗时费力,且缺乏一致性和规范性,因此,自动勾画技术成为当前的研究热点[3~6]。
自动勾画程序是利用医学图像分割技术,在某种最优算法下将参考图像与待勾画图像的解剖特征进行空间映射及转换来完成自动勾画过程。本研究基于深度学习(Deep learning,DL)的连心智能云自动勾画平台(AIcontour),通过对20 例既往行鼻咽癌放疗的患者的放疗计划资料进行回顾性研究,通过基于人工勾画的OARs 对AIcontour 自动勾画的相应结构勾画质量进行几何学评价、剂量学评价和时间测评,多维度系统性研究DL 自动勾画的OARs 在鼻咽癌IMRT 放疗计划中的可行性和临床应用价值。
1 材料与方法
1.1 病例选择与自动勾画在Raystation 计划系统上选取已完成IMRT 治疗的20 例鼻咽癌患者放疗计划资料,该20 例患者OARs 均为人工勾画,并由主任医师审核通过,其中OARs 包括脑干、脊髓、眼球、晶体、视神经、腮腺、视交叉。将CT 图像和人工勾画的OARs 导入AIcontour 进行相应结构的自动勾画。
1.2 自动勾画精度几何学评价在AIcontour 上,以人工勾画的OARs 轮廓体积为基准真值,采用形状相似性系数(Dice coefficient,DCS)、Jaccard 系数(Jaccard coefficient,JC)、Hausdorff 距离(HD)、体积差异(Volume difference,VD)指标定量评估DL 自动勾画方法获得的 OARs 轮廓体积的精确性。
1.2.1 DCS DCS 用于评价自动勾画与人工勾画OARs 的重合性。DCS=2×(Va∩Vm)/(Va+Vm),其中,Va 为自动勾画OARs 的体积,Vm 为人工勾画OARs 的体积。DCS 值范围0~1,DCS 值越接近于1,表示两种勾画方式的重合性越好。DSC>0.7 代表自动勾画与人工勾画的结构重合性较好[3,4]。
1.2.2 JC JC 用于度量两个集合(A 和B)之间的相似性,定义为两个集合交集的大小除以并集的大小,其计算公式为J(A,B)=|A∩B|/|A∪B|,0 ≤J(A,B)≤1,JC 数值越大,表示样本相似度越高。
1.2.3 HD HD 是度量空间中任意两个集合之间距离的量。定义空间中的两个点集A={a1,a2,…},B={b1,b2,…},HD 用于衡量A、B 之间的距离,计算公式为HD(A,B)=MAX[H(A,B),H(B,A)]。
1.2.4 VD VD 是自动勾画与人工勾画结果体积差异,其计算公示为VD=Va-Vm,其中,Va 为自动勾画OARs 的体积,Vm 为人工勾画OARs 的体积。
1.3 基于自动勾画的计划设计将自动勾画的OARs 体积结构导入Raystation 计划系统相应患者结构集,重新以自动勾画的OARs 为剂量限制结构进行能量为6MV 的9 野均分IMRT 计划设计,最大子野数(Segments)为70 个,最小子野面积为2cm2,最小子野MU 为5。靶区处方剂量:PGTVnx 69Gy、PGTVnd 66Gy、PTV 60Gy,分32 次,95%靶区体积满足处方剂量。
1.4 剂量学评价IMRT 放疗计划经主任医师审核通过后,同时勾选自动勾画和人工勾画的OARs 体积进行OARs 剂量学比较。评估以DL 自动勾画OARs 作为剂量限制结构在进行计划设计时,作为基准真值人工勾画的OARs 体积与自动勾画OARs体积的剂量学差异。
1.5 OARs 勾画时间测评本研究20 例患者均由同一名主任医师分别对纳入的OARs 进行人工勾画、自动勾画、自动勾画加人工干预,分别记录三种勾画方式所需时间。
1.6 统计学方法利用SPSS 22.0 软件对两组勾画的几何学评价、剂量学评价结果进行统计分析,行配对t检验。三种不同勾画方式的勾画时间结果以表示,行方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 自动勾画几何学精度结果20 例基于人工智能的自动勾画与人工勾画头颈部OARs 几何学评价参数的统计学结果见表1。其中,左右眼球、左右腮腺、脑干、脊髓的DCS、JC 平均值均大于0.7;左右晶体的DCS、JC 平均值为0.6~0.7;左右视神经的DCS、JC 平均值为0.4~0.6;视交叉的DCS 平均值为0.42,JC 平均值为0.28。VD 方面,自动勾画的眼球、视交叉、腮腺体积大于人工勾画体积,晶体、视神经、脑干、脊髓自动勾画体积小于人工勾画体积。HD 距离最大值为左右腮腺,分别为(17.12±0.11)mm、(12.98±0.11)mm。见表1、图1。
表1 20 例自动勾画与人工勾画头颈部OARs 几何学评价参数()

表1 20 例自动勾画与人工勾画头颈部OARs 几何学评价参数()
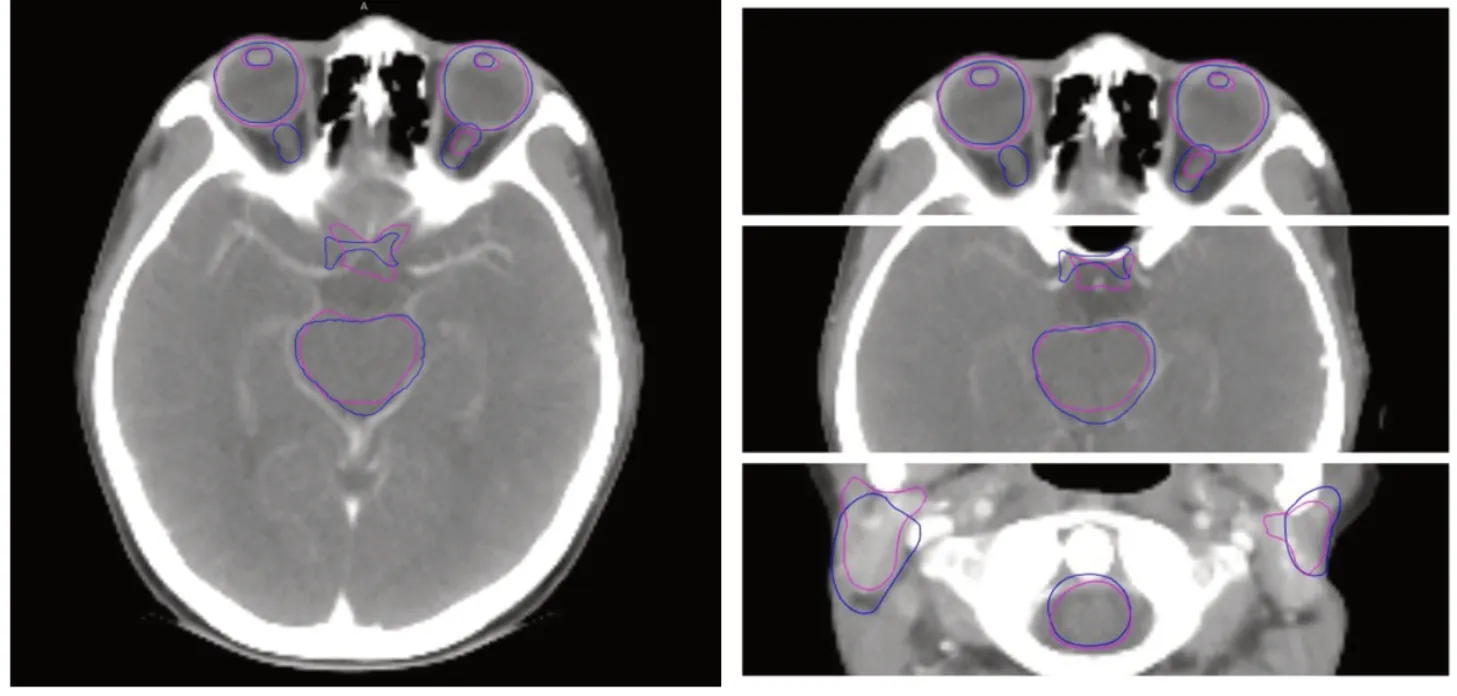
图1 自动勾画与人工勾画头颈部OARs 对比图
2.2 自动勾画OARs 和人工勾画OARs 受照剂量比较自动勾画OARs 设计的放疗计划经主任医师审核通过后,各限制结构均满足临床需求,其中人工勾画左右晶体、左右视神经和视交叉的OARs 体积受照剂量大于自动勾画(P<0.05)。见表2。
20 例患者串行器官受照剂量分布折线图显示,在自动勾画OARs 作为剂量限制结构设计的放疗计划下,人工勾画的左右晶体、左右视神经、视交叉最大受照剂量分布明显偏离自动勾画,1 例患者右晶体、3 例患者左视神经、1 例患者右视神经、4 例患者视交叉均超出最大剂量限值。脑干和脊髓的人工勾画和自动勾画最大受照剂量分布趋势一致。箱线图结果显示,人工勾画的OARs 中右晶体、右视神经出现较大偏态值。见图2~7。
2.3 鼻咽癌OARs 人工勾画、自动勾画、自动勾画加人工干预三种勾画方式时间比较人工勾画时间为(90.1±12.2)min,自动勾画时间为(1.1±0.2)min,自动勾画加人工干预勾画时间为(19.2±2.1)min,三种方式勾画时间比较,差异有统计学意义(P<0.05)。
表2 自动勾画计划下的自动勾画OARs 和人工勾画OARs受照剂量比较(cGy,)

表2 自动勾画计划下的自动勾画OARs 和人工勾画OARs受照剂量比较(cGy,)

图2 自动勾画计划下20 例患者晶体受照剂量折线图(单位:cGy)
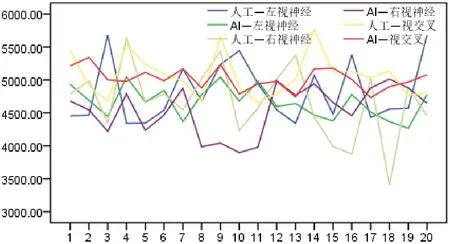
图3 自动勾画计划下20 例患者视神经和视交叉受照剂量折线图(单位:cGy)
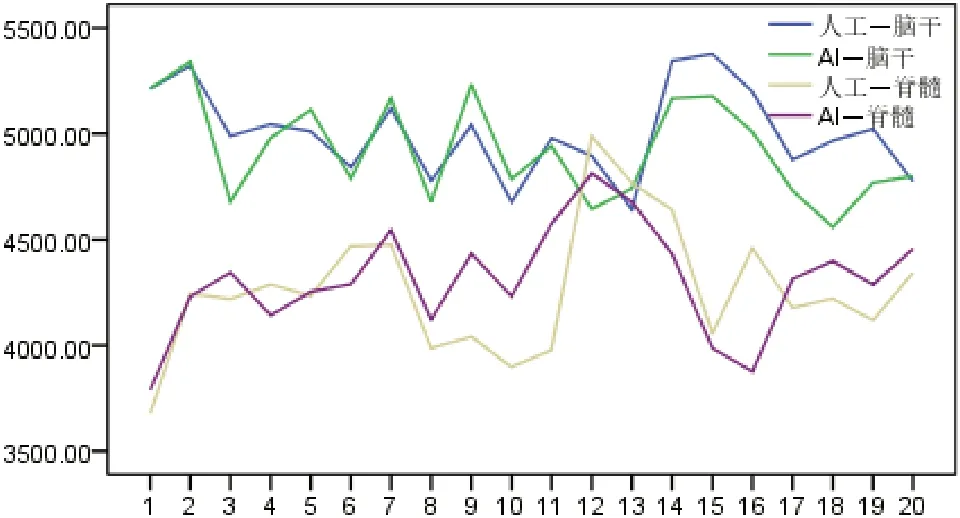
图4 自动勾画计划下20 例患者脑干和脊髓受照剂量折线图(单位:cGy)

图5 自动勾画计划下20 例患者晶体受照剂量箱线图(单位:cGy)

图6 自动勾画计划下20 例患者视神经和视交叉受照剂量箱线图(单位:cGy)
3 讨论
放疗中OARs 自动勾画是利用计算机处理下的医学图像自动分割技术来实现OARs 轮廓的自动勾画过程,精准高效的自动勾画工具可以减轻放疗医生工作量、缩短放射治疗靶区勾画时间并提高放疗计划质量[5~7]。近几十年来,自动图像分割技术逐步快速发展,传统放疗CT 图像自动勾画技术为基于图谱的自动分段软件(Atlas-based autosegmention software,ABAS)勾画,该技术的图像分割方式为将待勾画图像与数据集图像进行配准后标记[9],其处理过程包括图像预处理、图集创建、图像配准和标记融合多个步骤,OARs 自动勾画的精准实现受到图集创建方法[8~12]、标记融合方法[13,14]、图像配准方法[15~18]的影响。基于图谱库的ABAS 自动勾画目前在临床应用广泛,但其使用相对固定的图像数据集,勾画精度的进一步发展受限于处理不同患者的解剖结构变化,且有效地执行一次勾画任务需要计算机密集处理较多的图像数据,耗时较长。近年来,基于DL 的快速图像分割技术逐步发展[19~23],其中深度卷积模型的DL 图像分割技术研究在生物医学图像分割中取得较大进展并应用于肿瘤放疗的OARs 自动勾画中[24]。本研究使用的连心智能云AIcontour 自动勾画平台,是基于DL 技术,运用U-net 卷积神经网络DL 算法,采用标准数据对其进行有效训练,通过算法逻辑实现图像快速自动分割,是一种高效的自动勾画程序。
在针对DL 的放疗OARs 自动勾画工具评价研究中,自动勾画程序在胸腹部肿瘤放疗中的勾画效果与人工勾画相比具有较高的精度,数秒就可以快速勾画全部OARs,可以较好地辅助人工进行放疗计划设计[25~27]。在鼻咽癌的放疗中,OARs 多且解剖结构复杂,这时精准快速的自动勾画工具就具有较高的临床实用价值。目前针对鼻咽癌放疗OARs的DL 自动勾画既往研究多为对勾画结果与人工勾画进行几何学参数比较,缺乏多个病例的剂量学评价研究。本研究使用AIcontour 自动勾画平台,对20 例已完成鼻咽癌放疗病例进行回顾性研究,通过基于人工勾画的OARs 对自动勾画质量同时进行几何学评价和剂量学评价,并对勾画所需时间进行时间测评,系统性多维度研究DL 自动勾画的OARs在鼻咽癌IMRT 放疗计划中的可行性及临床应用价值。
本研究结果中的几何学评价分析结果显示,以主任医师手工勾画为金标准,左右眼球的DCS 值为0.92±0.03、0.94±0.03,JC 值为0.85±0.08、0.88±0.06,HD 距离为(1.21±0.11)mm、(1.41±0.11)mm,其勾画结果在所有OARs 中最好。较大体积的OARs 脑干、脊髓、左右腮腺DCS 和JC 平均值均大于0.7,腮腺HD 距离较大,差异位置主要集中在腮腺内侧,说明人工勾画和自动勾画在器官体积边界定义上具有一定差异。对于较小体积的OARs,其中左右视神经、视交叉DCS 和JC 平均值均小于0.6,视交叉DCS 和JC 平均值最低仅为0.42 和0.28,勾画结果较差。左右晶体自动勾画DCS 和JC 平均值均≤0.7 且接近于0.7,其勾画结果也并不理想。小体积OARs 由于体积较小,CT 层数较少,且CT 图像对于软组织器官的分辨率不高,对人工勾画造成影响,机器学习的原始数据差异较大,进而导致自动勾画结果较差。Ibragimov 等[28]对50 例CT 图像DL 自动勾画研究DCS 值结果显示,脊髓为0.87±0.12,左腮腺为0.76±0.06,右腮腺为0.77±0.05,左眼球为0.88±0.11,右眼球为0.89±0.04,左视神经为0.63±0.09,右视神经为0.64±0.10,视交叉为0.37±0.13,小体积OARs 尤其是视交叉和视神经勾画效果较差,与本研究结果基本一致。
剂量学评价研究结果显示,并行器官中左右眼球和左右腮腺受照剂量平均值自动勾画与人工勾画接近,均未超出剂量限值,且自动勾画结果可以满足放疗计划需求。串行器官中,中枢神经系统脑干和脊髓的受照剂量平均值自动勾画与人工勾画接近。20 例鼻咽癌患者脑干和脊髓自动勾画与人工勾画最大剂量分布基本一致,且最大剂量均未超出剂量限值,本研究中脑干和脊髓的自动勾画作为剂量限值结构可满足临床放疗计划需求。在自动勾画OARs 计划下,人工勾画的左右晶体最大受照剂量分布偏离于自动勾画,且有1 例患者右晶体超出最大剂量限值;人工勾画的左右视神经和视交叉最大受照剂量分布偏离自动勾画,其中3 例患者左视神经、1 例患者右视神经、4 例患者视交叉超出最大剂量限值;箱线图统计结果显示,右晶体、右视神经也显示出较大偏态值。对于晶体、视神经、视交叉这三种小体积OARs,以自动勾画体积作为剂量限制结构,会造成主任医师勾画的OARs 超出剂量限值,不能满足临床放疗计划设计需求。
放疗计划是鼻咽癌IMRT 成败的关键因素,OARs 的精准勾画是放疗计划品质的重要保障。但自动勾画结果受限于机器学习的标准数据集,而标准数据集又来源于人工勾画,对于头颈部的晶体、视神经、视交叉这些小体积OARs,其CT 图像分辨率不高,人工勾画困难,个体差异较大,难以创建标准数据集以供机器学习。对于眼球、腮腺两种并行器官,因进行平均剂量限制,自动勾画体积差异对受照剂量结果影响较小,本研究结果显示,自动勾画结果可以直接作为放疗剂量限制结构。对于脊髓、脑干两种串行器官,虽然本研究呈现出较好的研究结果,但体积差异对串行器官最大剂量限值较为敏感,建议临床医师对自动勾画结果仔细审核以规避风险。对于晶体、视神经、视交叉三种小体积OARs,本研究结果显示需要对自动勾画结果进行人工干预,以满足临床放疗计划需求。蒋皤等[29]研究认为,即使是最优的鼻咽癌OARs 自动勾画结果也不能满足临床放疗计划需求。本研究三种勾画时间测评结果显示,人工勾画时间为(90.1±12.2)min、自动勾画时间为(1.1±0.2)min、自动勾画加人工干预勾画时间为(19.2±2.1)min,三者比较差异有统计学意义(P<0.05)。
综上所述,本研究使用的AIcontour 自动勾画平台,虽然其自动勾画结果不能完全满足鼻咽癌放疗计划要求,但可以仅对小体积OARs 进行人工干预后用于临床放疗计划设计,可显著提升放疗医生工作效率,具有较高的临床实用价值。

