基于核桃油-辛酸酶法合成新型结构脂的研究
焦云琦, 徐丹亚, 梅 洁, 马 慧, 刘凤兰, 孔令明
(新疆农业大学食品科学与药学学院1,乌鲁木齐 830000)(新疆林科院经济林研究所2,乌鲁木齐 830000)
结构脂是在油脂代谢及营养学研究的基础上开发的一类新型油脂,通过改变甘油三酯的骨架上脂肪酸的组成和位置的分布,可以将有特殊的营养功能或生理功能的脂肪酸结合到指定位置,充分发挥其营养功能和生理功能[1-5]。中长链结构脂一方面通过中链脂肪酸提供机体所需的能量,另一方面通过长链脂肪酸为机体提供营养。目前已有以芝麻油、花生油、菜籽油、金枪鱼油和大豆油、玉米油等为原料生产结构脂[6-13],而以核桃油为原料的研究相对较少,并且目前大部分研究关注结构脂的功能特性,忽略了其原料油脂本身的营养特性,对结构脂制备的原料油脂的筛选研究较少。核桃油是一种高营养的食用油,不饱和脂肪酸含量极高且有较好的油酸比例,适合人体吸收。除此之外,还含有丰富的微量成分如维生素、磷脂等,具备多种生物活性,如健脑、消除炎症、改善Ⅱ型糖尿病患者的脂质状况等[14-16]。因此,以核桃油为原料制备核桃油-辛酸结构脂对于提高结构脂的营养功能及生理功能有重要意义。
以核桃油为原料油,加入辛酸并利用固定化脂肪酶Lipozyme TL IM 进行催化,发生酸解反应,将核桃油转化为核桃油-辛酸结构脂,通过单因素实验对核桃油-辛酸结构脂的影响,并进行响应面优化核桃油-辛酸结构脂的制备,从而获得核桃油-辛酸结构脂。
1 材料与方法
1.1 材料
1.1.1 原料与主要试剂
核桃油:实验室以新疆温185品质核桃为原料压榨而成;固定化脂肪酶Lipozyme TL IM,固定化脂肪酶Lipozyme RM IM,固定化脂肪酶Novozym 435,购自诺维信公司;正辛酸,冰乙酸,三氯甲烷,韦氏试剂,环己烷,硫代硫酸钠标液。
1.1.2 主要仪器与设备
TDL-5-A离心机,PL203电子天平,恒温水浴摇床,气相色谱仪Aglient 7890。
1.2 实验方法
1.2.1 核桃油与辛酸的酸解反应单因素实验
将核桃油与辛酸以一定比例的底物摩尔比混合,并加入一定量脂肪酶完全融合后,在无溶剂体系中,一定温度条件下密闭振荡反应一段时间,反应结束后在4 500 r/min条件下离心15 min除去脂肪酶,得到核桃油结构脂。采用单因素实验探究底物摩尔比辛酸∶核桃油(1∶1、2∶1、3∶1、4∶1和5∶1),酶质量分数(8%~16%),不同的反应时间(6~12 h),不同的反应温度(35~75 ℃)对于核桃油-辛酸结构脂中辛酸插入率[17-20]的影响。
1.2.2 酸解法合成-辛酸结构脂响应面优化实验
运用Box-Behnken响应面设计法,在单因素实验基础上,每个因素选取 3 个水平,以底物摩尔比(A)、加酶量(B)、反应时间(C)、反应温度(D)3个因素为考察对象,以辛酸插入率为参考值Y,建立酶催化核桃油与辛酸酸解反应的二次回归数学模型。
1.3 核桃油甲酯化
称取 50 uL 核桃油-辛酸结构脂样品于 15 mL试管中,加 0.3 mL的乙醚与0.7 mL的正己烷溶解油样,再用移液枪加入1.0 mL甲醇溶液,加入甲醇-氢氧化钾溶液10 mL与油样混匀,再加入 2.0 mL饱和氯化钠水溶液,涡旋振荡混匀,静置 20 min使其分层。在 3 000 r/min离心 5 min,吸取上层清液用于GC分析。
1.4 气相色谱检测条件
色谱柱:HP-88 毛细管柱(100 m×0.25 mm;膜厚 0.25 μm);检测器为氢火焰离子化检测器(FID),进样口的温度设置为 260 ℃,检测器温度设置为 280 ℃。升温程序:120 ℃保持 1 min,然后以 20 ℃/min升温至 175 ℃并保持 10 min,最后以 1 ℃/min升至200 ℃保持 10 min。载气为氢气(纯度>99.9%);进样量 1 μL,分流比为 50∶1。氮气流速:30 mL/min,空气流速 400 mL/min,氢气流速 40 mL/min。
1.5 理化性质的测定
过氧化值参考GB 5009.227—2016《食品安全国家标准食品中过氧化值的测定》。
碘值参考GB/T 5532—2008《动植物油脂碘值的测定》。
2 结果与分析
2.1 核桃油总脂肪酸组成与含量
核桃油在甲酯化法处理后经过气相色谱测定,对混合脂肪酸甲酯进行定性和定量分析,对核桃油的营养价值进行科学评价,根据气相色谱图谱核桃油脂肪酸组成含量如表1所示。

表1 核桃油总脂肪酸组成
从表1可以看出,核桃油中各脂肪酸甲酯分离情况较好,杂峰比较少,对比37种脂肪酸甲酯混标与样品的保留时间进行定性,发现在核桃油中得到6种脂肪酸甲酯混合物。核桃油中的脂肪酸组成与含量,其中含有6种脂肪酸分别是棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸,主要以不饱和脂肪酸为主,不饱和脂肪酸质量分数为89.83%,其中单不饱和脂肪酸的质量分数为19.13%,多不饱和脂肪酸的质量分数为70.69%,与前人的研究结果基本一致[17,21]。
2.2 酸解法制备核桃油-辛酸结构脂单因素实验结果分析
2.2.1 酶的种类对核桃油-辛酸结构脂脂肪酸种类及含量的影响
为筛选出通过无溶剂体系能够将辛酸最大程度与核桃油结合的固定化脂肪酶,选用商业固定化脂肪酶 Novozym 435、Lipozyme TL IM、Lipozyme RM IM 进行实验,考察其对核桃油-辛酸结构脂合成的催化活性。不同酶进行酸解反应核桃油-辛酸结构脂的脂肪酸组成及含量对比如表2所示。

表2 不同酶进行酸解反应核桃油-辛酸结构脂的脂肪酸组成及质量分数/%
表2可知,通过酸解反应,不同的脂肪酶作为催化剂对核桃油-辛酸结构脂中脂肪酸组成有不同的影响,当脂肪酶 Lipozyme TL IM 和脂肪酶 Lipozyme RM IM 参与反应时,核桃油-辛酸结构脂的脂肪酸种类相较于核桃油发生了变化,增加了辛酸及少量羊蜡酸,而当脂肪酶Novozym 435参与反应时,脂肪酸种类增加了辛酸及二十碳烯酸,辛酸的插入量相较于其他2种固定化脂肪酶低。辛酸插入率从高到低的顺序为:脂肪酶 Lipozyme TL IM>脂肪酶 Lipozyme RM IM>脂肪酶Novozym 435,范围从2.02%到27.88%。从成本及辛酸插入率两个方面考虑,最终选择脂肪酶 Lipozyme TL IM作为后续的反应催化剂,与前人研究结果一致[18,19,22,23]。
过氧化值越高说明油脂酸败程度越高,核桃油本身的过氧化值符合GB/T 22327—2008 核桃油的要求。由图1可知,使用不同种类的脂肪酶都对核桃油-辛酸结构脂的过氧化值有一定的影响,并且使用脂肪酶Lipozyme TL IM 作为催化剂时,其过氧化值最低,说明其油脂酸败的程度最低。
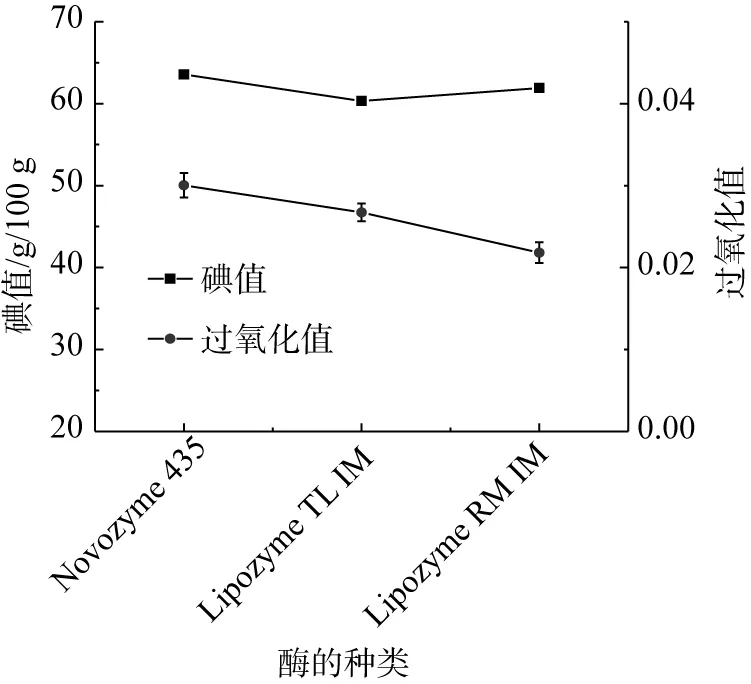
图1 不同脂肪酶对核桃油-辛酸结构脂的碘值及过氧化值的影响
由图2可以看出,使用脂肪酶Lipozyme TL IM 、脂肪酶Lipozyme RM IM 和Novozym 435这3种酶作为催化剂时,其碘值相差不大。碘值越高说明油脂的不饱和程度越高,结合表3,相较于核桃油,核桃油-辛酸结构脂中的不饱和脂肪酸含量降低,总脂肪酸组成及含量发生了变化,同时也反映出核桃油-辛酸结构脂较纯核桃油具有更高的氧化稳定性。
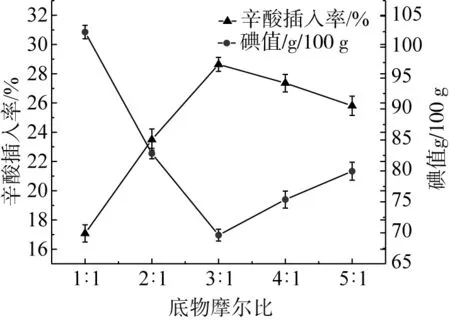
图2 不同底物摩尔比对核桃油-辛酸结构脂的辛酸插入率及碘值的影响
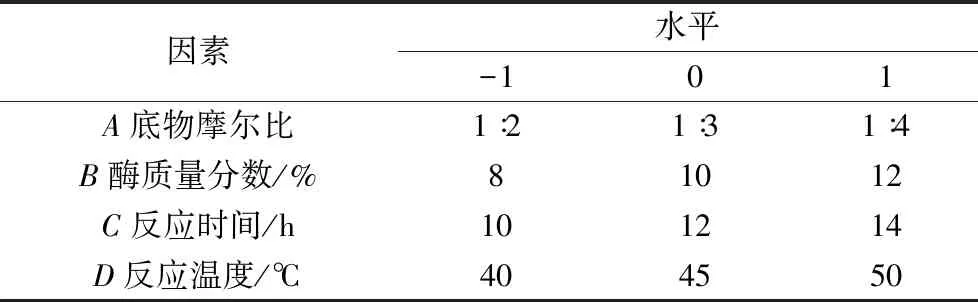
表3 响应面实验因素水平表
2.2.2 底物摩尔比对核桃油-辛酸结构脂的辛酸插入率及碘值的影响
由图2可知,在底物摩尔比为1∶1时,辛酸插入率较低,酸解反应不完全,可能是由于提供的酰基供体较少,随着底物摩尔比的增加,辛酸插入率逐渐增加。当底物摩尔比增加到3∶1时,辛酸插入率达到最高,碘值最低;这是因为在脂肪酸比例相对较低,随着脂肪酸供体比例的增加,辛酸的插入率也在提高。进一步增加摩尔比到4∶1和5∶1,辛酸插入率并没有因为辛酸含量的增加而继续增加,反而略微下降,而碘值则呈一定的上升趋势,可能是由于适当的底物摩尔比有利于反应平衡并增加底物和催化剂之间的碰撞比例。较高比例的底物摩尔比对于核桃油-辛酸结构脂的合成无益[20,24],结合经济角度考虑,选择摩尔比3∶1作为最佳底物摩尔比,与前人的研究结果一致[21,25]。
2.2.3 酶质量分数对核桃油-辛酸结构脂的辛酸插入率的影响
在底物足够,其他条件固定的条件下,反应系统中不含有抑制酶活性的物质及其他不利于酶发挥作用的因素时,酶促反应的速度与酶质量分数成正比。
由图3可知,随着酶质量分数的增加,辛酸插入率逐渐增加,碘值逐渐下降,这表示出核桃油-辛酸的饱和脂肪酸含量在不断的增加;但当酶质量分数超过10%以后呈现平缓下降的趋势,由于当酶相对于底物的切点过多时,过高的酶浓度导致酶分子之间的竞争抑制[22,26],引起辛酸插入率的下降。过高的酶质量分数对核桃油-辛酸的合成无益[23,27],结合辛酸插入率以及经济角度考虑,选择酶质量分数为10%作为最佳酶质量分数,与前人研究结果一致[23,24,27,28]。
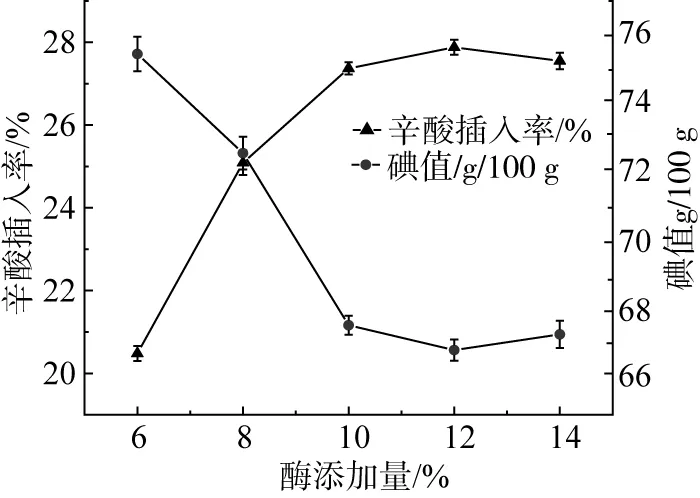
图3 酶质量分数对核桃油-辛酸结构脂的辛酸插入率的影响
2.2.4 反应温度对核桃油-辛酸结构脂的辛酸插入率的影响
酶促反应在一定温度范围内反应速度随温度的升高而加快;但当温度升高到一定限度时,酶促反应速度不仅不再加快反而随着温度的升高而下降。
图4可知,随着反应温度的增加,辛酸插入率呈上升的趋势,当温度为45 ℃时,辛酸插入率最大,达到27.37%;当温度超过45 ℃时,辛酸插入率逐渐下降,当反应温度为75 ℃时,辛酸插入率最低,为16.00%。脂肪酶Lizyome TL IM酶的最适温度范围为55~75 ℃,可能是由于反应时间较长,导致酶的最适温度下降,适当地提高温度,有助于提高酶的活性和加快反应的速度,而过高的温度使酶活性降低,从而减缓反应的速度,因此,选择45 ℃为后续的反应温度,与前人研究结果一致[25,29]。

图4 反应温度对核桃油-辛酸结构脂辛酸插入率及碘值的影响
2.2.5 反应时间对核桃油-辛酸结构脂的辛酸插入率的影响
由图5可知,随着反应时间的延长,辛酸插入率逐渐增加,但当反应时间超过12 h以后,辛酸插入率的含量开始有些下降。出现这种现象的原因可能是随着反应时间的延长,反应逐渐达到动态平衡状态[22,26],由此可知,过长的反应时间对辛酸插入核桃油的合成无益,结合辛酸插入率及能源消耗考虑,选择反应时间为12 h作为最佳反应时间,与前人研究结果一致[26,30]。
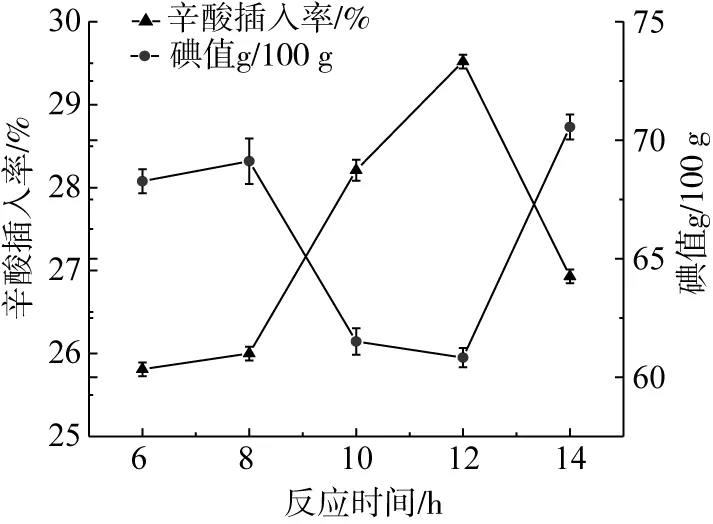
图5 反应时间对核桃油-辛酸结构脂辛酸插入率的影响
2.3 响应面实验结果分析
2.3.1 响应面实验设计
根据单因素实验结果,采用 Design-Expert 8.0 软件,以辛酸插入率为响应值,以底物摩尔比、加水量、反应时间、反应温度4个因素为自变量,设计4因素3水平共 29 点的响应面实验(其中 24个析因点,5个中心点)。因子水平编码见表 5。表3中-1,0,1分别代表因素的低、中、高水平。
2.3.2 响应面实验结果与讨论
响应面实验结果与讨论如表4所示。

表4 实验设计及结果
2.3.3 回归模型的显著性检验及方差分析
利用Design-Expert.8.0.6.1软件对表4数据进行分析,得到核桃油-辛酸结构脂的辛酸插入率与各因素之间的二次多元回归拟合方程为:
Y=32.93+2.48A+2.36B+1.48C-0.72D+1.20AB-2.56AC-1.88AD+1.62BC+2.19BD+1.39CD-7.09A2-9.95B2-2.05C2-2.34D2。
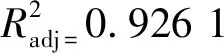
2.3.4 响应面多因素交互作用分析
底物摩尔比、酶质量分数、反应时间及反应温度4个因素对响应值的影响显著性可用F值来评价,F值越大,说明该因素对辛酸插入率的影响越大。由表6可知,F(A)=24.86,F(B)=22.53,F(C)=8.83,F(D)=2.11,辛酸插入率知受各因素影响程度大小依次为底物摩尔比(A)>酶质量分数(B)>反应时间(C)>反应温度(D),其中底物摩尔比和酶质量分数对核桃油-辛酸结构脂的辛酸插入率的影响极显著(P<0.001),反应时间C对核桃油-辛酸结构脂的辛酸插入率的影响显著(P<0.05),但反应温度D对核桃油-辛酸结构脂的辛酸插入率的影响不显著(P>0.05)。由表5可知,交互项AC、AD、BD(P<0.05),表示底物摩尔比与反应时间和反应温度的交互作用对响应值的影响显著、酶质量分数与反应温度的交互作用对响应值的影响显著,响应面坡度越大,响应值对不同条件的变化越敏感。反之,坡度越平缓,对响应值的影响越小。
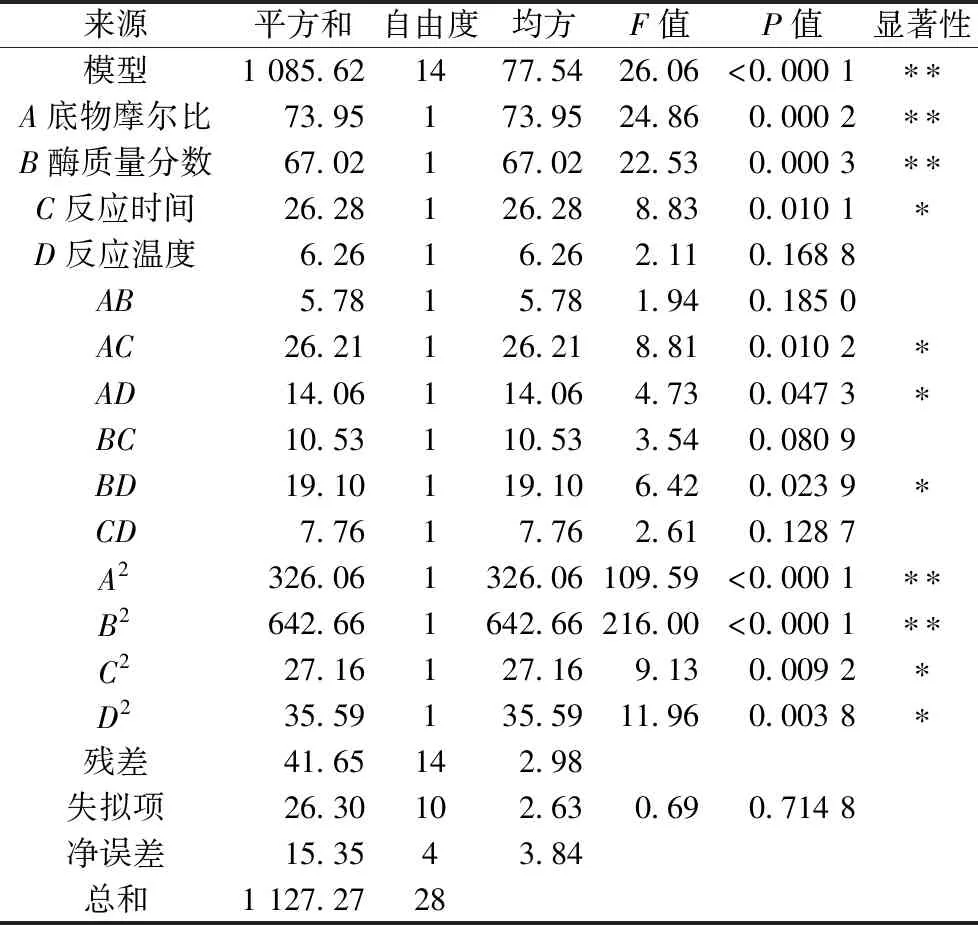
表5 响应面回归模型的显著性检验及方差分析
2.3.5 最佳条件的确定及验证实验
根据响应面分析得到核桃油-辛酸结构脂的辛酸插入率最佳的酸解条件为:底物摩尔比(辛酸∶核桃油)为3.14∶1,酶质量分数为10.3%,反应时间为12.64 h,反应温度为44.79 ℃,在这个条件下,核桃油-辛酸结构脂的辛酸插入率可以达到33.53%。考虑到实际操作性上,将实际实验条件调整为底物摩尔比(辛酸∶核桃油)为3∶1,酶质量分数为10%,反应时间为12.6 h,反应温度为44.8 ℃,在此条件下重复3次实验,取平均值得到核桃油-辛酸结构脂的辛酸插入率为32.37%,接近软件优化的最大值,因此采用响应面分析法得到核桃油-辛酸结构脂较高辛酸插入率的最佳制备工艺的条件是可行的。实验结果与预测值结果相符良好,说明响应面模型预测结果是有效的。
3 结论
通过筛选选择固定化脂肪酶Lipozyme TL IM 制备核桃油-辛酸结构脂,通过响应面结果可以得出酸解法制备核桃油-辛酸结构脂的最佳条件为底物摩尔比(辛酸∶核桃油)为3∶1,酶质量分数为10%,反应时间为12.6 h,反应温度为44.8 ℃,在此条件下,辛酸插入率为32.37%。该条件适于制备核桃油-辛酸结构脂,通过对核桃油-辛酸结构脂制备工艺可为新型结构脂的研究与开发提供参考。

