常压Mg-Na复合盐溶液体系制备α-半水石膏
李云飞,刘蜀庆,唐盛伟,张 涛
(四川大学化学工程学院,四川成都 610065)
半水石膏可分为α-半水石膏和β-半水石膏。其中,α-半水石膏具有晶面完整、硬化体强度高和生物亲和性好等特点,可用于现代建筑材料、精密铸造、牙科材料等领域[1-3]。目前,α-半水石膏主要由二水石膏通过蒸压法、加压水溶液法和常压盐溶液法制备得到。相较于蒸压法和加压水溶液法,常压盐溶液法具有工艺条件温和、不需要压力设备且生产能耗低等优点,是近几十年发展起来的一种新方法[4-6]。
采用常压盐溶液法制备α-半水石膏的主要影响因素包括盐溶液体系、转晶剂、温度、液固比、pH、杂质等[7-9]。其中,盐溶液体系及其浓度是影响二水石膏向α-半水石膏转晶过程的关键因素。盐溶液的加入可以增加二水石膏的溶解度,降低水活度,提高α-半水石膏的相对过饱和度,降低二水石膏转化为α-半水石膏的反应温度[10-11]。单一盐溶液的代表体系是NaCl 体系。杨后文等[12]研究了NaCl 盐溶液浓度对α-半水石膏晶体形貌及转化率的影响。结果表明:随着NaCl 盐溶液浓度的增加,二水石膏脱水速率加快,在95 ℃、NaCl 质量分数为20%的盐溶液中制备得到针状和长棒状的晶体;但过量的氯离子会加速反应过程中的金属单元腐蚀,从而导致样品中氯含量超标而被限制使用范围,因此反应之后需处理大量含氯废水[13]。复合盐溶液体系可调节性较高,但作用机理复杂。杨润等[14]研究表明与单一Ca(NO3)2盐溶液相比,采用Ca(NO3)2-Na2SO4复合盐溶液能够缩短磷石膏脱水反应时间,消除有机酸转晶剂的延缓效应,提高磷石膏的转换效率。
转晶过程可以在单一的Mg(NO3)2溶液中完成,但Mg(NO3)2使用浓度范围相对较高(质量分数一般为38%~41%)[15],加入少量钠盐与Mg(NO3)2形成复合盐溶液体系可以有效降低所需Mg(NO3)2浓度,从而降低α-半水石膏的生产成本。本文采用常压盐溶液法,以Mg(NO3)2为主要成分,在Mg(NO3)2-NaCl、Mg(NO3)2-NaNO3和Mg(NO3)2-Na2SO43 种复合盐溶液体系中考察了二水石膏的转晶过程。针对Mg(NO3)2-NaCl体系,系统研究了复合盐溶液浓度、转晶剂类型和用量对转晶速率和晶体形貌的影响,以期为常压盐溶液法制备α-半水石膏提供应用基础。
1 实验部分
1.1 实验原料
CaSO4·2H2O、Mg(NO3)2、NaCl、NaNO3、Na2SO4、DL-苹果酸、顺丁烯二酸、3-硝基邻苯二甲酸、NaOH及H2SO4均为分析纯。
1.2 实验过程
采用常压盐溶液法制备α-半水石膏。将盐介质配制成一定浓度的溶液,用2 mol/L NaOH 溶液与2 mol/L H2SO4溶液调节pH为5,并置于500 mL三口烧瓶中。待三口烧瓶的温度升至95 ℃后,按液固质量比为5∶1 加入二水石膏,持续以200 r/min 的速率搅拌4 h,反应过程中每隔一定时间取样,用倒置生物显微镜观察晶体形态。反应结束后,取样过滤并用沸水洗涤3次,用无水乙醇终止反应,然后于40 ℃烘箱中干燥至恒重,烘干的样品置于干燥器中保存,用于后续测试。
1.3 分析方法
采用D/Max 2500 PC 型X 射线衍射仪(XRD)分析样品物相,分析条件为Cu靶,波长λ=0.154 18 nm,扫描电压为40 kV,电流为40 mA,扫描范围为10°~80°,扫描速率为8 (°)/min;采用DSZ2000X 型倒置生物显微镜进行形貌分析,并用ImageProPlus6.0 软件评估α-半水石膏晶体的长度与直径;采用IS250型X射线能谱仪(EDS)进行元素组成分析。样品的结晶水含量参照GB/T 1766.2—1999《建筑石膏结晶水含量的测定》进行测定;样品的力学性能参照GB/T 17669.3—1999《建筑石膏力学性能的测定》使用YAW-300E型微机控制抗压抗折一体机进行测定。
2 结果与讨论
2.1 不同复合盐体系对转晶过程的影响
采 用Mg(NO3)2-NaCl、Mg(NO3)2-Na2SO4和Mg(NO3)2-NaNO33 种复合盐溶液研究了二水石膏向α-半水石膏转晶的过程,其中Mg(NO3)2质量分数为36%,其他盐介质质量分数均为1%,故将此3 种 复 合 盐 溶 液 分 别 命 名 为36%Mg(NO3)2+1%NaCl、36%Mg(NO3)2+1%Na2SO4、36%Mg(NO3)2+1%NaNO3。在液固质量比为5∶1、反应温度为95 ℃条件下考察3 种复合盐对二水石膏转晶过程的影响,结果如图1 所示。由图1a 可知,根据转晶过程中不同时间所得生成物结晶水含量的变化,可将实验过程划分为3 个阶段。第一阶段为晶体诱导阶段,即反应开始到料浆中刚好析出α-半水石膏晶体,此阶段生成物的结晶水含量基本不变,接近二水石膏的理论结晶水质量分数(20.93%)。由图1b 可知,Mg(NO3)2-NaCl、Mg(NO3)2-Na2SO4和Mg(NO3)2-NaNO33 种复合盐溶液体系的诱导时间分别为10、20、30 min。第二阶段为晶体生长阶段,即α-半水石膏晶体出现、生长再到转化完成,此阶段生成物结晶水含量不断下降,直到接近α-半水石膏的理论结晶水质量分数(6.21%)。60 min后为第三阶段,此时转晶过程已经基本结束,生成物的结晶水含量基本保持不变。以上结果表明,在3 种复合盐溶液体系中二水石膏向α-半水石膏的转晶过程均能够在60 min内完成。

图1 不同复合盐溶液对二水石膏转晶过程的影响Fig.1 Effect of different mixed salt solutions on transition of α-hemihydrate gypsum from dihydrate gypsum
不同复合盐溶液体系对α-半水石膏的晶体形貌影响结果如图2~3所示。由图2~3可知,3种复合盐溶液体系所得α-半水石膏均为长柱状;Mg(NO3)2-NaCl、Mg(NO3)2-Na2SO4和Mg(NO3)2-NaNO3体系中所得产物的平均长度分别为39.11、37.30、37.78 μm,平均直径分别为3.69、3.30、4.77 μm,平均长径比分别为11.69、10.78和8.15。结果表明,在以Mg(NO3)2为主体的复合盐溶液中,加入不同种类的少量钠盐对产物晶体形貌的影响较小。综合考虑转化速率、α-半水石膏形貌、盐溶液成本等因素,选Mg(NO3)2-NaCl体系进行了后续的工艺研究。
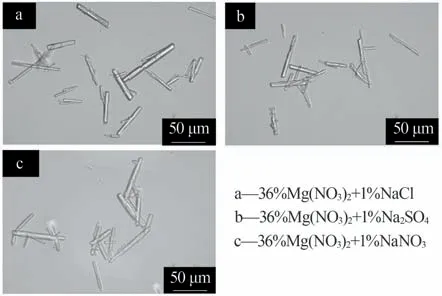
图2 不同复合盐溶液中α-半水石膏的晶体形貌Fig.2 Morphology of α-hemihydrate gypsum in different mixed salt solutions
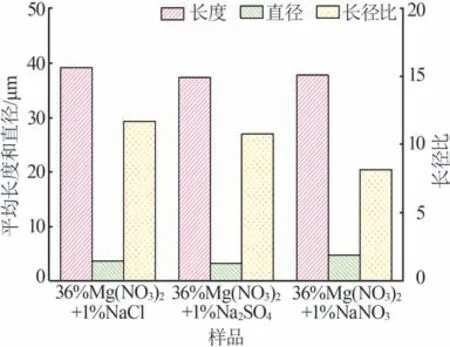
图3 不同复合盐溶液体系对α-半水石膏平均长度、直径和长径比的影响Fig.3 Effect of different mixed salt solutions on average length,diameter and aspect ratio of α-hemihydrate gypsum
2.2 Mg(NO3)2浓度对转晶过程的影响
在NaCl 质量分数均为1%的Mg(NO3)2-NaCl 复合盐溶液体系中,液固质量比为5∶1、反应温度为95 ℃条件下考察了Mg(NO3)2浓度对二水石膏转化为α-半水石膏的物相、反应速率和微观形貌的影响。图4 为不同Mg(NO3)2浓度下生成物的XRD 谱图。由图4 可见,在24%Mg(NO3)2-1%NaCl 复合盐溶液体系中生成物的XRD 谱图中显示了二水石膏和α-半水石膏的特征衍射峰,且二水石膏的峰强度较强,表明在此条件下反应4 h 后转晶过程尚未完成,产物主要为二水石膏。保持NaCl 质量分数为1%,当Mg(NO3)2质量分数≥27%时,产物的特征衍射峰均归属于α-半水石膏,说明在此条件下二水石膏基本完全转化为α-半水石膏。对30%Mg(NO3)2-1%NaCl复合盐溶液体系中制备的α-半水石膏进行了EDS分析,结果如表1所示。由表1可知,样品中只检测到α-半水石膏的特征元素O、Ca、S,且其质量分数均与α-半水石膏的理论值接近,由此说明所合成样品为α-半水石膏。

表1 α-半水石膏的化学组成Table 1 Chemical compositions of α-hemihydrate gypsum

图4 不同Mg(NO3)2浓度下生成物的XRD谱图Fig.4 XRD patterns of products at different Mg(NO3)2 concentrations
不同Mg(NO3)2浓度下二水石膏反应产物结晶水含量随时间的变化如图5a所示,相应的诱导时间和晶体生长时间如图5b所示。由图5a~b可知,随着Mg(NO3)2质量分数从27%增加到36%,结晶速率加快,诱导时间从90 min 缩短至20 min,生长时间从120 min 缩短至40 min。其机理在于半水石膏和二水石膏的溶解度差会随着Mg(NO3)2浓度的增加而增大,从而提高二水石膏转晶速率[16]。
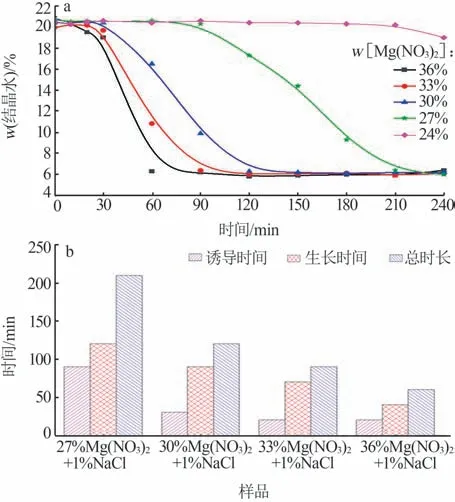
图5 Mg(NO3)2浓度对二水石膏转晶过程的影响Fig.5 Effect of Mg(NO3)2 concentration on transition of α-hemihydrate gypsum from dihydrate gypsum
图6~7 为Mg(NO3)2浓度对生成物晶体形貌的影响。由图6~7 可见,在24%Mg(NO3)2-1%NaCl 溶液中生成物的形貌主要为片状,与二水石膏的形貌一致[6],说明在此条件下二水石膏不能完全转化为α-半水石膏;保持NaCl质量分数为1%,当Mg(NO3)2质量分数≥27%时,α-半水石膏的形貌均为长柱状,且随着Mg(NO3)2浓度的增加,α-半水石膏的平均长度逐渐减小,平均长径比也总体呈下降趋势。这主要是因为Mg(NO3)2浓度越大,α-半水石膏的过饱和度越大,生成α-半水石膏晶核的数量也就越多,从而形成的晶体粒度越小,但这对长径比影响不大[17]。

图6 Mg(NO3)2浓度对生成物晶体形貌的影响Fig.6 Effect of Mg(NO3)2 concentration on morphology of products

图7 Mg(NO3)2浓度对α-半水石膏平均长度、直径和长径比的影响Fig.7 Effect of Mg(NO3)2 concentration on average length,diameter and aspect ratio of α-hemihydrate gypsum
2.3 转晶剂种类对转晶过程的影响
α-半水石膏在纯水溶液中生长为长径比大的长柱状或针状,加入转晶剂可以实现对α-半水石膏的晶形调控,降低其长径比,改善α-半水石膏的力学性能[14]。在30%Mg(NO3)2-1%NaCl 的复合盐溶液体系中,液固质量比为5∶1、反应温度为95 ℃的条件下研究了顺丁烯二酸、3-硝基邻苯二甲酸和DL-苹果酸3种转晶剂对二水石膏转化为α-半水石膏的反应速率和微观形貌的影响。图8为转晶剂种类对二水石膏转晶过程的影响。由图8a可知,添加或未添加转晶剂的二水石膏在4 h 内均可完成转化。未添加转晶剂时,样品结晶水含量曲线在30 min后出现拐点并开始下降,120 min以后曲线持平,说明反应结束;当添加质量分数为2%的3-硝基邻苯二甲酸或质量分数为2%的顺丁烯二酸时,反应诱导时间和总时长均无明显变化;当加入质量分数为2%的DL-苹果酸时,反应速率明显降低,诱导时间为60 min,反应总时长增加至150 min(图8b)。一般来说,添加转晶剂后反应的转化速率会低于未添加转晶剂时的反应速率,这是因为加入的有机酸分子吸附在反应物及生成物晶体表面上阻碍了反应物的溶解和生成物的生长[18]。

图8 转晶剂种类对二水石膏转晶过程的影响Fig.8 Effect of type of crystal modifier on transition of α-hemihydrate gypsum from dihydrate gypsum
转晶剂种类对α-半水石膏的晶体形貌影响结果如图9~10 所示。从图9~10 可以看出,未添加转晶剂的α-半水石膏以长棒状为主,其平均长度为111.58 μm,平均直径为9.37 μm,平均长径比为12.15;添加质量分数为2%的3-硝基邻苯二甲酸后,α-半水石膏晶体形貌仍为长棒状,但晶体粒度有所减小,平均长度为75.29 μm,平均直径为14.10 μm,平均长径比为13.27;添加质量分数为2%的顺丁烯二酸后,α-半水石膏的形貌仍然为长棒状,但晶体尺寸缩小较为明显,平均长度为66.09 μm,平均直径为6.75 μm,平均长径比为9.72,说明顺丁烯二酸对晶体生长的抑制作用明显;添加质量分数为2%的DL-苹果酸后,α-半水石膏的微观形貌为棒状晶体,平均长度为88.75 μm,平均直径为10.47 μm,平均长径比降低了28.8%,为8.65,说明在此条件下DL-苹果酸对晶形的调控效果最佳。
2.4 转晶剂浓度对转晶过程的影响
在30%Mg(NO3)2-1%NaCl 体系中,液固质量比为5∶1、反应温度为95 ℃的条件下,考察DL-苹果酸浓度对二水石膏转化为α-半水石膏的反应速率和微观形貌的影响。图11 为DL-苹果酸浓度对二水石膏转晶过程的影响。由图11可知,添加不同浓度的DL-苹果酸的二水石膏在4 h内均完成了转化,且随着DL-苹果酸浓度的增大,转晶速率减小,诱导时间和生长时间总体呈上升趋势。当添加质量分数为0.03%的DL-苹果酸时,诱导时间为20 min,生长时间为40 min;当DL-苹果酸质量分数升高到2%时,诱导时间增加为60 min,生长时间为90 min。这是由于DL-苹果酸对α-半水石膏表面的吸附作用抑制了α-半水石膏的生长,使转晶速率降低,反应时间延长。
不同浓度的DL-苹果酸对α-半水石膏的晶体形貌影响结果见图12~13。由图12~13 可知,不同DL-苹果酸浓度下α-半水石膏均为长柱状,晶体平均长度变化不大。当DL-苹果酸质量分数为0.03%时,α-半水石膏的平均长度为96.11 μm,平均长径比为12.67;当DL-苹果酸质量分数为1%时,α-半水石膏的平均长度为90.27 μm,平均长径比为11.56。这主要是因为DL-苹果酸可以通过羧酸根与α-半水石膏晶体表面的Ca2+产生配位作用,吸附在α-半水石膏端面的(111)晶面,抑制了该晶面的生长,进而抑制晶体轴向的生长速率,从而使晶体的长径比减小[19];当DL-苹果酸浓度增加时,这种吸附作用更为明显,因此当DL-苹果酸的质量分数增大至2%时,α-半水石膏的长径比进一步减小至8.65。

图13 DL-苹果酸浓度对α-半水石膏平均长度、直径和长径比的影响Fig.13 Effect of DL-malic acid concentration on average length,diameter and aspect ratio of α-hemihydrate gypsum
2.5 α-半水石膏的力学性能
不同浓度的DL-苹果酸为转晶剂时产物的绝干抗压强度如表2所示。由表2可知,添加不同浓度的DL-苹果酸后,样品的绝干抗压强度变化较小;当质量分数为1%的DL-苹果酸作为晶种时,α-半水石膏绝干抗压强度可达21.74 MPa。

表2 α-半水石膏的力学强度Table 2 Mechanical strength of α-hemihydrate gypsum
3 结论
1)在95 ℃条件下,Mg(NO3)2-NaCl、Mg(NO3)2-Na2SO4和Mg(NO3)2-NaNO33种复合盐溶液体系中,二水石膏均可在4 h内转晶为α-半水石膏。Mg(NO3)2-1%NaCl的复合盐溶液体系中,95 ℃时完成转晶过程所需的最低Mg(NO3)2质量分数为27%。Mg(NO3)2浓度的增大能够促进二水石膏的溶解,提高溶液的过饱和度,使α-半水石膏成核速率加快,从而使α-半水石膏的粒度减小。
2)以DL-苹果酸为转晶剂时,二水石膏转晶速率随着DL-苹果酸浓度的增加而减小,这是因为DL-苹果酸中的羧酸根可与α-半水石膏(111)晶面上的Ca2+结合产生配位作用,降低晶面吸附能,减小晶体的轴向生长速率,使α-半水石膏的平均长度和长径比降低。其中在30%Mg(NO3)2-1%NaCl 体系中,添加质量分数为1%的DL-苹果酸时,α-半水石膏的绝干抗压强度可达21.74 MPa。
3)本研究工作主要集中在Mg-Na 复合盐溶液体系,加入少量钠盐可以有效降低转晶过程所需的Mg(NO3)2浓度,使用转晶剂可以调节样品的长径比。该研究结果可为化工石膏的综合利用提供一定的参考。

