肠内营养粉对老年稳定期COPD患者肺功能及BODE指数的影响
朱鹏飞,聂晓红,周倩,张美凤,姚梦蝶,周晴,肖祝
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的可以预防和治疗的呼吸系统疾病[1]。其本质是一种全身炎症反应,可并发营养不良、骨质疏松、焦虑或抑郁、胃食管反流等多种并发症[2]。其中营养不良的发生率可达25%~65%,表现为体质量指数(body mass index,BMI)降低、脂肪减少、肌肉萎缩以及内脏蛋白减少等。营养支持是COPD 患者治疗计划中的重要部分[3]。目前针对COPD 稳定期肠内营养支持的方案较多,总体原则是高蛋白、高脂肪、低碳水化合物、补充多种维生素及矿物质。肠内营养粉作为一种营养品,常用于术后、肿瘤等存在蛋白质-能量营养不良或有营养不良风险的患者[4],但其对COPD稳定期存在营养不良或营养不良风险患者的补充效果尚鲜见报道。BODE指数包括BMI(B)、气流阻塞程度(O)、呼吸困难(D)和运动能力(E),综合了营养状态、临床症状、肺功能和运动能力等信息,能较准确地预测COPD 患者的预后[5]。本研究探讨肠内营养粉对老年稳定期COPD 患者肺功能指标及BODE 指数的影响,以期为该类患者营养支持方案的选择提供参考。
1 对象与方法
1.1 研究对象 前瞻性收集2021年1月—12月于成都医学院第二附属医院呼吸与危重症医学科就诊的COPD稳定期患者116例,其中男90例,女26例,年龄60~90岁,平均(73.84±7.04)岁。COPD 稳定期的诊断标准[6]:(1)有吸烟、被动吸烟或接触生物燃料等危险因素。(2)有过呼吸困难、慢性咳嗽和(或)咯痰为主要症状的急性发作期,目前属于稳定阶段。(3)吸入沙丁胺醇气雾剂后肺功能检查中第1 秒用力呼气容积(the first secondforced expiratory volume,FEV1)占用力肺活量(forced vital capacity,FVC)百分比<70%。纳入标准:(1)年龄≥60 岁。(2)6 个月内肺功能按COPD 全球倡议分级为3—4级。(3)胃肠道功能正常,可正常进食,营养结构大致处于蛋白质占身体供能的10%~15%,脂肪占20%~30%,碳水化合物占55%~65%。(4)能够配合抽血、6 min 步行距离(six minutes walking distance,6MWD)、改良版英国医学研究委员会呼吸问卷(mMRC)、肺功能等检查。排除标准:(1)严重心脑血管疾病、肝肾功能不全、甲状腺疾病、免疫系统疾病、有胸部手术史、哮喘、双侧胸腔积液、明显肺实变、间质性肺炎、支气管扩张、肺结核及未控制的糖尿病等。(2)认知障碍及行动不便。(3)资料不完整或中途退出者。(4)研究期间漏服肠内营养粉累计超过15 d 者。(5)患有半乳糖血症及对牛乳或大豆蛋白过敏者。(6)素食或严重偏食者。本研究获成都医学院第二附属医院伦理委员会批准(批准号:2020年审45号),获患者知情同意并签署知情同意书。
1.2 分组方法 微型营养评估(micro nutritional assessment,MNA)内容包括人体测量、一般评估、短期饮食评估和主观评估4 个部分18 条问题,共30 分[7]。按照MNA 评分将116 例COPD稳定期患者分为营养正常组(MNA>23.5分,24例)、营养不良风险组(17.0 分≤MNA≤23.5 分,65 例)和营养不良组(MNA<17.0 分,27 例)。营养正常组24 例患者行常规治疗及正常蛋白饮食(蛋白质每日摄入量为每千克体质量1.2 g)。将92例营养不良风险及营养不良者按随机数字表法分为试验组和对照组,各46例。对照组中男38例,女8例,年龄60~90岁,平均(73.74±8.06)岁,患者均行常规治疗及高蛋白饮食(蛋白质每日摄入量为每千克体质量2 g);试验组中男39例,女7例,年龄62~89岁,平均(73.50±6.75)岁,患者在常规治疗基础上予肠内营养粉剂(400 g/罐,雅培制药有限公司,热量分配为蛋白14.2%、碳水化合物54%、脂肪31.8%)治疗。再将试验组分为A 组(17.0 分≤MNA≤23.5 分,33 例)和B 组(MNA<17.0分,13例)2个亚组。肠内营养粉6勺(55.8 g)加200 mL 温水搅拌均匀,制成共计250 mL 安素溶液,于2 h 内服用完;A组每日1次,B组每日2次,持续3个月。
1.3 观察指标及测定方法 患者入院时及治疗3个月后,记录如下指标。(1)测量身高、体质量,并计算BMI。(2)采用德国MS-Diffusion 耶格(Jaeger)肺功能仪测量FEV1、FEV1占预计值的百分比(FEV1pred%)、FEV1/FVC。(3)6MWD。试验开始前2 h内避免剧烈活动,测量患者在平地尽全力快走6 min的距离,速度由受试者自己控制,中途可以放慢速度或停下休息。(4)mMRC评分。根据mMRC评分[8]判断呼吸困难的严重程度,评分0~4 分,分数越高,症状越重。(5)BODE 指数。汇总BMI、FEV1、6MWD、mMRC这4项内容评分[9],总分为0~10分,分数越高,患者情况越差。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析。计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验;2组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料组间比较采用χ2检验。相关性分析采用Pearson 相关。P<0.05 为差异有统计学意义。
2 结果
2.1 3 种不同营养状态组间基线指标比较 3 组年龄和FEV1/FVC差异无统计学意义(P>0.05)。与营养正常组比较,营养不良风险组BMI、6MWD和MNA评分降低,mMRC评分和BODE指数升高;营养不良组的女性比例、BMI、FEV1、FEV1pred%、6MWD 和MNA 评分降低,mMRC 评分和BODE 指数升高(P<0.05)。与营养不良风险组比较,营养不良组BMI、FEV1和MNA评分降低(P<0.05),见表1。
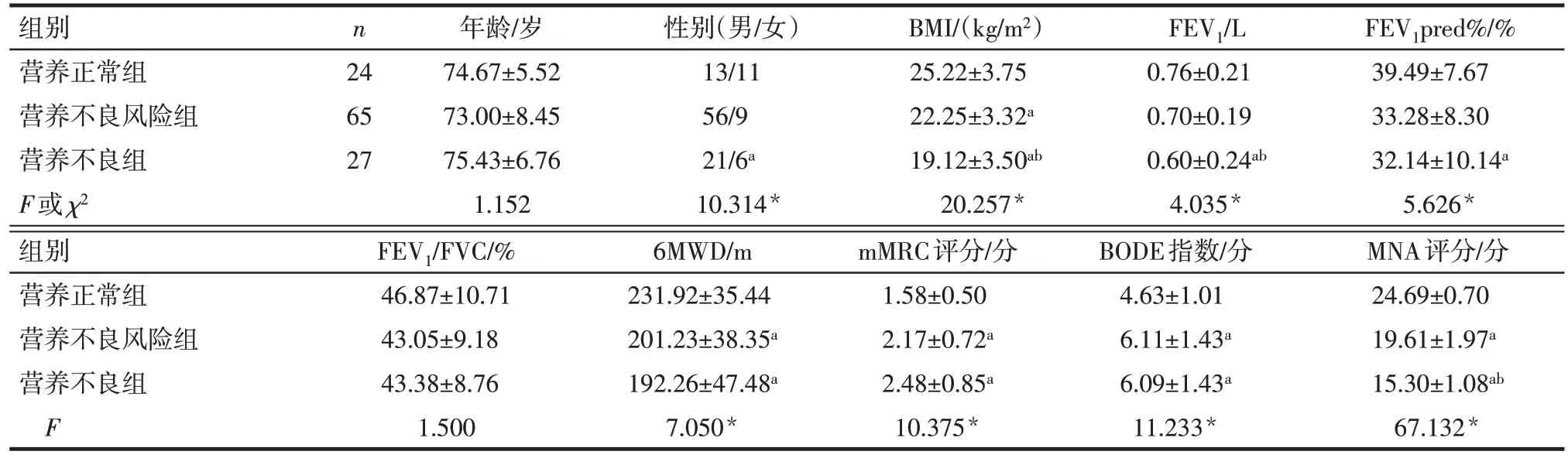
Tab.1 Comparison of indicators between three groups of different nutritional status表1 不同营养状态的3组间各指标的比较
2.2 试验组与对照组不同时点各指标比较 入院时,2 组各指标差异均无统计学意义(P>0.05)。与入院时相比,治疗3个月后对照组BMI、FEV1、6MWD和MNA 评分降低,FEV1/FVC 升高;试验组BMI、FEV1、FEV1pred%、6MWD 和MNA 评分升高,mMRC评分和BODE 指数降低(P<0.05)。治疗3 个月后,试验组6MWD和MNA评分高于对照组,mMRC评分和BODE指数低于对照组(P<0.05),见表2。
Tab.2 Comparison of indexes at different time points between the experimental group and the control group表2 试验组与对照组不同时点各指标的比较(n=46,)
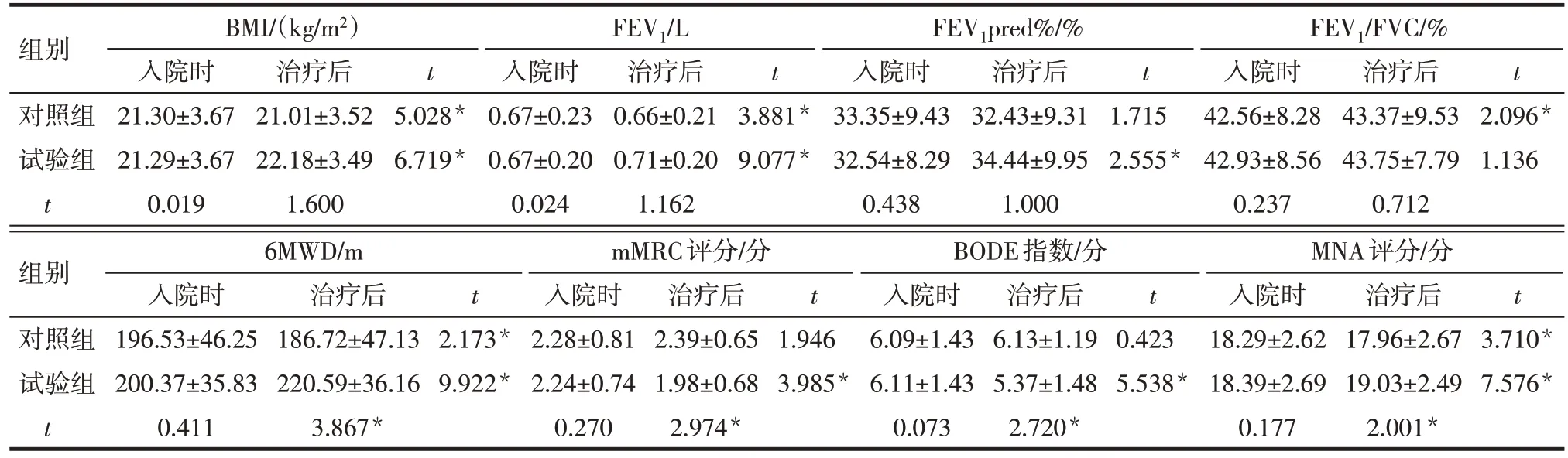
Tab.2 Comparison of indexes at different time points between the experimental group and the control group表2 试验组与对照组不同时点各指标的比较(n=46,)
*P<0.05。
组别对照组试验组t FEV1/L BMI/(kg/m2)入院时21.30±3.67 21.29±3.67 0.019治疗后21.01±3.52 22.18±3.49 1.600 t t t t 5.028*6.719*入院时0.67±0.23 0.67±0.20 0.024治疗后0.66±0.21 0.71±0.20 1.162 3.881*9.077*FEV1pred%/%入院时33.35±9.43 32.54±8.29 0.438治疗后32.43±9.31 34.44±9.95 1.000 1.715 2.555*FEV1/FVC/%入院时42.56±8.28 42.93±8.56 0.237治疗后43.37±9.53 43.75±7.79 0.712 2.096*1.136组别对照组试验组t 6MWD/m入院时196.53±46.25 200.37±35.83 0.411治疗后186.72±47.13 220.59±36.16 3.867*t t t t 2.173*9.922*mMRC评分/分入院时2.28±0.81 2.24±0.74 0.270治疗后2.39±0.65 1.98±0.68 2.974*1.946 3.985*BODE指数/分入院时6.09±1.43 6.11±1.43 0.073治疗后6.13±1.19 5.37±1.48 2.720*0.423 5.538*MNA评分/分入院时18.29±2.62 18.39±2.69 0.177治疗后17.96±2.67 19.03±2.49 2.001*3.710*7.576*
2.3 试验组不同亚组治疗前后各指标比较 入院时,B 组BMI、FEV1和MNA 评分低于A 组,BODE 指数高于A 组(P<0.05),FEV1pred%、FEV1/FVC、6MWD和mMRC评分与A组差异无统计学意义(P>0.05)。治疗3 个月后,A 组BMI、FEV1、6MWD 和MNA 评分升高,mMRC 评分和BODE 指数降低(P<0.05);B组BMI、FEV1、FEV1pred%、6MWD和MNA评分升高,BODE 指数降低(P<0.05);B 组BMI、FEV1和MNA 评分低于A 组,mMRC 评分和BODE 指数高于A 组(P<0.05),FEV1pred%、FEV1/FVC 和6MWD与A组差异无统计学意义(P>0.05),见表3。
Tab.3 Comparison of indexes before and after treatment between different subgroups of the experimental group表3 A和B组治疗前后各指标的比较()
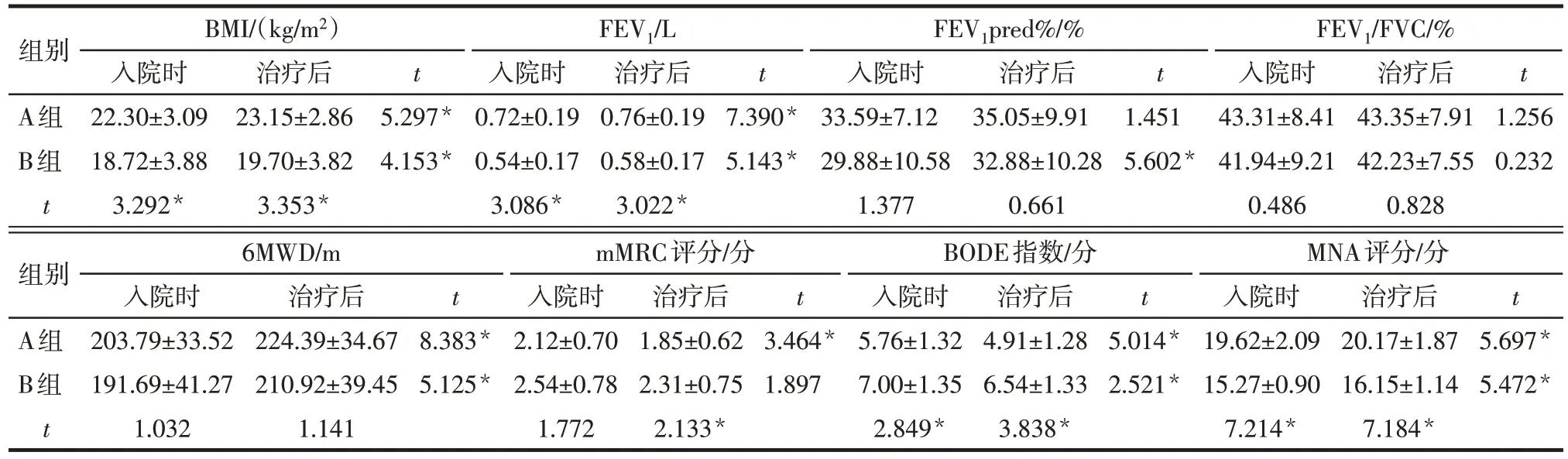
Tab.3 Comparison of indexes before and after treatment between different subgroups of the experimental group表3 A和B组治疗前后各指标的比较()
*P<0.05。A组、B组分别为33、13例。
组别A组B组t FEV1/L BMI/(kg/m2)入院时22.30±3.09 18.72±3.88 3.292*治疗后23.15±2.86 19.70±3.82 3.353*t t t t 5.297*4.153*入院时0.72±0.19 0.54±0.17 3.086*治疗后0.76±0.19 0.58±0.17 3.022*7.390*5.143*FEV1pred%/%入院时33.59±7.12 29.88±10.58 1.377治疗后35.05±9.91 32.88±10.28 0.661 1.451 5.602*FEV1/FVC/%入院时43.31±8.41 41.94±9.21 0.486治疗后43.35±7.91 42.23±7.55 0.828 1.256 0.232组别A组B组t 6MWD/m入院时203.79±33.52 191.69±41.27 1.032治疗后224.39±34.67 210.92±39.45 1.141 t t t t 8.383*5.125*mMRC评分/分入院时2.12±0.70 2.54±0.78 1.772治疗后1.85±0.62 2.31±0.75 2.133*3.464*1.897 BODE指数/分入院时5.76±1.32 7.00±1.35 2.849*治疗后4.91±1.28 6.54±1.33 3.838*5.014*2.521*MNA评分/分入院时19.62±2.09 15.27±0.90 7.214*治疗后20.17±1.87 16.15±1.14 7.184*5.697*5.472*
2.4 COPD 患者肺功能、BODE 指数与MNA 的相关性分析 COPD 患者入院时的MNA 评分与BMI、FEV1、FEV1pred%、FEV1/FVC、6MWD 均呈正相关(r分别为0.569、0.285、0.229、0.166、0.337,P<0.05),与mMRC 评分和BODE 指数均呈负相关(r分别为-0.425、-0.440,P<0.05)。
3 讨论
COPD 的特征是持续存在的气流受限和相应的呼吸道症状,通常与显著暴露于香烟烟雾等有害颗粒或有害气体相关,宿主因素(如基因、肺发育异常和加速老化等)亦会导致个体进展为COPD。研究表明,我国40 岁以上人群的COPD 患病率为13.7%[10],而60 岁以上人群COPD 患病率高达27.0%[11]。
COPD 住院患者合并营养不良的发生概率近三分之一[12],随着病情的发展,一旦出现呼吸衰竭,则营养不良进一步加重[3]。营养不良会影响COPD 患者的肺功能、生活质量、急性加重程度及预后,同时也是影响患者病死率的独立危险因素[13-14]。COPD患者合并营养不良还可进一步导致患者运动能力下降,且低体力活动患者具有较低的BMI、无脂肪质量指数、MNA评分、血清前白蛋白[14]。本研究纳入116例稳定期COPD患者中营养不良发生率为23.2%,营养不良风险发生率为56.0%。营养不良发生可能与以下因素相关:患者长期处于气道阻塞状态及机体高代谢状态,呼吸做功增加[16];长期的呼吸衰竭可损害患者的胃黏膜,导致胃肠菌群失调,消化吸收障碍[17];长期患病导致食欲下降,营养摄入减少。特别是本研究纳入人群为老年人,且肺功能为COPD 全球倡议分级3—4级,这类人群本身发生营养不良的概率就较高。
营养状况评估包括BMI、BODE 指数、MNA 评分、营养风险筛查方法(NRS2002)等一般客观测量。MNA 评分是一项简便的住院患者营养状态评价工具,主要适用于65岁以上老年人的营养风险筛查和营养状况评定,与传统的营养评估方法具有较好的相关性和一致性,能及早发现早期营养不良风险[18-19]。在对COPD患者评估工具中,BODE指数不仅是优于圣•乔治医院呼吸问题调查问卷(SGRQ)的死亡率最佳预测因子,还是与健康相关生活质量密切相关的指标[20]。MNA 评分和BODE 指数密切相关,可用于筛选COPD 患者的营养状况[21]。本研究结果显示,与营养正常组比较,营养不良风险组BMI、6MWD 和MNA 评分降低,mMRC 评分和BODE指数升高;营养不良组BMI、FEV1、FEV1pred%、6MWD 和MNA 评分降低,mMRC 评分和BODE 指数升高。与营养不良风险组比较,营养不良组BMI、FEV1和MNA评分降低,提示营养不良风险及营养不良COPD患者的疾病状态及生活质量均较营养正常者差;营养不良患者BMI 和肺功能较营养不良风险者差。有研究表明,饮食摄入和营养状况与COPD风险和发病以及肺功能下降相关[22]。本研究结果显示,MNA 评分与FEV1、FEV1pred%及FEV1/FVC 呈正相关,与BODE 指数呈负相关,与既往研究结果一致。另外,本研究中男性COPD 患者更易发生营养不良,这与Odencrants等[23]研究结果不同,可能与本研究排除标准较严格,入组女性比例较低有关。
营养支持分为肠内营养与肠外营养两种方式,两者各有优劣,多认为肠内营养比肠外营养具有获得方式简单、无创、患者易于接受等优势,但亦存在可能加重患者胃肠负担、吸收程度高度依赖患者胃肠功能等劣势。另有研究认为,肠内营养可有效提高COPD 患者前白蛋白、转铁蛋白、总蛋白、血红蛋白等水平,减少肺炎发生率[24]。与出现营养不良后行营养支持相比,早期肠内营养支持更能使患者获益,并可改善COPD 患者呼吸肌疲劳,缩短住院时间[25]。肠内营养粉作为目前常用的肠内营养剂,以整蛋白为氮源,营养成分全面,以淀粉和蔗糖为糖源,渗透压低,并且不含乳酸,因此胃肠道不良反应小,可有效改善患者营养状态。本研究结果显示,与入院时相比,治疗3个月后对照组BMI、FEV1、6MWD和MNA 评分降低,FEV1/FVC 和BODE 指数升高;试验组BMI、FEV1、FEV1pred%、6MWD 和MNA 评分升高,mMRC 评分和BODE 指数降低。治疗3 个月后,试验组6MWD和MNA评分高于对照组,mMRC评分和BODE指数低于对照组。提示若仅对营养不良风险或营养不良COPD 患者行常规治疗,其营养状态及生活质量会更差;在常规治疗的基础上补充肠内营养粉,可改善患者的营养状态及生活质量。对试验组亚组分析发现,治疗3 个月后,A、B 组在BMI、FEV1、6MWD、BODE指数和MNA评分方面均较治疗前有改善;另A 组对mMRC 评分有改善,而B 组对FEV1pred%有提高,表明针对不同程度营养不良的COPD 患者,采取不同剂量的营养支持基本能达到改善营养不良及肺功能的效果。
综上,对于老年稳定期COPD 患者,运用MNA评分工具对患者进行营养状态评估以指导肠内营养支持治疗有重要意义。根据营养不良程度的不同可予不同剂量的肠内营养粉加以补充,治疗3 个月可在一定程度上改善胃肠道功能正常患者的肺功能及BODE 指数,从而改善患者的生活质量。但肠内营养支持具体方案及远期效果尚待进一步研究验证。

