金丝桃苷对糖尿病足溃疡大鼠炎症反应、创面愈合及AMPK/SIRT1信号通路的影响
雷慧,鲍亚玲△,鲍喜静,马君
糖尿病足溃疡(DFU)与周围神经病变、血管疾病和足部感染有关[1]。糖尿病性溃疡肉芽组织中血管生成异常会导致营养供应减少,延缓创面愈合[2]。炎症是组织损伤和感染的保护性反应,机体识别病原体后,巨噬细胞会启动早期炎症反应,从而募集免疫细胞,包括中性粒细胞和单核细胞,以产生炎性细胞因子,如白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)等。炎症反应可加重2型糖尿病患者伤口愈合期间的组织损伤,这种损伤的主要病理机制涉及炎性因子的相互作用和活性氧的产生[3]。因此,长时间的炎症会导致伤口愈合延迟。金丝桃苷是一种类黄酮,具有抗炎、抗氧化、改善糖尿病肾病(DN)以及保护血管的作用[4]。研究表明,金丝桃苷能下调脓毒症模型大鼠心肌细胞中的炎性因子水平,改善大鼠心肌损伤[5]。同时,金丝桃苷也可抑制DN大鼠肾组织炎症反应,改善糖脂代谢,从而减轻肾组织病理损伤[6]。腺苷酸活化蛋白激酶(AMPK)/沉默信息调节因子1(SIRT1)信号通路参与能量代谢和炎症反应过程,在糖尿病中也有调控作用[7]。研究发现,激活AMPK/SIRT1 信号通路可抑制糖尿病心肌病小鼠的炎症和心肌细胞凋亡,从而减轻糖尿病心肌病症状[8]。由于金丝桃苷的抗炎活性,其对DFU也具有治疗作用。本研究拟探讨金丝桃苷对DFU模型大鼠创面愈合及AMPK/SIRT1 信号通路的影响,为DFU的治疗提供参考。
1 材料与方法
1.1 实验动物 SPF 级SD 大鼠(雌雄不限)60 只,7~8 周龄,体质量235~256 g,购自江苏瀚江生物科技有限公司,生产许可证号:SCXK(苏)2021-0004,大鼠均饲养于室温22~26 ℃,相对湿度60%~70%,12 h光暗交替的饲养房中。本研究经张家口学院伦理委员会批准(伦理号:伦理审核2022-078)。
1.2 主要药物、试剂及仪器 金丝桃苷(原料药,纯度≥99.5%)购自商丘美兰生物工程有限公司;二甲双胍片(0.25 g/片)购自深圳中联制药有限公司;高糖高脂饲料购自北京惠特比科技发展有限公司;链脲佐菌素(STZ)、IL-6、TNF-α 酶联免疫吸附试验(ELISA)试剂盒、HE 染色试剂盒、PCR 试剂盒、蛋白裂解液均购自昆山远慕生物科技有限公司;Trizol试剂、反转录试剂盒、BCA试剂盒、ECL发光液均购自西安淳风生物科技有限公司;兔源AMPK、SIRT1、GAPDH一抗,羊抗兔二抗(批号分别为BK19402、BK01295、BK01856、BK11042)均购自南京标科生物科技有限公司。小动物血糖仪(型号Biosen C)、酶标仪(型号K6600-A)、显微镜(型号SS-NEX)、荧光定量PCR 仪(型号CG-05)均购自上海奥陆生物科技有限公司;凝胶成像系统(型号FluorChem E)购自杭州九洋生物科技有限公司。
1.3 实验方法
1.3.1 DFU 建模及分组给药 大鼠适应性喂养1 周后构建DFU大鼠模型[9],方法如下:大鼠给予高糖高脂饲料(60%普通饲料、20%蔗糖、10%蛋黄粉、10%猪油)喂养4周后禁食不禁水12 h,一次性腹腔注射65 mg/kg STZ,继续以高糖高脂饲料喂养1周,检测大鼠空腹血糖(FBG),两次FBG>16.7 mmol/L视为糖尿病大鼠造模成功。随后腹腔注射3%戊巴比妥钠麻醉大鼠,消毒足背部,然后用印章在大鼠足背部标记一个7 mm×3 mm 的矩形,剪除矩形范围内皮肤并深至筋膜,以制备DFU大鼠模型。48只大鼠造模成功,按随机数字表法分为模型组,金丝桃苷低、高剂量组,二甲双胍组,每组12只。另取12 只大鼠作为对照组,以普通饲料(80%玉米、20%麦麸)喂养4周,然后一次性腹腔注射65 mg/kg生理盐水,接着以相同方法制备一个7 mm×3 mm的矩形创面。
建模完成后,金丝桃苷低、高剂量组分别给予100、200 mg/kg 金丝桃苷灌胃给药[10](将金丝桃苷和生理盐水混溶成质量浓度分别为10 g/L、20 g/L的混悬液,以10 mL/kg 灌胃);二甲双胍组给予200 mg/kg 二甲双胍灌胃给药[11](将二甲双胍片和生理盐水混溶成浓度为20 g/L 的混悬液,以10 mL/kg灌胃);对照组和模型组大鼠灌胃等体积生理盐水。各组给药每日1次,连续4周。
1.3.2 FBG 水平测定 分别于大鼠给药前后采集大鼠尾静脉血1 mL,采用血糖仪检测FBG水平。
1.3.3 血清TNF-α、IL-6水平测定 给药结束后,麻醉大鼠,腹主动脉取血3 mL,4 ℃、5 600 r/min离心12 min,取上清液,按照ELISA 试剂盒说明书操作方法检测大鼠血清TNF-α、IL-6水平。
1.3.4 创面愈合率的测定 分别于给药前和给药后对大鼠伤口拍照,使用Image J 软件测量伤口面积,计算创面愈合率,创面愈合率(%)=[1-(给药后伤口面积/给药前伤口面积)]×100%。
1.3.5 创面肉芽组织病理学观察 收集大鼠创面肉芽组织,分为两部分,一部分置于-80 ℃冰箱中保存;另一部分用4%多聚甲醛固定,石蜡包埋,切片(厚度4µm),HE染色,每张切片随机读取6个视野,显微镜下观察大鼠创面肉芽组织病理学变化。
1.3.6 创面肉芽组织中AMPK、SIRT1 mRNA 表达检测 取1.3.5中-80 ℃保存的大鼠创面肉芽组织,解冻,匀浆,Trizol试剂提取肉芽组织中的总RNA,反转录合成cDNA。荧光定量PCR(qPCR)法检测大鼠肉芽组织中AMPK、SIRT1 mRNA 表达水平,内参为GAPDH。引物由苏州拓维生物技术有限公司设计合成,引物序列见表1。参照PCR 试剂盒说明书配置反应体系及环境,AMPK、SIRT1 mRNA表达水平采用2-ΔΔCt法分析计算。样本重复3次。
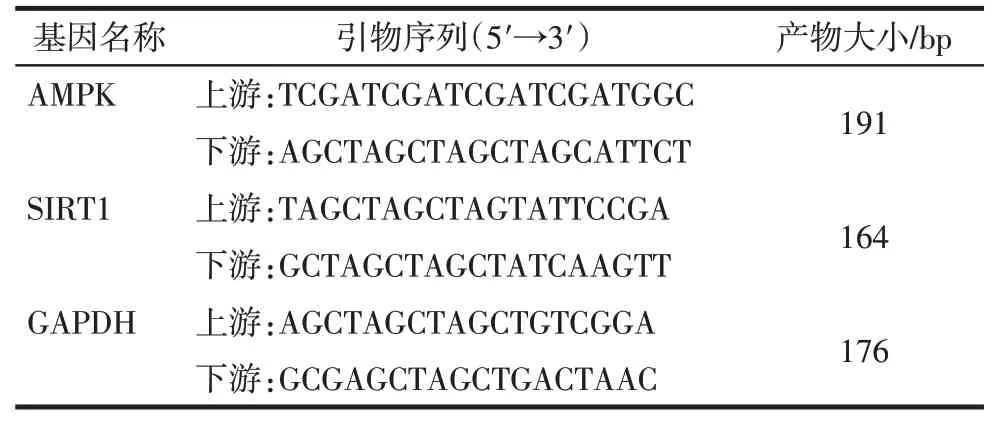
Tab.1 Primer sequence for qPCR表1 qPCR引物序列
1.3.7 创面肉芽组织中AMPK、SIRT1 蛋白表达水平的测定 取1.3.5中大鼠创面肉芽组织,解冻,匀浆,裂解缓冲液中裂解,BCA试剂盒定量总蛋白。电泳分离每个样品中等量的蛋白质(30 µg)后转膜,5%脱脂奶粉封闭1 h,加入兔源AMPK(1︰750)、SIRT1(1︰900)、GAPDH(1︰1 150)一抗,4 ℃下过夜;次日加入羊抗兔二抗(1︰2 100),室温下孵育1 h,ECL 试剂显影,Image J 软件分析条带灰度值。以GAPDH 为内参,计算AMPK、SIRT1蛋白表达水平。样本重复3次。
1.4 统计学方法 使用SPSS 24.0 软件进行数据分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠FBG水平比较 给药前,与对照组相比,模型组大鼠FBG水平升高(P<0.05),模型组,金丝桃苷低、高剂量组,二甲双胍组大鼠FBG水平差异无统计学意义(P>0.05)。给药后,与对照组相比,模型组大鼠FBG 水平升高(P<0.05);与模型组相比,金丝桃苷低、高剂量组大鼠FBG 水平依次降低(P<0.05);二甲双胍组和金丝桃苷高剂量组FBG水平差异无统计学意义(P>0.05)。见表2。
Tab.2 Comparison of FBG levels of rats between five groups表2 各组大鼠给药前后FBG水平比较(n=12,mmol/L,)
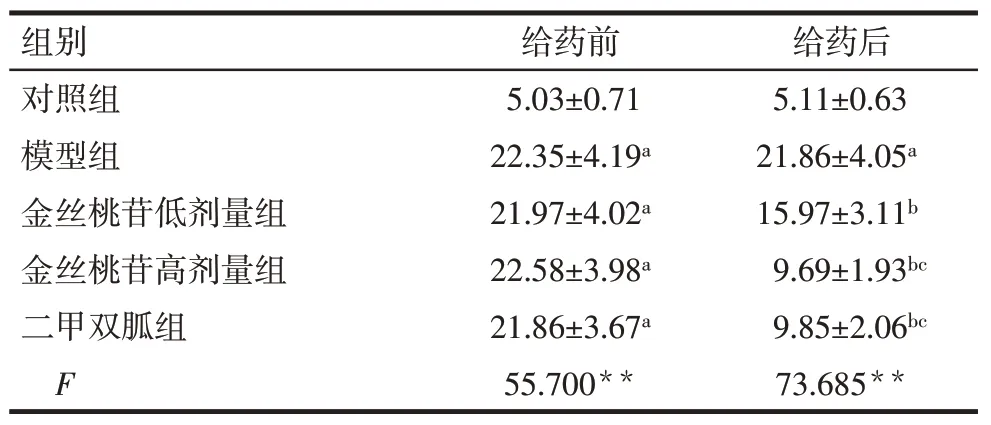
Tab.2 Comparison of FBG levels of rats between five groups表2 各组大鼠给药前后FBG水平比较(n=12,mmol/L,)
**P<0.01;a与对照组比较,b与模型组比较,c与金丝桃苷低剂量组比较,P<0.05;表3—5同。
组别对照组模型组金丝桃苷低剂量组金丝桃苷高剂量组二甲双胍组F给药前5.03±0.71 22.35±4.19a 21.97±4.02a 22.58±3.98a 21.86±3.67a 55.700**给药后5.11±0.63 21.86±4.05a 15.97±3.11b 9.69±1.93bc 9.85±2.06bc 73.685**
2.2 各组大鼠血清中TNF-α、IL-6水平比较 与对照组相比,模型组大鼠血清中TNF-α、IL-6 水平升高(P<0.05);与模型组相比,金丝桃苷低、高剂量组大鼠血清中TNF-α、IL-6 水平依次降低(P<0.05);二甲双胍组和金丝桃苷高剂量组TNF-α、IL-6 水平差异无统计学意义(P>0.05)。见表3。
Tab.3 Comparison of serum levels of TNF-α and IL-6 between five groups表3 各组大鼠血清中TNF-α、IL-6水平比较(n=12,ng/L,)
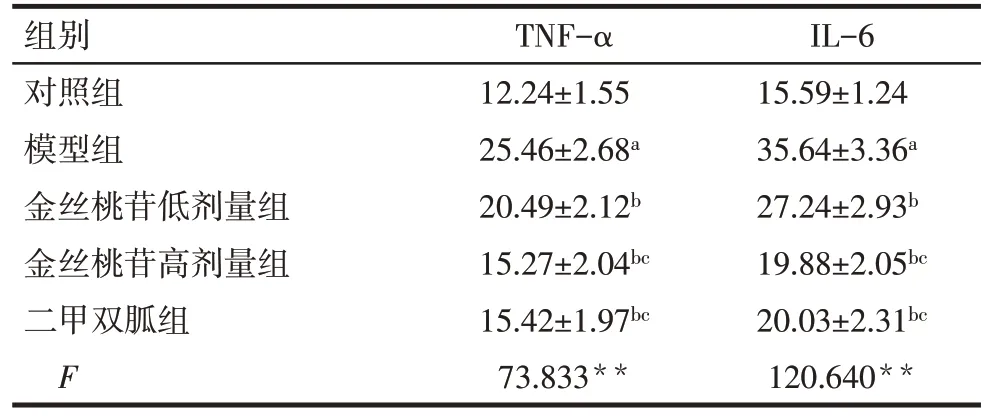
Tab.3 Comparison of serum levels of TNF-α and IL-6 between five groups表3 各组大鼠血清中TNF-α、IL-6水平比较(n=12,ng/L,)
组别对照组模型组金丝桃苷低剂量组金丝桃苷高剂量组二甲双胍组F TNF-α 12.24±1.55 25.46±2.68a 20.49±2.12b 15.27±2.04bc 15.42±1.97bc 73.833**IL-6 15.59±1.24 35.64±3.36a 27.24±2.93b 19.88±2.05bc 20.03±2.31bc 120.640**
2.3 各组大鼠创面愈合率比较 对照组、模型组、金丝桃苷低剂量组、金丝桃苷高剂量组、二甲双胍组大鼠创面愈合率分别为37.49%±3.57%、12.65%±2.01%、21.58%±2.47%、29.25%±2.90%、29.35%±3.04%,5组大鼠创面愈合率比较差异有统计学意义(F=130.081,P<0.01)。与对照组相比,模型组大鼠创面愈合率降低(P<0.05);与模型组相比,金丝桃苷低、高剂量组创面愈合率依次升高(P<0.05);二甲双胍组和金丝桃苷高剂量组创面愈合率差异无统计学意义(P>0.05)。见图1。
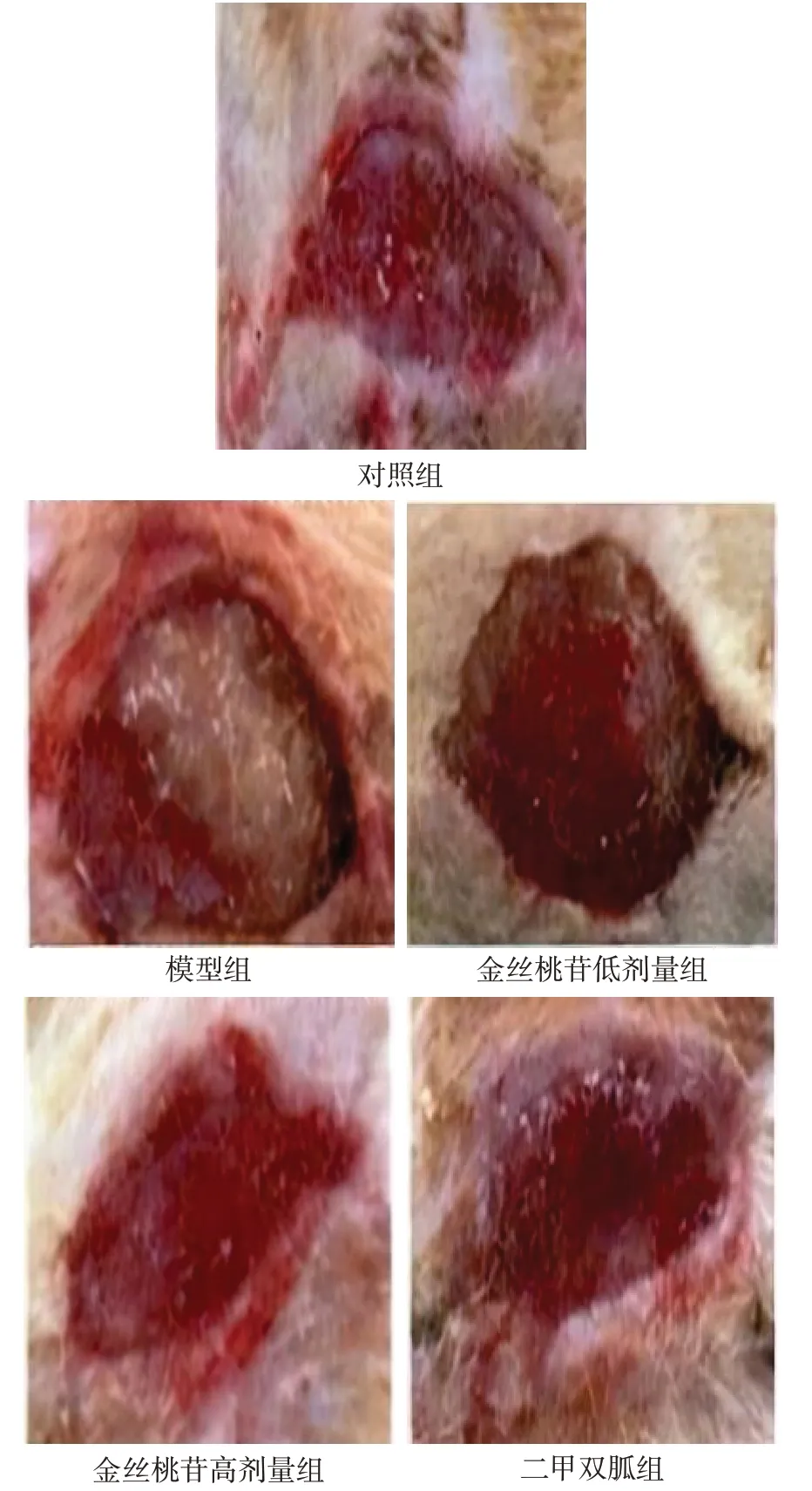
Fig.1 Wound healing of rats in each group after administration图1 各组大鼠给药后伤口愈合情况
2.4 各组大鼠创面肉芽组织病理学变化 对照组大鼠创面肉芽组织细胞结构完整,排列整齐,炎性细胞浸润少;模型组大鼠创面肉芽组织成纤维细胞及毛细血管坏死严重,伴随大量炎性细胞浸润;金丝桃苷低、高剂量组创面肉芽组织上述病理学变化程度依次减轻;二甲双胍组和金丝桃苷高剂量组创面肉芽组织病理学变化无明显差异。见图2。
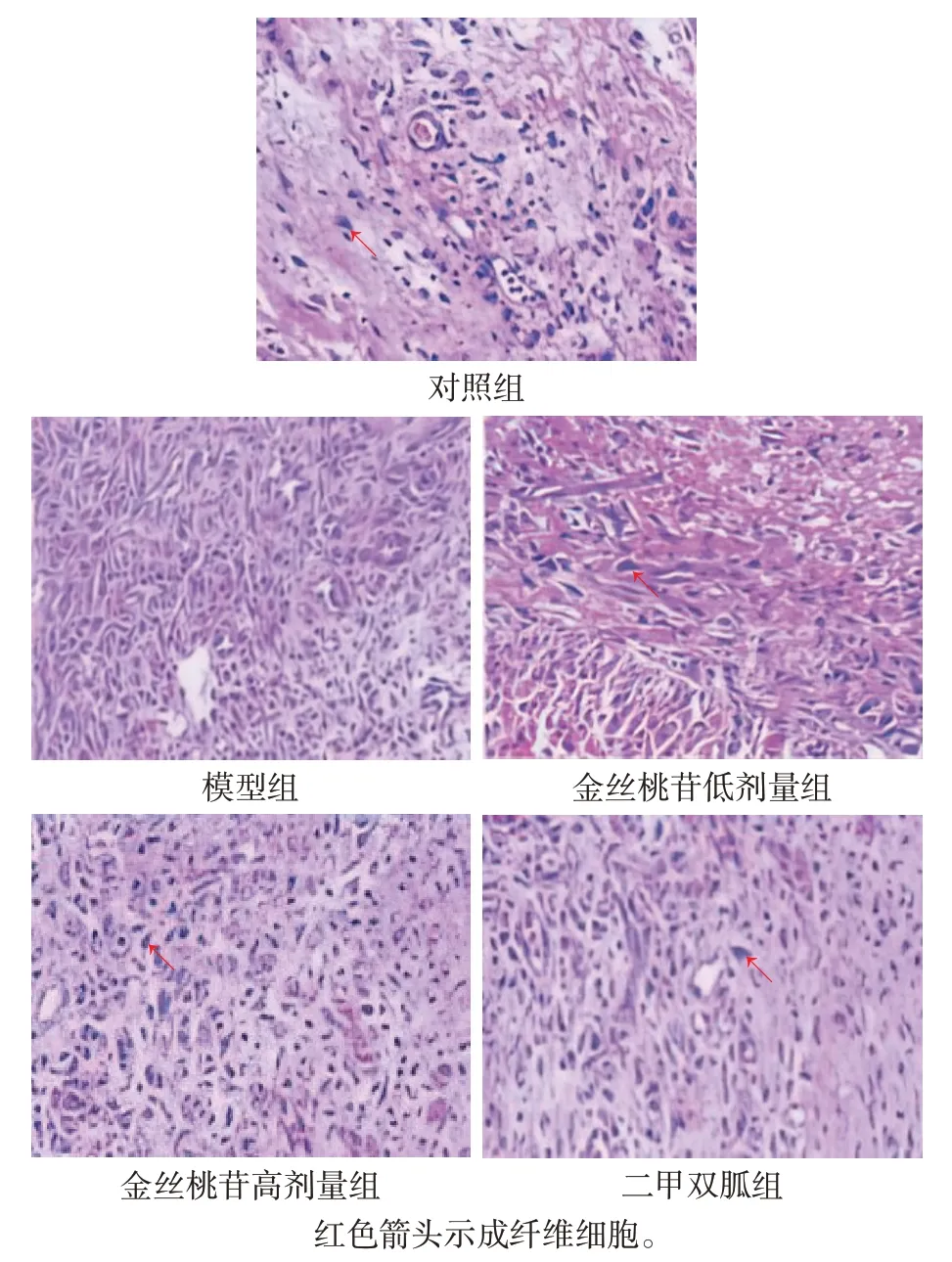
Fig.2 Histopathological changes of wound granulation tissue of rats in each group(HE staining,×400)图2 各组大鼠创面肉芽组织病理学变化情况(HE染色,×400)
2.5 各组大鼠创面肉芽组织中AMPK、SIRT1 mRNA表达水平比较 与对照组相比,模型组大鼠创面肉芽组织中AMPK、SIRT1 mRNA 表达水平降低(P<0.05);与模型组相比,金丝桃苷低、高剂量组大鼠创面肉芽组织中AMPK、SIRT1 mRNA表达水平依次升高(P<0.05);二甲双胍组和金丝桃苷高剂量组两因子表达水平差异无统计学意义(P>0.05)。见表4。
Tab.4 Comparison of mRNA expression levels of AMPK and SIRT1 in wound granulation tissue of rats between five groups表4 各组大鼠创面肉芽组织中AMPK、SIRT1 mRNA表达水平比较(n=12,)
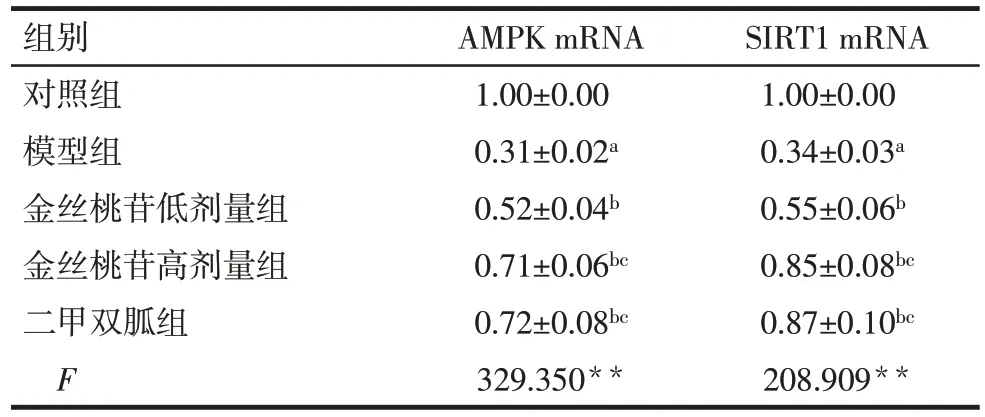
Tab.4 Comparison of mRNA expression levels of AMPK and SIRT1 in wound granulation tissue of rats between five groups表4 各组大鼠创面肉芽组织中AMPK、SIRT1 mRNA表达水平比较(n=12,)
组别对照组模型组金丝桃苷低剂量组金丝桃苷高剂量组二甲双胍组F AMPK mRNA 1.00±0.00 0.31±0.02a 0.52±0.04b 0.71±0.06bc 0.72±0.08bc 329.350**SIRT1 mRNA 1.00±0.00 0.34±0.03a 0.55±0.06b 0.85±0.08bc 0.87±0.10bc 208.909**
2.6 各组大鼠创面肉芽组织中AMPK、SIRT1 蛋白表达水平比较 与对照组相比,模型组大鼠创面肉芽组织中AMPK、SIRT1 蛋白表达水平降低(P<0.05);与模型组相比,金丝桃苷低、高剂量组创面肉芽组织中AMPK、SIRT1蛋白表达水平依次升高(P<0.05);二甲双胍组和金丝桃苷高剂量组创面肉芽组织中AMPK、SIRT1蛋白表达水平差异无统计学意义(P>0.05)。见图3、表5。
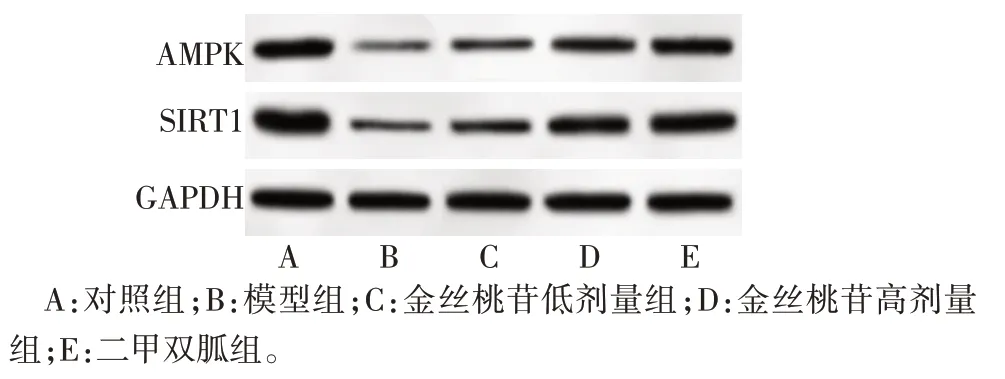
Fig.3 Western blot assay of AMPK and SIRT1 in wound granulation tissue of rats in each group图3 各组大鼠创面肉芽组织中AMPK、SIRT1蛋白免疫印迹图
Tab.5 Comparison of protein expression levels of AMPK and SIRT1 in wound granulation tissue of rats between five groups表5 各组大鼠创面肉芽组织中AMPK、SIRT1蛋白表达水平比较(n=12,)
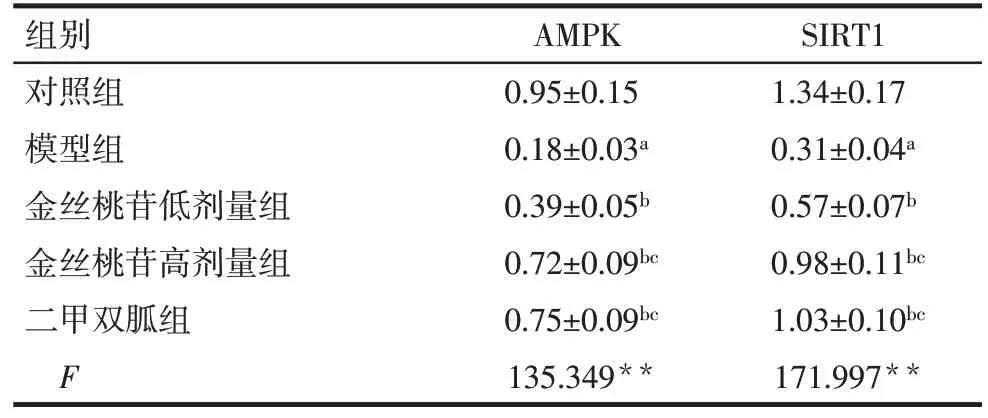
Tab.5 Comparison of protein expression levels of AMPK and SIRT1 in wound granulation tissue of rats between five groups表5 各组大鼠创面肉芽组织中AMPK、SIRT1蛋白表达水平比较(n=12,)
组别对照组模型组金丝桃苷低剂量组金丝桃苷高剂量组二甲双胍组F AMPK 0.95±0.15 0.18±0.03a 0.39±0.05b 0.72±0.09bc 0.75±0.09bc 135.349**SIRT1 1.34±0.17 0.31±0.04a 0.57±0.07b 0.98±0.11bc 1.03±0.10bc 171.997**
3 讨论
3.1 DFU 模型大鼠创面肉芽组织病变情况 DFU是糖尿病具有破坏性的并发症,也是中晚期糖尿病患者感染、溃疡或深部组织破坏的常见病因[12]。部分DFU 患者需要进行截肢手术,这极大地影响了患者的生活质量[13]。因此寻求DFU 的治疗药物意义重大。在DFU 创面愈合的早期阶段,炎症反应诱导中性粒细胞积聚,从而加速细菌和坏死组织的清除。在糖尿病患者中,伤口愈合的正常连续区域被破坏,伤口进入以持续发炎为特征的慢性非愈合状态。炎性细胞的大量繁殖会导致促炎细胞因子的持续产生,从而使组织基质金属蛋白酶表达失控,并明显限制肉芽组织的形成和成熟[14]。因此,如炎症得到有效抑制,将促进肉芽组织形成,有助于DFU 创面愈合。本研究发现DFU 模型大鼠创面肉芽组织成纤维细胞及毛细血管坏死严重,伴随大量炎性细胞浸润,FBG、血清中TNF-α、IL-6水平升高,创面愈合率降低。提示DFU 模型大鼠创面肉芽组织发生病变,愈合困难,同时伴随高血糖和炎症反应。
3.2 金丝桃苷可加快DFU 模型大鼠创面愈合 金丝桃苷具有抗炎、抗氧化及神经保护等药用价值[15]。朱妍妍等[16]研究表明,金丝桃苷能通过激活Kelch样环氧氯丙烷相关蛋白-1(Keap1)/核因子E2 相关因子2(Nrf2)/血红素加氧酶-1(HO-1)信号通路,减轻过氧化氢诱导的小鼠精母细胞氧化损伤。申玲君等[17]研究发现,金丝桃苷能通过下调miRNA-199a来抑制脂多糖诱导的人肺泡上皮细胞凋亡和炎症反应。本研究结果发现,金丝桃苷干预后的DFU 模型大鼠创面肉芽组织病变减轻,FBG、血清中TNF-α、IL-6 水平降低,创面愈合率升高。因此提示金丝桃苷能减轻DFU 模型大鼠血糖和炎症反应,加快创面愈合。
3.3 金丝桃苷可调控AMPK/SIRT1信号通路 AMPK/SIRT1 信号通路是与能量代谢密切相关的通路[18]。张蕴等[19]研究表明,N-乙酰半胱氨酸能激活AMPK/SIRT1 信号通路,缓解氧化应激和线粒体凋亡介导的脑血管内皮细胞损伤。同时,AMPK/SIRT1 信号通路在糖尿病中也起着调控作用。Li 等[20]研究发现,青蒿琥酯能通过激活AMPK/SIRT1信号通路,抑制糖尿病大鼠视网膜增厚,阻止视网膜屏障的形成。Xue 等[21]研究发现,罗汉果皂苷ⅢE 通过激活AMPK/SIRT1 信号通路缓解高糖诱导的足细胞炎症和氧化应激。本研究发现,DFU 大鼠创面肉芽组织中AMPK、SIRT1 mRNA和蛋白表达水平较正常大鼠降低,经金丝桃苷处理后,AMPK、SIRT1 mRNA和蛋白表达水平升高;且金丝桃苷剂量越高,效果越明显。结合上述研究结果,本研究认为金丝桃苷对DFU 大鼠创面愈合的改善情况可能与激活AMPK/SIRT1信号通路有关。
综上所述,金丝桃苷能减轻DFU 大鼠炎症反应,加快创面愈合,这一作用可能是通过激活AMPK/SIRT1信号通路来实现的。然而金丝桃苷能否通过其他通路加速DFU大鼠创面愈合还有待深入研究。

