亚氨基二琥珀酸四钾络合铁转化硫化氢体系的电化学行为
刘驰宇,许逸宁,马政生,王慧宁
(西北大学 化工学院,陕西 西安 710069)
硫化氢是一种有毒、有害的窒息性气体[1-2],已列入我国《危险化学品重大危险源辨识》[3]、《危险化学品目录》[4]、《重点监管的危险化学品名录》[5]等相关法规中,属于安全生产和环境保护中重点监测、控制和治理的高危险性废气之一[6]。在天然气开采、石油炼制、焦炉煤气生产、芳烃加氢、生物工程制药、城市生活垃圾处理等多个工业领域都存在硫化氢污染、致毒的危险,如何实现硫化氢的高效无害化处理是这些行业发展急需解决的问题[7-10]。
相比于一些传统的转化硫化氢的方法,高效络合铁法具有环境友好、催化剂可再生循环使用、工艺流程简单、技术及装备稳定、能实现撬装化等优点,可适用于各种工业气体中硫化氢的无害化处理[11-12]。依据使用的络合剂不同,络合铁法可分为三乙醇胺(TEA)法、磺基水杨酸盐法、酞菁钴法和乙二胺四乙酸(EDTA)法等。由于TEA 法操作成本较高、磺基水杨酸法再生时间长[13-17],这些方法在工业上已很少使用。目前应用较多的是EDTA 法,但由于EDTA 的水溶性较差,难以制备高浓度的络合铁溶液,使得转化硫化氢时的硫容量有限。
本工作选用绿色环保的亚氨基二琥珀酸四钾(IDSK4)[18-25]为络合剂、有机醇胺N,N-二甲基乙醇胺(MDEA)为pH 调节剂,与Fe3+构建了络合铁体系,利用电化学工作站通过测定循环伏安曲线优化了物料配比、pH 等工艺参数,并拟合出开路电位与Fe3+/Fe2+浓度比的关系曲线,在实际应用中可以通过测量开路电位来判断体系的状态继而指导生产。
1 实验部分
1.1 IDSK4-Fe3+络合物的制备
40%(w)的IDSK4溶液:工业品,河北协同环保科技股份有限公司;Fe(NO3)3·9H2O、Na₂S·9H₂O:化学纯,中国医药集团有限公司;MDEA:工业品,四川省精细化工研究设计院;浓硫酸:98%(w),西陇化工股份有限公司。
IDSK4-Fe3+络合物的制备(以较优条件为例):称取808 g 的Fe(NO3)3·9H2O,溶于一定量的水,定容至1 000 mL,得到2.0 mol/L 的Fe(NO3)3溶液。量取上述溶液25 mL(含0.05 mol 的Fe3+),搅拌下缓慢加入IDSK4溶液 300.75 g(0.3 mol),溶液由橘红色逐渐变为黏稠的棕红色,最后变为墨绿色沉淀,此时溶液的pH=6.0;继续快速搅拌,缓慢加入23.5 mL(0.2 mol)MDEA,体系的pH 约为10,溶液逐渐变为酒红色,最终沉淀消失,制得IDSK4-Fe3+络合物。
1.2 电化学检测装置
电化学实验装置如图1 所示。
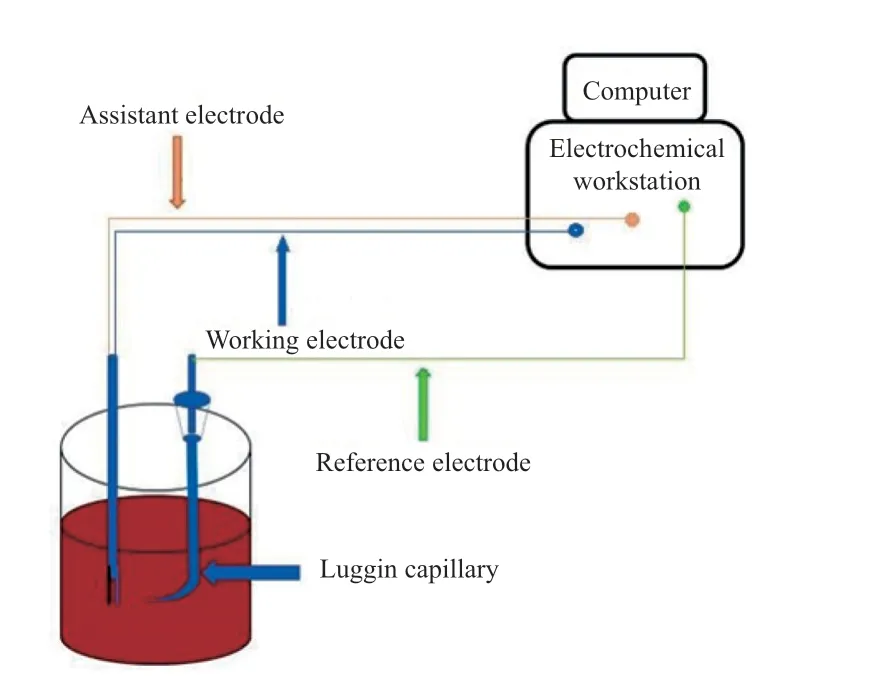
图1 电化学实验装置Fig.1 Diagram of electrochemical experimental device.
实验中所使用的电化学工作站可提供精确度较高的三电极系统,其中,绿色接线柱接参比电极、黄色接线柱接辅助电极、蓝色接线柱接工作电极。工作电极和辅助电极为铂片电极,参比电极为饱和甘汞电极。铂片电极表面均匀平滑,测定的电位区域较宽,且不与络合铁溶液发生化学反应。饱和甘汞电极具有良好的稳定性,可逆性好,温度系数小,实际使用温度可达 80 ℃。测量时,在电解池中加入配置好的IDSK4-Fe3+溶液,将电极插入到电解池内测定电位与电流,得到的电信号通过电化学工作站中的软件转变为图形信息,进而分析其中的变量因素。
1.3 利用循环伏安法测定IDSK4-Fe3+络合物的氧化还原性能
电化学测试法操作简单,可将难以测定的物化参数转化为易得的电化学数据。其中,循环伏安法是常用的电化学方法[26],主要用于定性、半定量的分析。该方法将激发电位施加在工作电极上,以恒定的扫描速率在初始电位和终止电位之间循环扫描。一组还原-氧化循环过程中,用三角波电压扫描得到的循环伏安曲线体现为一个完整的闭环曲线,通常上半部分为氧化波,下半部分为还原波。根据曲线中氧化峰和还原峰的对称性可判断活性物质的电化学可逆性能,同时在曲线中可读取峰的电位值和电流密度值。
本工作采用循环伏安法测定了IDSK4-Fe3+络合物的电位、电流值,从循环伏安曲线可判断体系的氧化、还原性能,进一步推断体系转化硫化氢的能力和再生性能。
1.4 IDSK4-Fe3+络合物转化硫化氢实验
IDSK4-Fe3+络合物吸收转化硫化氢采用的装置如图2 所示。所需的少量硫化氢气体由稀硫酸和硫化钠反应制得,并通过惰性气体氮气带入系统。反应一定时间后,从缓冲瓶取样,测量体系的开路电位(OCP)。反应结束后,关闭氮气系统,切换至压缩空气系统,利用空气中的氧气再生络合铁体系。
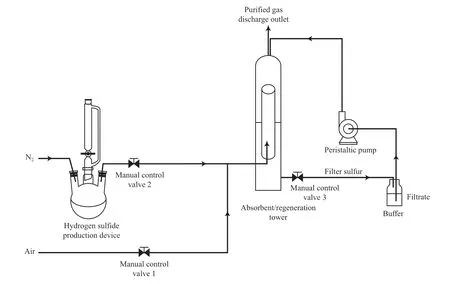
图2 IDSK4-Fe3+络合物转化硫化氢实验装置示意图Fig.2 Schematic diagram of experimental equipment for transforming hydrogen sulfide with IDSK4-Fe3+ complex.
2 结果与讨论
2.1 不同因素对IDSK4-Fe3+络合物电化学性能的影响
2.1.1 pH 的影响
碱性条件有利于IDSK4-Fe3+络合物的生成,且pH 影响络合物的稳定性,继而影响体系吸收、转化硫化氢的能力。考察pH 对IDSK4-Fe3+氧化还原反应的影响时,Fe3+,IDS4-,MDEA 的摩尔比为1∶3∶3,MDEA 采取滴加的方式,随MDEA的加入,pH 逐渐增大。定量的MDEA 加完后,需要继续提高体系的pH,则采用0.01 mol/L 的NaHCO3溶液进行微调(温度为室温,扫描速率为10 mV/s)。不同pH 下IDSK4-Fe3+络合物的循环伏安曲线如图3 和图4 所示。
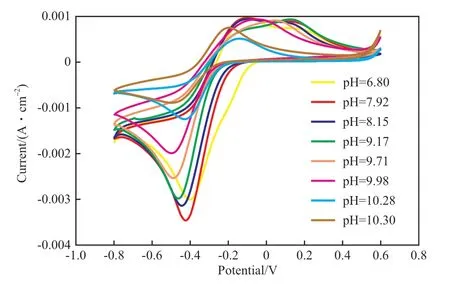
图3 不同pH 下IDSK4-Fe3+络合物的循环伏安曲线Fig.3 Cyclic voltammetry curves of IDSK4-Fe3+ complex at different pH.
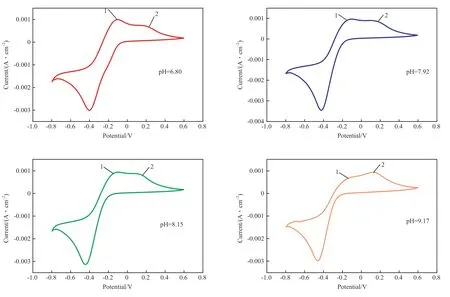
图4 出现副峰的伏安特性曲线Fig.4 Voltammetry curves with secondary peaks appear.
由图3 和图4 可知,闭环曲线下半部分的还原峰只有一个,归属于IDSK4-Fe3+还原成IDSK4-Fe2+。当pH 不大于9.71 时,闭环曲线的上半部分出现了两个氧化峰,表明体系在电流的作用下发生了两种氧化反应,根据体系的组成可判断为IDSK4-Fe2+氧化为IDSK4-Fe3+的主反应、游离的Fe2+氧化为Fe3+的副反应。
IDS4-与Fe3+和Fe2+络合物的稳定常数分别为15.2 和8.2,说明IDS4-与Fe3+的络合能力远大于与Fe2+的络合能力,因此Fe3+是以络合态的形式存在,还原峰只出现一个;当络合态三价铁还原成络合态二价铁时,会电离出少量Fe2+。氧化反应既有络合态二价铁氧化成络合态三价铁的反应,也有游离态Fe2+氧化成Fe3+的反应,产生的少量Fe3+与过量的IDSK4形成了络合物,如图5 所示。因此还原峰只有一个,氧化峰有两个。

图5 氧化-还原过程中体系的变化Fig.5 Transformation of system during oxidation-reduction process.
由图4 可见,随着pH 的增大,氧化峰1 的电流密度逐渐减小,当pH>9.71 后,氧化峰1 消失。因为随着pH 的增大IDSK4电离程度增加,IDS4-的有效浓度增加,体系中的Fe2+更多转化成了络合态的IDSK4-Fe2+,因而氧化峰1 消失,从而也说明氧化峰1 为副反应,氧化峰2 为主反应。进一步分析发现当pH>9.98 时,主反应氧化峰2 的电流密度逐渐减小,表明pH 在10 左右时,IDSK4-Fe2+氧化为IDSK4-Fe3+的反应容易发生,所需能量低。因此,用IDSK4制备转化硫化氢的络合铁体系时,应控制pH 为10 左右。
2.1.2 物料配比的影响
提高IDSK4与铁离子的摩尔比能够降低体系内游离铁离子的浓度,抑制副反应。由于络合反应为平衡反应,提高物料摩尔比对降低游离铁离子浓度的效果是有限的,而同时过量的IDSK4还会降低体系中络合物的浓度,导致体系的氧化还原能力变弱,因此对物料配比需要进行优化。在pH=10的条件下进行物料配比的优化实验。为了排除实验中加入MDEA 对体系氧化还原性能的影响,做了如图6 所示的空白对照实验,选用的扫描速率为10 mV/s。由图6 可见,MDEA 对IDSK4-Fe3+络合物的电化学影响极为有限,它的作用是高效地吸附硫化氢。

图6 MDEA 的循环伏安曲线Fig.6 Cyclic voltammetry curve of N,N-dimethylethanolamine(MDEA).
不同Fe3+/IDS4+摩尔比下IDSK4-Fe3+络合物的循环伏安曲线见图7 和图8。
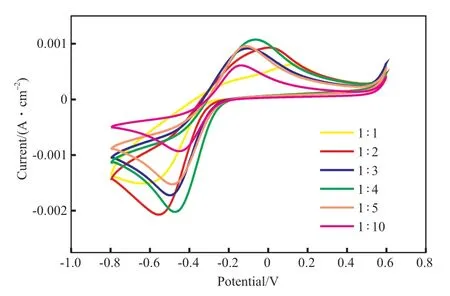
图7 不同Fe3+/IDS4+摩尔比下IDSK4-Fe3+络合物的循环伏安曲线Fig.7 Cyclic voltammetry curves of IDSK4-Fe3+ complex with different n(Fe3+)∶n(IDS4+).
由图7 和图8 可知,Fe3+/IDS4-摩尔比为1∶1和1∶2 时,循环伏安曲线的对称性差,且上半部分出现了两个氧化峰,表明该配比下再生过程会有副反应发生。随着Fe3+/IDS4-摩尔比的减小,循环伏安曲线的对称性增强,当Fe3+/IDS4-摩尔比为1∶4时,氧化峰表现出明显的单一氧化反应过程。还原峰中,除了Fe3+/IDS4-摩尔比为1:1 时的峰形差,其余峰表现出良好的还原反应过程。Fe3+/IDS4-摩尔比为1∶4,1∶5,1∶10时未出现明显的副反应峰,但这三组中氧化峰的电流密度绝对值在Fe3+/IDS4-摩尔比为1∶4 时最大,同样,还原峰的电流密度绝对值在Fe3+/IDS4-摩尔比为1∶4 时也最大。因此,Fe3+/IDS4-摩尔比为1∶4 时更有利于硫化氢的吸收及吸收液的再生。
2.1.3 小结
通过对不同pH 和物料配比的IDSK4-Fe3+络合物的循环伏安曲线进行测试和分析,发现IDSK4-Fe3+络合物具有化学可逆性,可进行循环利用。常温下,pH=10、Fe3+/IDS4-摩尔比为1∶4 时,IDSK4-Fe3+络合物的电化学性能最佳,且IDSK4-Fe3+/IDSK4-Fe2+电对的可逆性优异。
2.2 氧化还原电位法测定IDSK4-Fe3+络合物中Fe3+/Fe2+浓度比
溶液中的总铁含量可采用邻菲啰啉分光光度法测定,然而络合铁溶液中的铁离子浓度易受到络合剂的影响,导致Fe3+的测定值产生较大误差。刘杰[27]利用电化学中的氧化还原电位法测试铁离子浓度,该方法简便,同时误差较小。
OCP 的数值与溶液中的Fe3+/Fe2+浓度比及体系中的氧化性有关。Fe3+浓度随OCP 的增大而增大,溶液的氧化性也随之增强;Fe2+浓度随OCP的减小而增大,溶液的还原性增强。
根据能斯特方程,在IDSK4-Fe3+溶液中,当发生氧化还原反应时,OCP 的变化受Fe2+失电子得到Fe3+的影响,且OCP 与Fe3+/Fe2+浓度比存在线性关系,见式(1):
式中,OCP0为氧化还原电位的初始值,V;R为热力学常数,R=8.314 J/(mol·K);T为温度,K;Z为单个粒子带电数;F为法拉第常数,取值96 485 C/mol。
吸收温度为25 ℃时测量瞬时OCP 值,因为
式中,n为电极反应中的电子转移数,在本体系中n=1;Q为电荷量,C。取T=298 K,RT/ZF=2 477.8/Q。随着反应的进行,Fe3+逐渐转化为Fe2+,Fe3+/Fe2+浓度比逐渐减小,通过式(1)可计算出溶液中的Fe3+/Fe2+浓度比,以此分析吸收反应进行的程度。通过测定吸收前和吸收时Fe3+/IDS4-摩尔比为1∶4时IDSK4-Fe3+的OCP 值,即可绘制标准曲线,见图9。标准曲线的公式见式(3),在测量OCP 后,可通过式(3)计算Fe3+/Fe2+浓度比,结果见表1。

表1 不同时间下IDSK4-Fe3+转化硫化氢的OCP 及Fe3+/Fe2+浓度比Table 1 OCP and cFe3+/cFe2+ of hydrogen sulfide transformed by IDSK4-Fe3+ complex at different time

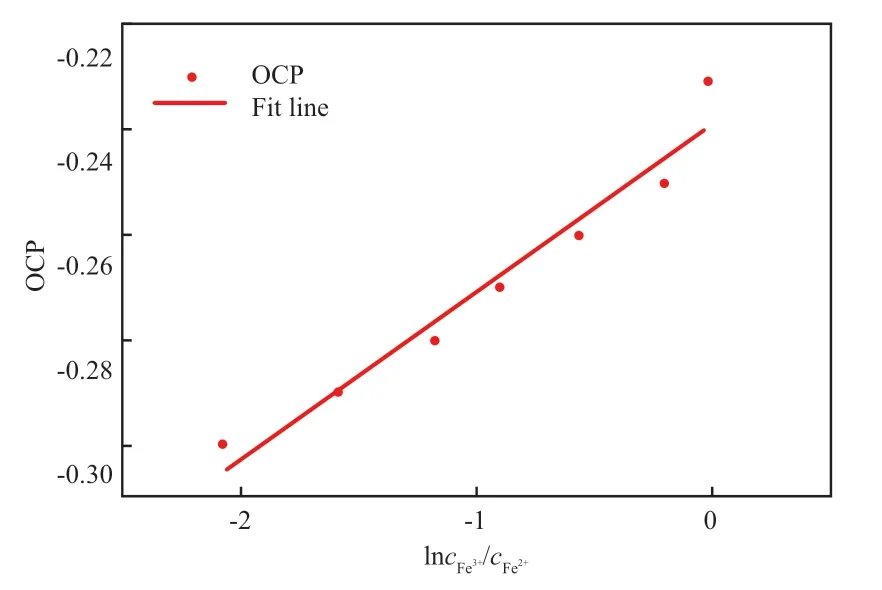
图9 OCP 与lncFe3+/cFe2+的标准曲线Fig.9 Standard curve of open circuit potential(OCP)to lncFe3+/cFe2+.
由式(3)计算可得,当OCP 大于-0.30 V 时,Fe3+/Fe2+浓度比大于0.14;OCP=-0.35 ~-0.30 V时,Fe3+/Fe2+浓度比在0.03 ~0.14 之间;当OCP低于-0.35 V 时,Fe3+/Fe2+浓度比小于0.03。在实验中,可以观察到当OCP 大于-0.30 V 时,体系正常使用,直至OCP 降至-0.30 V 以下,洗气瓶出口处有5×10-6(φ)左右的硫化氢泄露,此时停止通入硫化氢并鼓入空气,体系可以再生到吸收之前的状态;继续通入硫化氢,洗气瓶出口处泄露的硫化氢含量逐渐增大,当OCP 降至-0.35 V 以下时,出口泄露的硫化氢含量超过测量仪器上限(2 000×10-6(φ)),体系静置2 h 后分层,鼓入空气也不能恢复到吸收前的状态,说明体系已被击穿而失效。
3 结论
1)通过电化学循环伏安曲线寻找IDSK4-Fe3+络合物脱硫的最佳条件,分别做了Fe3+/IDS4-摩尔比为1∶1,1∶2,1∶3,1∶4,1∶5,1∶10 以及pH=6.8 ~10.3 的氧化还原曲线,最终得出在常温下,Fe3+/IDS4-摩尔比为1∶4、pH=10 为最佳吸收状态。
2)利用OCP 与Fe3+/Fe2+浓度比的标准曲线拟合的公式,在工业中可以通过OCP 来监测体系性能的变化以指导生产。当OCP 大于-0.30 V 时,即Fe3+/Fe2+浓度比大于0.14,吸收液正常使用;OCP=-0.35 ~-0.30 V 时,即Fe3+/Fe2+浓 度 比 在0.03 ~0.14 之间,需要补液或停止作业鼓入空气再生;当OCP 低于-0.35 V 时,Fe3+/Fe2+浓度比小于0.03,体系失效,需要更换新的体系。在实际应用中应极力避免OCP 小于-0.35 V。

