壳聚糖基氮化硼吸附剂的制备及其吸附脱硫性能研究
朱桂生,黄 燕,冯玉祥,黄春霞,丛 欣,张兆瑞
(1.江苏索普聚酯科技有限公司,江苏 镇江 212000;2.江苏大学 化学化工学院,江苏 镇江 212013;3.江苏索普化工股份有限公司,江苏 镇江 212006)
0 引 言
燃油中硫化物燃烧所产生的硫氧化物(SOx)会造成严重的大气污染,威胁人类的健康。加氢脱硫(HDS)是目前工艺最完善的脱硫技术,但是由于空间位阻和电子效应的影响,二苯并噻吩(DBT)等硫化物的加氢活性低,反应条件严苛,能耗氢耗高,脱硫成本骤增。因而,寻求更有效的脱硫方法对实现国家“节能减排”的战略目标具有重要的意义。
吸附脱硫(ADS)是一种在温和条件下实施的脱硫工艺,其操作简便、能耗低,且副反应少。目前已开发的吸附剂主要有活性炭、介孔二氧化硅、金属有机框架(MOF)等。其中,氮化硼(BN)因其良好的化学稳定性、耐高温、耐有机溶剂等优点,被认为是一种潜在的高性能吸附剂。BN 的氮源主要有三聚氰胺、叠氮钠、双缩脲等无机材料,但是这类无机氮源表现出的缺点限制了其进一步应用,如三聚氰胺对人体有害。壳聚糖是自然界中存在的氮含量较高的天然生物质多糖,其来源丰富,生物相容性好,可生物降解。
本文以硼酸为硼源、尿素和不同分子量的壳聚糖为双氮源,通过高温煅烧法制备得到一系列壳聚糖基氮化硼吸附剂(BN-CSx)。以DBT 为污染物模型,考察BN-CSx对DBT 的吸附性能,筛选出吸附容量最高的BN-CS20吸附剂,探讨吸附过程的动力学和热力学特性。
1 实验部分
1.1 试剂与仪器
硼酸(H3BO3;分析纯)、尿素(CH4N2O;分析纯)、P123(分析纯)、壳聚糖(分析纯)、甲醇(CH3OH;分析纯)、正辛烷(C8H11;分析纯)、十四烷(C14H30;质量分数为99%),以上原料均购自于国药集团化学试剂有限公司;二苯并噻吩(C12HN2O;质量分数为98%),Sigma-Aldrich 公司。
SK-G06123K-2-420 开启式真空/气氛管式电炉(天津市中环实验电炉有限公司);Nicolet Nexus 470 傅里叶变换红外光谱仪(美国Nicolet 公司);JSM-6010 扫描电子显微镜(日本JEOL 会社);Agilent 7890A 气相色谱仪(美国安捷伦科技有限公司);ASAP2020 比表面与孔隙度分析仪(美国Micromeritics 公司)。
1.2 吸附剂的制备
根据文献采用H2O2辅助微波降解法制备低分子量壳聚糖CSx(x=20 和40),其中x 表示微波降解时间。吸附剂的制备步骤如下:称取约0.5 g 模板剂P123 用25 mL 去离子水中于70 ℃油浴搅拌下完全溶解,依次加入0.62 g 硼酸、0.3 g 低分子量壳聚糖、14.41 g 尿素和25 mL 甲醇,继续加热搅拌至固体完全析出,将所得前驱体置于管式炉中,于900 ℃的N2氛围中煅烧2 h,得到壳聚糖基氮化硼吸附剂,记为BN-CSx(x=20 和40)。
为对比考察壳聚糖分子量对吸附性能的影响,以尿素和未经降解的大分子壳聚糖为双氮源,在同样的实验条件下制备得到氮化硼材料,记为BN-CS0。此外,为了探究以尿素为单氮源的条件下所制得的氮化硼材料的吸附性能,在不加壳聚糖的条件下采用同样的实验方法合成氮化硼材料,记作BN。
1.3 含二苯并噻吩模拟燃油的制备
使用内标法以正辛烷为溶剂配制含有DBT 的模拟燃油。将不同质量的DBT 分别溶解于正辛烷中,再加入一定量的正十四烷作为内标物,制得DBT 含量分别为100、200、300、400 和500 mg/L的模拟柴油。
1.4 吸附性能评价
准确称取0.050 0 g 吸附剂于50 mL 锥形瓶中,加入20.00 mL 含硫量为5×10-4的模拟燃油。在一定温度(298、308、318 K)下,置于恒温水浴振荡器中于130 r/min 下进行吸附实验。一定时间间隔,使用移液枪吸取上清液,离心后使用气相色谱仪(氢火焰离子检测器)检测剩余的硫含量。参数设置如下:气源:N2、H2和O2混合气;气体流速分别为:(H2)30、(O2)400、(N2)25 mL/min,并计算吸附剂的吸附容量。
吸附容量的计算公式为:
式中:qt为t min 后的吸附容量,mg/g;C0为初始硫浓度,mg/L;Ct为吸附t min 后硫的浓度,mg/L;Voil是加入的模拟燃油的体积,L;m 是加入的吸附剂的质量,g。
1.5 吸附动力学实验
测定不同时间间隔(10、20、30、60、120、180、240 min)内吸附剂对DBT 的吸附容量,分别采用准一级动力学模型、准二级动力学模型并对数据进行拟合,分析吸附过程符合的动力学模型。
所采用的动力学模型公式如下:
准一级动力学模型:
准二级动力学模型:
式中:k1为准一级动力学的平衡常数;k2为准二级动力学的平衡常数;qe为达吸附平衡时的吸附容量;qt为t 时刻的吸附容量。
1.6 吸附等温线实验
于298 K 温度下,分别测定不同硫浓度下(100、200、300、400 和500 mg/L)吸附剂的吸附容量,分别采用Langmuir 和Freundlich 吸附等温线模型对数据进行拟合,以进一步探究吸附剂与目标硫化物之间的相互作用。所采用的吸附等温线模型公式如下[15]:
Langmuir 吸附等温线模型:
Freundlich 吸附等温线模型:
式中:qm指理论的吸附容量最大值,mg/g;KL、KF分别为2 种模型对应的常数;n 代表吸附剂表面的不均匀程度。
1.7 吸附热力学实验
分别于298、308、318 K 温度下进行吸附实验,测定平衡吸附容量,对数据进行热力学拟合,探讨吸附过程的热力学特性。公式如下:
式中:Kc为反应的吸附平衡常数;ΔG 为吸附反应的吉布斯自由能变;ΔH 为反应的焓变,ΔS 为反应的熵变;R 为理想气体常数,取8.314 J K-1mol-1。
2 结果与讨论
2.1 吸附剂的结构表征
BN 和BN-CS20的X 射线衍射(XRD)图如图1所示。
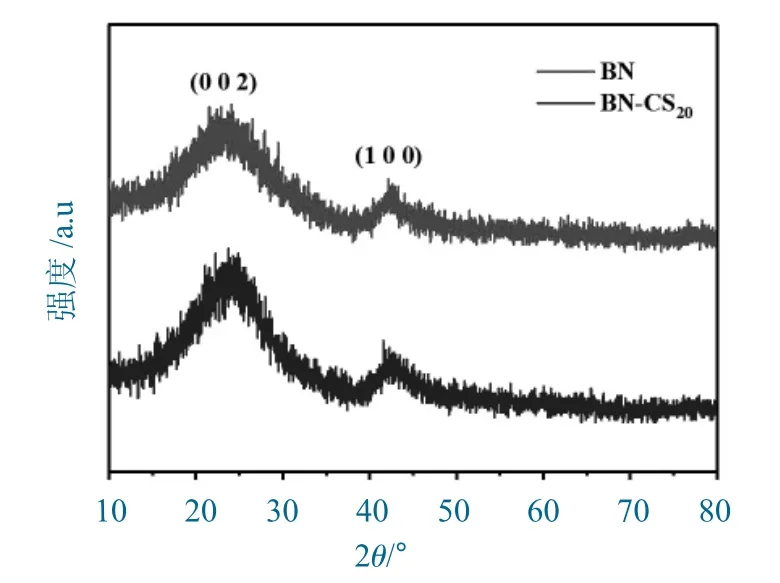
图1 BN和BN-CS20 的XRD谱图Fig.1 XRD patterns of BN and BN-CS20
与以尿素为单氮源制备而得的BN 的XRD 图对比可以发现,BN-CS20的XRD 谱图未有显著变化,位于23°和43°附近的衍射峰分别对应于氮化硼的(002)和(100)晶面,与文献一致,说明以尿素和壳聚糖为双氮源可成功构建氮化硼材料。
BN-CS20的N2吸附-脱附等温线和孔径分布图如图2 所示。
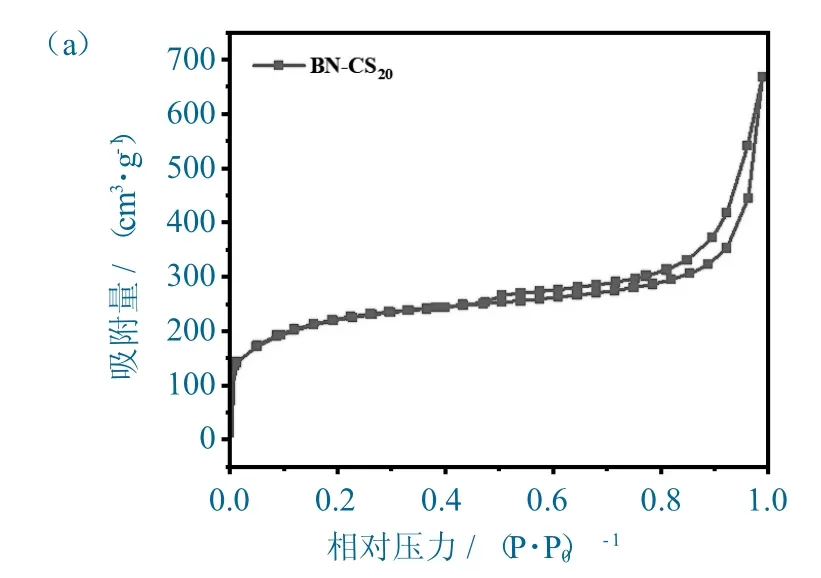
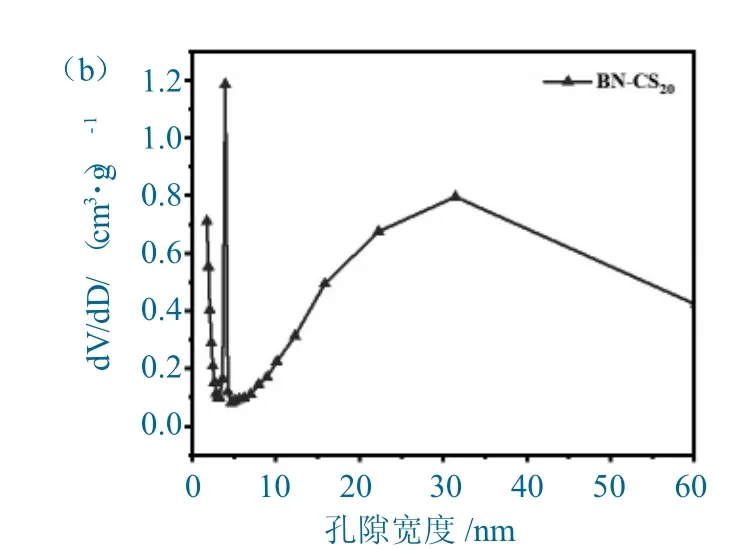
图2 BN-CS20 的(a)N2 吸附-脱附曲线和(b)孔径分布图Fig.2 N2 adsorption and desorption isotherms(a)and the corresponding pore size distribution curves(b)of BN-CS20
如图2(a)所示,BN-CS20的N2吸附-脱附等温线符合IUPAC 中定义的Ⅳ型曲线,且出现H3型回滞环,表明吸附剂含有介孔结构,孔型为锥形孔。根据孔径分布图(图2(b))可知,吸附剂的孔径主要在2~50 nm 范围内,属于介孔,其中4 nm 和31 nm 的孔居多,除此之外也存在少量的微孔。
BN-CS20的比表面积和孔径等参数见表1。

表1 BN-CS20 的比表面积和孔径等参数Table 1 The surface area,pore size and pore volume of BN-CS20
由表1 可知,BN-CS20 的比表面积为726.78 m2g-1,高于常见的碳微球吸附剂(约70 m2·g-1)。在吸附过程中,更大的比表面积有利于吸附位点的暴露及吸附质分子的扩散和传递,从而为吸附质的高效吸附去除提供有利条件。
以尿素为单一氮源所制备的BN 材料的SEM图像如图3 所示。

图3 (a) BN、(b-c) BN-CS20 和(d)吸附DBT 后BN-CS20 的SEM图Fig.3 SEMimages of(a)BN,(b-c)BN-CS20 and(d)BN-CS20 after DBT adsorption
由图3(a)可以看出BN 以单片层结构为主,由图3(b,c)可知,BN-CS20多为单片层堆积而成的多层片状结构。其形成过程可能为:在模板剂P123 的作用下,壳聚糖、硼酸、尿素以氢键的形式结合,高温煅烧后掺入碳,推测由于碳的掺入使BN 的层间作用力更强,因此形成了多层片状结构。图3d 为BN-CS20吸附DBT 后的SEM 图,与吸附DBT 前BN-CS20的SEM 图对比可知,吸附DBT 后的BN-CS20仍然保持多层的片状结构,形貌未有显著变化。
为了进一步证实BN-CS20对DBT 的有效吸附,通过SEM-mapping 对吸附DBT 后的BN-CS20进行元素分析。BN-CS20的Mapping 图如图4 所示。

图4 BN-CS20 的Mapping 图Fig.4 Mapping images of BN-CS20
利用红外光谱对相关材料的表面基团进行对比分析。
BN-CS20的红外谱图如图5 所示。
由图5a 的BN-CS20的FT-IR 谱图可得,位于1 386 cm-1处的红外特征峰归属于B-N-B 的面内伸缩振动,而800 cm-1处的吸收峰则对应于B-N-B的面外弯曲振动,3 420 cm-1处的红外吸附峰归属于-NH2的伸缩振动。当BN-CS20吸附DBT 后,在其红外谱图(图5c)的741 cm-1处出现一个新的特征峰,对比商品级DBT 的红外谱图(图5b)发现,该新的红外特征峰对应于DBT 五元环中C-S-C 键的伸缩振动,证明BN-CS20对DBT 的有效吸附。
吸附DBT 后的BN-CS20经甲醇溶剂洗脱后,其红外谱图(图5d)中未显示DBT 的特征吸收峰,说明甲醇可有效洗脱被BN-CS20吸附的DBT,有望实现吸附剂的再生。
2.2 吸附剂的筛选
对合成的BN、BN-CS0、BN-CS20和BN-CS40对DBT 的平衡吸附容量(qe)进行对比,以便筛选出吸附性能最优的吸附剂。
对DBT 的吸附容量对比如图6 所示。
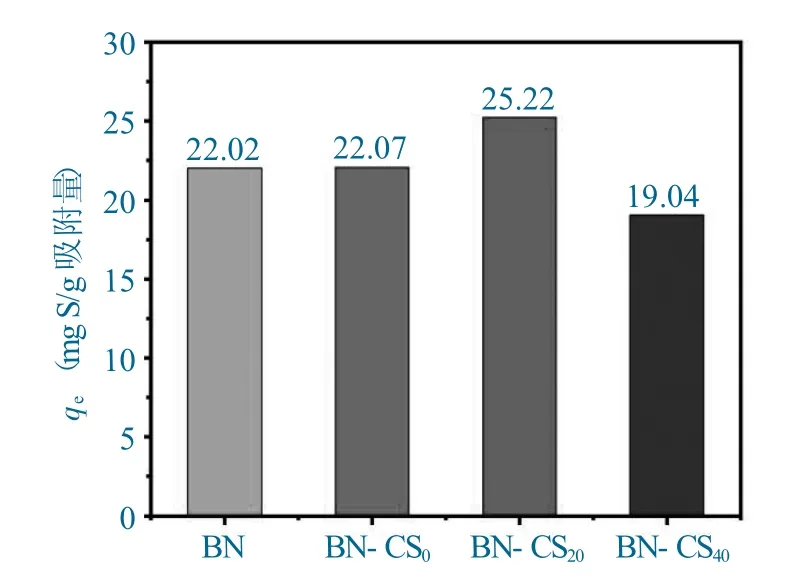
图6 对DBT 的吸附容量对比Fig.6 Comparison of adsorption capacity
由图6 可知,吸附剂的吸附性能与壳聚糖的分子量有关,以微波降解20 min 后所得的CS20为氮源,制备的BN-CS20对DBT 的吸附容量最高,且高于以尿素为单氮源制备的BN 吸附剂。
因此,后续将以BN-CS20为主要研究对象进行吸附实验。
2.3 吸附动力学分析
不同时间下BN-CS20对DBT 的吸附容量;BN-CS20吸附DBT 的(b)准一级和(c)准二级动力学模型拟合曲线如图7 所示。
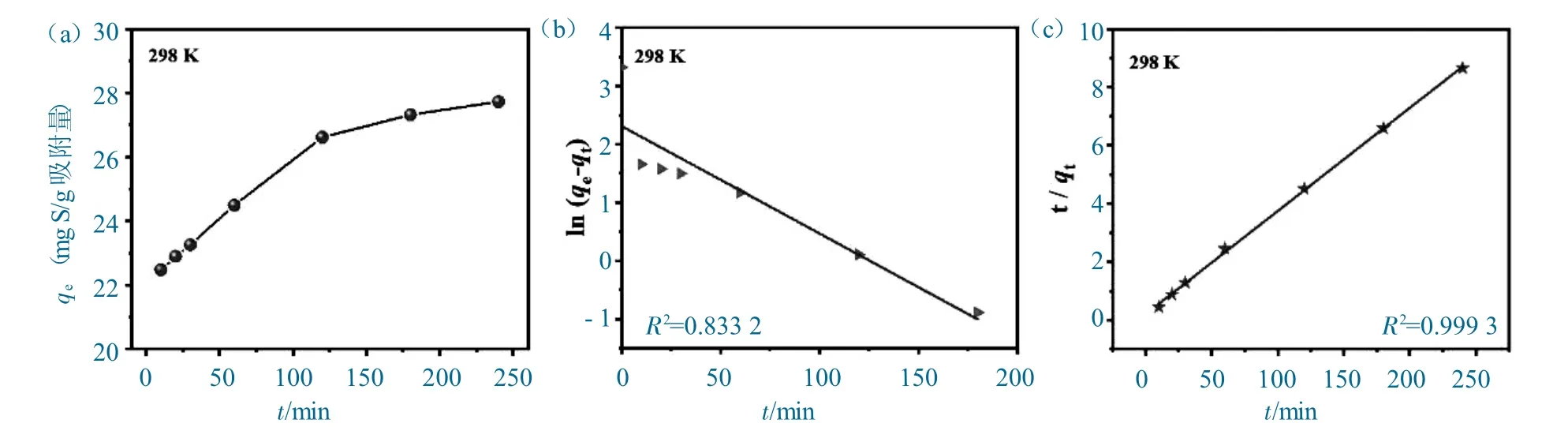
图7 (a) 不同时间下BN-CS20 对DBT 的吸附容量;BN-CS20 吸附DBT 的(b)准一级和(c)准二级动力学模型拟合曲线Fig.7 (a)Time dependence curve of DBT adsorption capacity.Kinetic fitting curves of(b)pseudo-first-order and(c)pseudo-second-order models
图7(a)为不同时间下BN-CS20对DBT 的吸附容量变化,可以看出在前120 min,BN-CS20对DBT 的吸附容量快速增大,随后减缓,最终在180 min 左右达到吸附平衡。这主要是由于在吸附初始阶段,燃油中的DBT 浓度高,且BN-CS20表面含有大量的未被占据的吸附位点,DBT 分子与吸附位点的接触几率大,因而吸附速率快。随着吸附的进行,未被占据的吸附位点逐渐饱和,吸附速率也逐渐降低,直至达到吸附平衡。
对所得动力学数据进行准一级(图7b)和准二级(图7c)动力学线性拟合,与准一级动力学拟合所得的相关系数(R2=0.833 2)相比,准二级动力学拟合的R2值为0.999 3,更接近于1,且准二级动力学模型计算所得的最大理论平衡吸附容量(qe,cal=28.20 mg g-1)与实验所得吸附容量(qe,exp=27.73 mg g-1)更接近,说明BN-CS20对DBT 的吸附过程更符合准二级动力学模型,以化学吸附为主。BN-CS20吸附DBT 的准一级和准二级动力学模型拟合,参数见表2。
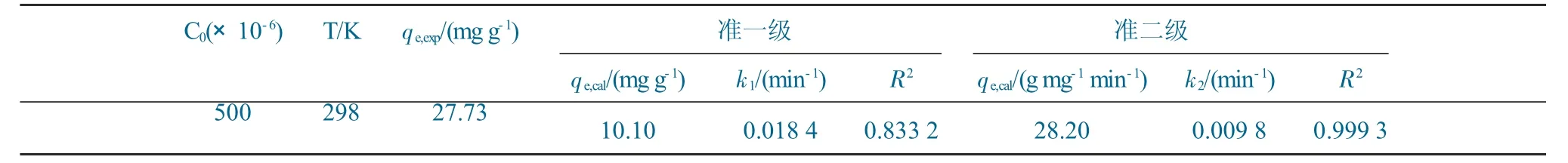
表2 BN-CS20 吸附DBT 的准一级和准二级动力学模型拟合参数Table 2 Pseudo-first-order and pseudo-second-order kinetic parameters for DBT adsorption on BN-CS20
2.4 吸附等温线分析
不同硫浓度下BN-CS20对DBT 的吸附容量(298 K)以及Langmuir 和Freundlich 等温线模型拟合结果如图8 所示。
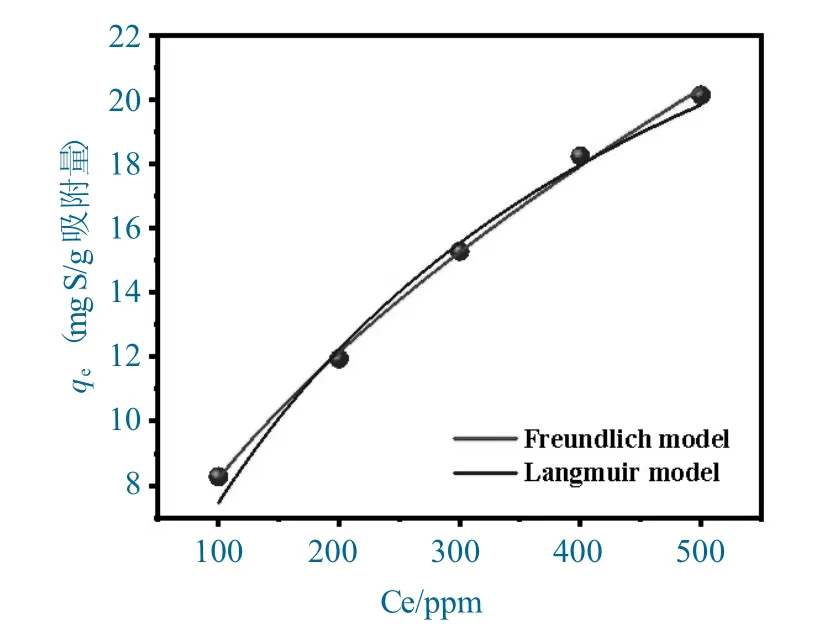
图8 BN-CS20 吸附DBT 的Langmuir 和Freundlich 等温线模型拟合曲线(T=298 K)Fig.8 Fitting curves of Langmuir and Freundlich adsorption isotherms of BN-CS20 adsorbing DBT
由图8 可得,BN-CS20对DBT 的吸附容量随浓度增大而显著增大,证实了浓度梯度对该吸附过程的驱动。
对上述数据分别进行Langmuir 和Freundlich 等温线模型拟合,拟合参数见表3。
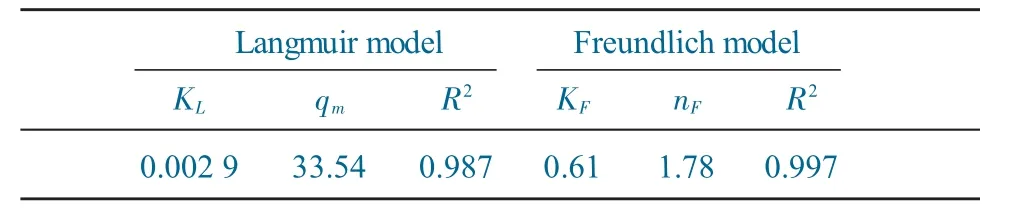
表3 BN-CS20 吸附DBT 的Langmuir 和Freundlich 等温线模型拟合参数Table 3 Langmuir and Freundlich isotherm parameters for DBT adsorption on BN-CS20
由表3 可得,与Langmuir 模型拟合的相关系数(R2=0.987)相比,BN-CS20吸附DBT 的Freundlich模型拟合所得R2值更大(R2=0.997),说明该吸附更符合Freundlich 等温线模型,表明BN-CS20对DBT 的吸附主要为多层吸附。
2.5 吸附热力学分析
进一步地,对BN-CS20吸附DBT 的吸附过程进行热力学分析,以便确定吸附的最佳温度以及优化吸附条件。298 K、308 K 和318 K 三个不同温度下BN-CS20对DBT 的平衡吸附容量如图9 所示。
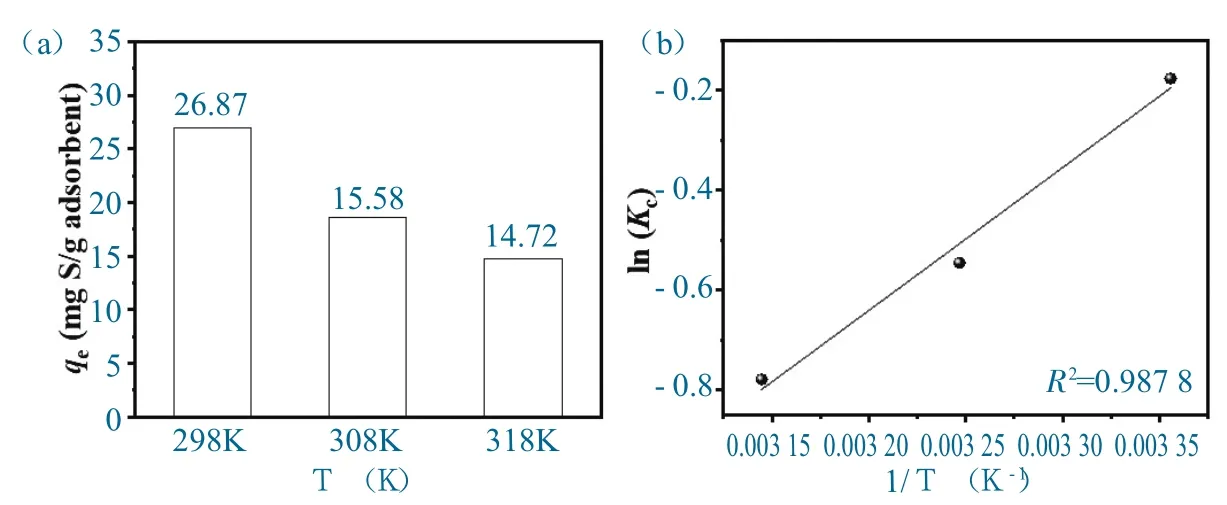
图9 (a) 不同温度下BN-CS20 对DBT 的吸附容量;(b) BN-CS20 吸附DBT 的热力学拟合曲线Fig.9 (a)Temperature dependence curve of DBT adsorption capacity.(b)Thermodynamic fitting curve of BN-CS20 adsorbing DBT
由图9 可知,随着温度的升高,BN-CS20 对DBT 的吸附容量逐渐降低,这表明该吸附过程是放热的,室温有利于吸附反应的进行。
对热力学数据进行拟合,结果如图9b 所示,并计算相关热力学参数,计算结果列于表3.3 中。由表中数据可知,ΔH<0,说明该吸附过程为放热反应,室温更有利于BN-CS20吸附DBT。室温下的吸附过程能耗更低,更有利于工业生产。
BN-CS20 吸附DBT 的热力学拟合参数见表4。

表4 BN-CS20 吸附DBT 的热力学拟合参数Table 4 Thermodynamic parameters for DBT adsorption on BN-CS20
3 结 语
(1)以硼酸为硼源、尿素和壳聚糖为双氮源,采用高温煅烧法成功合成了一系列壳聚糖基氮化硼吸附剂(BN-CS0、BN-CS20和BN-CS40)。通过SEM、Mapping、FT-IR、XRD、BET 等技术对吸附剂的结构进行表征,结果表明BN-CS20呈多层片状结构,且具有介孔结构和较大的比表面积。
(2)吸附性能考察结果证实,BN-CS20对DBT 的吸附性能最佳,吸附容量可达到25.22 mg S/g。吸附动力学、吸附等温线和吸附热力学模型拟合结果显示,BN-CS20对DBT 的吸附在180 min左右可达到平衡,该吸附过程更符合准二级动力学和Freundlich 等温线模型,且室温更有利于吸附的进行。

