老年慢性失眠患者认知功能与失眠严重程度和血清25-羟维生素D3 及肿瘤坏死因子α 水平的相关性研究
吴子幸,胡欣,*,陶诗萌,何友军,蔡传云,江伟,*
1.230031 安徽省合肥市,中国人民解放军联勤保障部队第九〇一医院全科医学科
2.230032 安徽省合肥市,安徽医科大学
慢性失眠主要表现为睡眠起始和维持困难,造成个体对睡眠时间或质量不满足的一种主观感受,同时伴随有日间功能损害,病程持续3 个月以上,是常见的公共卫生问题之一[1]。据统计,我国慢性失眠患病率为9.2%,其中,老年人群约占总体的60%[2]。慢性失眠是老年人群认知损害疾病的危险因素[3],目前关于慢性失眠引起认知障碍的机制研究有限,因此,老年人群的睡眠问题及认知损害常得不到恰当的诊治。
有研究发现,25-羟维生素D3[25-hydroxy vitamin D3,25(OH)D3]水平较低的人群,其睡眠持续时间较短、睡眠质量较差[4],研究还发现低水平的25(OH)D3与神经退行性疾病(如帕金森病和阿尔茨海默病)的认知损害相关[5-6]。此外,有研究表明肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)对睡眠-觉醒行为具有特异性效应[7],越来越多的研究也提示TNF-α 的升高与记忆、认知、嗜睡、情感障碍及行为受损有关[8-9]。以上研究表明25(OH)D3和TNF-α在调节睡眠及维持认知功能方面扮演着重要角色。本研究采用光电容积脉搏波描记法(photoplethysmography,PPG)和神经心理量表对老年慢性失眠患者客观睡眠质量及认知功能进行评估,同时检测血清25(OH)D3及TNF-α 水平,旨在进一步探讨老年慢性失眠患者不同失眠程度的认知功能情况及其生物学机制。
1 对象与方法
1.1 研究对象
选取2020 年6 月—2022 年6 月在中国人民解放军联勤保障部队第九〇一医院诊治的老年慢性失眠患者105例为研究对象,其中男48例,女57例;年龄65~80岁,平均年龄(72.6±4.8)岁。纳入标准:(1)符合《国际睡眠障碍分类》第三版[10]关于失眠症的诊断标准;(2)每周失眠>3 d,总病程≥1 年;(3)年龄≥65周岁;(4)匹兹堡睡眠质量指数量表(Pittsburgh Sleep Quality Index,PSQI)[11]评分>7 分。排除标准:(1)近2 周内使用过抗焦虑、抗抑郁及镇静催眠药物;(2)患有精神、心理障碍病史;(3)合并有严重的脑、心、肺、肝、肾等器质性疾病;(4)存在阅读、语言交流障碍等无法完成量表测验。本研究经中国人民解放军联勤保障部队第九〇一医院伦理委员会讨论通过(批准号:202003001),所有受试者知情同意。
1.2 研究方法
1.2.1 一般资料:收集研究对象人口学资料,包括性别、年龄、病程、受教育年限、疾病史、家族史等;入组前所有受试者进行PSQI、简版老年抑郁量表(Geriatric Depression Scale-15,GDS-15)[12]、广泛性焦虑障碍量表(Generalized Anxiety Disorder-7,GAD-7)[13]测试。
1.2.2 客观睡眠质量评估:采用PPG(Morpheus Ox,以色列Wide Med 公司生产)于22:00 至次日6:00 对受试者睡眠质量进行监测。检查当天不使用镇静催眠药,不饮酒、咖啡、浓茶等兴奋性饮料,PPG 数据由云端服务器经Morpheus Ox 软件进行自动分析,监测总睡眠时间、睡眠潜伏期、睡眠效率及觉醒次数4 项指标。
1.2.3 认知功能评估:完成夜间睡眠监测的次日上午,在安静无干扰的环境下,所有受试者行简易智能精神状态量表[14](Mini-mental State Examination,MMSE)及蒙特利尔认知评估量表[15](Montreal Cognitive Assessment,MoCA)测试,总分均为30 分,得分越低,则提示认知障碍越重。
1.2.4 血清25(OH)D3、TNF-α 水平的检测:完成PPG 监测的次日8:00 取受试者静脉血(采血前空腹,避免过度紧张和剧烈运动),静置30 min 后以3 000 r/min 离心5 min,离心半径为15 cm,提取血清,置于-80℃冰箱冷冻保存。采用酶联免疫吸附试验检测受试者血清25(OH)D3、TNF-α 水平。试剂盒购买自武汉基因美科技有限公司,遵循试剂盒说明书进行严格操作。
1.3 分组
将105 例老年慢性失眠患者根据PSQI 评分分为轻度(7~10 分)、中度(11~15 分)和重度(16~21 分)失眠组[16-18]。其中轻度失眠组32 例,中度失眠组38 例,重度失眠组35 例。
1.4 统计学方法
采用SPSS 25.0 软件进行统计学分析,符合正态分布的计量资料以(±s)表示,多组间比较采用方差分析,组间两两比较行LSD-t 检验;计数资料以相对数表示,组间比较采用χ2检验;使用Spearman 秩相关分析法进行相关性分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 三组患者一般资料和PSQI 评分比较
三组患者年龄、性别、病程、受教育年限、GDS-15 评分、GAD-7 评分比较,差异均无统计学意义(P>0.05)。三组PSQI 评分比较,差异有统计学意义(P<0.05),其中中度失眠组、重度失眠组PSQI 评分均高于轻度失眠组,重度失眠组PSQI 评分高于中度失眠组,差异有统计学意义(P<0.05),见表1。
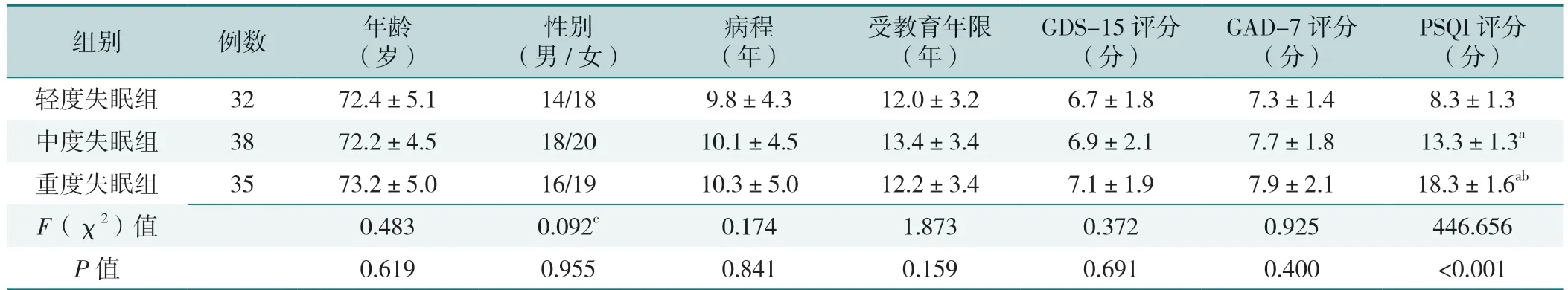
表1 三组患者一般资料和PSQI 评分比较Table 1 Comparison of general data and PSQI score in the three groups
2.2 三组患者PPG 睡眠监测指标比较
三组患者总睡眠时间、睡眠潜伏期、睡眠效率、觉醒次数比较,差异均有统计学意义(P<0.05)。其中重度失眠组睡眠潜伏期长于轻度失眠组和中度失眠组,觉醒次数高于轻度失眠组和中度失眠组,总睡眠时间低于轻度失眠组,睡眠效率低于轻度失眠组和中度失眠组,差异均有统计学意义(P<0.05);中度失眠组睡眠潜伏期高于轻度失眠组,睡眠效率低于轻度失眠组,差异均有统计学意义(P<0.05),见表2。
表2 三组患者PPG 睡眠监测指标比较(±s)Table 2 Comparison of sleep parameters recorded by PPG in the three groups
注:a 表示与轻度失眠组比较P<0.05,b 表示与中度失眠组比较P<0.05;PPG=光电容积脉搏波描记法。
组别例数总睡眠时间(min)睡眠潜伏期(min)睡眠效率(%)觉醒次数(次)轻度失眠组32375.16±62.4528.44±10.1871.25±16.539.34±3.31中度失眠组38354.27±78.3336.53±14.49a63.48±13.19a11.63±5.05重度失眠组35328.33±65.34a45.57±18.96ab54.37±10.25ab14.37±6.50ab F 值3.82610.82913.2207.968 P 值0.025<0.001<0.0010.001
2.3 三组患者认知功能比较
三组患者MMSE、MoCA 评分比较,差异均有统计学意义(P<0.05)。其中重度失眠组MMSE、MoCA 评分均低于轻度失眠和中度失眠组,中度失眠组MMSE、MoCA 评分均低于轻度失眠组,差异均有统计学意义(P<0.05),见表3。
表3 三组患者认知功能比较(±s,分)Table 3 Comparison of cognitive functions in the three groups
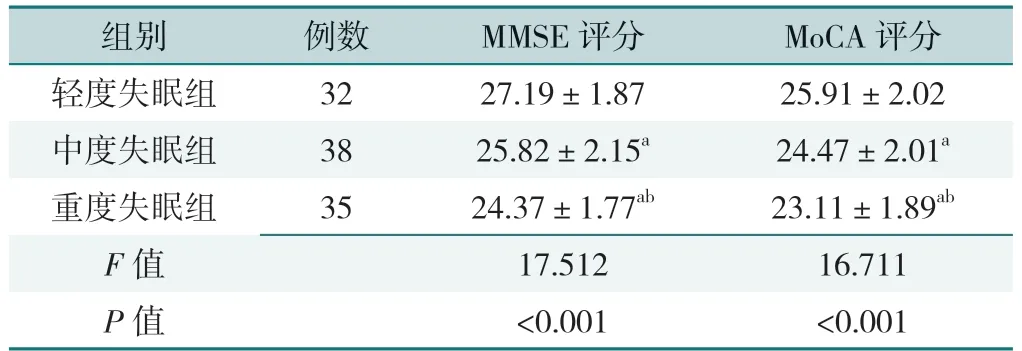
表3 三组患者认知功能比较(±s,分)Table 3 Comparison of cognitive functions in the three groups
注:a 表示与轻度失眠组比较P<0.05,b 表示与中度失眠组比较P<0.05;MMSE=简易智能精神状态量表,MoCA=蒙特利尔认知评估量表。
组别例数MMSE 评分MoCA 评分轻度失眠组3227.19±1.8725.91±2.02中度失眠组3825.82±2.15a24.47±2.01a重度失眠组3524.37±1.77ab23.11±1.89ab F 值17.51216.711 P 值<0.001<0.001
2.4 三组患者血清25(OH)D3 和TNF-α 水平比较
三组患者血清25(OH)D3和TNF-α 水平比较,差异均有统计学意义(P<0.05)。其中重度失眠组血清TNF-α 水平高于轻度失眠组和中度失眠组,25(OH)D3水平低于轻度失眠组和中度失眠组,差异均有统计学意义(P<0.05);中度失眠组血清TNF-α 水平高于轻度失眠组,25(OH)D3水平低于轻度失眠组,差异均有统计学意义(P<0.05),见表4。
表4 三组患者血清25(OH)D3 和TNF-α 水平的比较(±s)Table 4 Comparison of serum 25(OH)D3 and TNF-α levels among the three groups
注:a 表示与轻度失眠组比较P<0.05,b 表示与中度失眠组比较P<0.05;25(OH)D3=25-羟维生素D3,TNF-α=肿瘤坏死因子α。
组别例数25(OH)D3(ng/ml) TNF-α(pg/ml)轻度失眠组3253.29±16.76428.63±41.44中度失眠组3841.61±12.33a494.38±50.37a重度失眠组3532.09±10.46ab535.82±58.29ab F 值21.24237.752 P 值<0.001<0.001
2.5 老年慢性失眠患者认知功能与失眠严重程度、睡眠及血清学指标的相关性分析
Spearman 秩相关分析结果显示,MMSE、MoCA 评分与总睡眠时间、睡眠效率和25(OH)D3水平呈正相关(P<0.05),与失眠严重程度、睡眠潜伏期、觉醒次数和TNF-α 水平呈负相关(P<0.05),见表5。
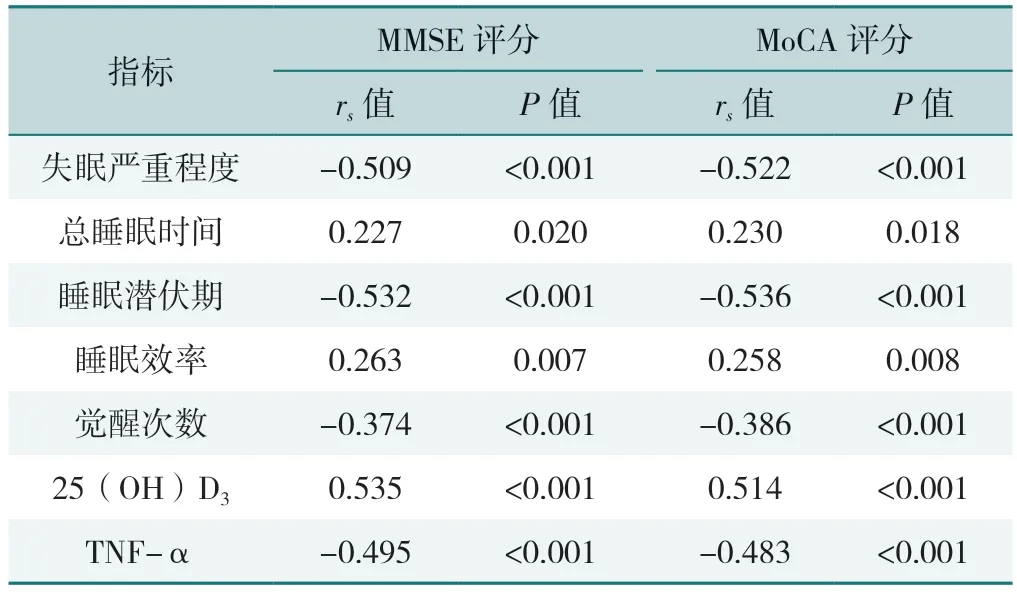
表5 老年慢性失眠患者认知功能与失眠严重程度、睡眠及血清学指标的相关性分析Table 5 Correlation analysis of cognitive functions with insomnia severity,sleep and serologic indexes in elderly patients with chronic insomnia
3 讨论
目前对于老年人群睡眠状况的评估多为量表评估,缺乏客观证据,多导睡眠监测虽为评价客观睡眠质量和结构的金标准,但操作复杂,患者配合度差,无法广泛应用。本研究采取PPG 监测,具有简易、无创且依从性好的优点,尤其适用于老年人群客观睡眠质量的监测。既往研究也表明,PPG 监测结果与多导睡眠监测结果一致[19]。本研究结果表明,老年慢性失眠患者认知功能下降与失眠严重程度增加、睡眠总时长缩短、睡眠潜伏期延长、睡眠效率下降和觉醒次数增多相关。当前关于认知损伤与失眠的相关研究较多,结果也不尽一致。一项纵向队列研究发现,睡眠总时间的延长可能会增加老年人群认知障碍的发生风险[20]。也有研究显示,睡眠时间长对老年人的执行功能及工作记忆产生不利影响[21]。国外一项针对50 岁以上人群的纵向队列研究发现,较长的睡眠时间和整体认知能力下降存在显著关联[22]。然而,有部分研究显示,睡眠时间过长或过短均会增加认知功能损伤的风险[23-24]。一项荟萃分析也表明,夜间睡眠不足或过多均会增加个体患认知障碍疾病的风险[25],提示良好的睡眠应该具有一个稳定的模式。有研究已证实,较长的入睡潜伏期可预测痴呆事件的发生[26]。一项关于老年人群的研究发现,睡眠质量差、睡眠潜伏期长和睡眠效率低均会增加个体认知障碍疾病的发生风险[27]。夜间觉醒次数增多可表现为片段化睡眠,致睡眠的连续性中断,破坏了睡眠的整体结构。国内一项动物实验提示,片段化睡眠导致老龄小鼠物体识别记忆和条件性恐惧记忆显著受损[28]。综上,失眠严重程度、睡眠潜伏期、睡眠效率、夜间觉醒次数及睡眠时长的改变均会对个体认知功能产生影响。
已有研究证实,神经炎症与大脑功能损伤密切相关,而TNF-α 是神经炎症过程中产生的主要细胞因子。国外一项动物实验发现,在大鼠蓝斑和下丘脑前部注射微量TNF-α 可延长非快速眼动睡眠期,提示TNF-α 可调节生物体的睡眠结构[29]。研究显示,TNF-α 在脑组织中呈现节律性表达的特点,且在深睡眠期时表达最高[30]。日间TNF-α 的低水平表达有利于维持觉醒状态,而夜间TNF-α 水平的升高有利于深睡眠,提示TNF-α 水平的昼夜节律性是调节睡眠的基础。本研究发现,老年慢性失眠患者8:00 左右的TNF-α 水平随失眠严重程度的增加而逐渐升高,推测慢性失眠的加重可能会导致患者体内TNF-α水平发生昼夜节律的紊乱。
本研究进一步相关分析显示,慢性失眠患者MMSE、MoCA 评分与TNF-α 水平呈负相关,提示老年慢性失眠患者认知功能损害与血清TNF-α 水平升高相关联。本课题组前期研究结果也发现,慢性失眠患者血清TNF-α 水平增加,且与患者空间工作记忆及物体再认记忆的损害相关[31]。研究证实,TNF-α 通过与TNF 受体结合,可以激活半胱氨酸-天冬氨酸蛋白酶凋亡通路,引起神经元快速凋亡,同时还参与了β-淀粉样蛋白的形成,与神经退行性疾病的认知损伤关系密切[32]。国外一项动物实验发现,提前6~18 h 向小鼠背侧海马中微量输注TNF-α,会损害小鼠情境恐惧记忆的检索及空间记忆的恢复和再巩固,提示TNF-α 对海马依赖性记忆的恢复和再巩固具有负调节作用[33]。另一项动物实验显示,脂多糖暴露的大鼠存在空间学习和记忆功能损害,同时在其大脑海马和皮层中检测出TNF-α 水平升高,在大鼠体内注射抗炎剂后,检测海马和皮层TNF-α 水平下降,受试小鼠学习及记忆能力明显改善[34]。已知海马区的记忆形成主要依赖长时程增强过程来实现,研究证实,TNF-α 可以增强α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体的表达,从而使得海马长时程增强过程中断、突触稳态失调,致短期识别及长期空间记忆的损伤,最终引起生物体认知障碍[35]。因此,TNF-α 水平的升高能引起大脑神经元的快速凋亡,同时参与了大脑内β-淀粉样蛋白形成,还可能通过阻断了长时程增强的过程,影响海马神经元间的突触连接,最终导致认知功能障碍。
维生素D 在肝脏中经过羟基化作用形成25-羟维生素D,其中25(OH)D3是维生素D 的最主要代谢形式。25(OH)D3可通过与维生素D 受体(vitamin D receptor,VDR)特异性结合而发挥其生理作用,VDR广泛分布于下丘脑、前额叶皮质、黑质、脑桥网状核、中脑中央灰质等区域,这些脑区在睡眠调节中发挥着主要作用[36]。研究显示,25(OH)D3与VDR 结合,可促进包括多巴胺、去甲肾上腺素、谷氨酸、γ-氨基丁酸、5-羟色胺等在内的多种神经递质的合成,同时可上调胶质细胞源性神经营养因子的表达,对中脑黑质的多巴胺能神经元的发育和分化具有重要作用,进一步影响认知功能及睡眠-觉醒周期[37]。本研究结果显示,老年慢性失眠患者血清25(OH)D3的水平随失眠严重程度的增加而逐渐降低。一项荟萃分析显示,维生素D 水平与睡眠障碍疾病的发病风险呈负相关,当维生素D<20 ng/mL 时,睡眠障碍发生风险显著增高[38]。国外一项干预研究显示,退伍军人补充维生素D(5 万U/周)可增加总睡眠时间[39]。另一项荟萃分析显示,补充维生素D(5 万U/2 周,连续8 周)有助于改善睡眠障碍患者的睡眠质量[40]。以上均提示维生素D 在生物体睡眠调节中发挥着重要作用。
本研究进一步的相关性分析结果表明,慢性失眠患者MMSE、MoCA 评分与25(OH)D3水平呈正相关,提示老年慢性失眠患者认知功能损害与血清25(OH)D3水平下降相关。所涉及的机制除影响神经营养因子的表达及多种神经递质的合成外,还可能与维生素D影响海马区神经元的发育相关。国外一项动物实验显示,25(OH)D3能提高小鼠神经钙黏蛋白表达,促进海马神经元细胞的轴突生长,对记忆的形成发挥作用[41]。同时,另一项动物实验显示,补充维生素D 可以调节小鼠老化过程中炎症因子的产生,特别是降低额叶及海马的TNF-α 水平,对小鼠衰老引起的空间记忆障碍有保护作用[42]。也有研究证实,维生素D 可以下调促炎因子的表达,降低TNF-α 的合成,因此维生素D 也被认为是一种免疫调节剂[43]。
综上所述,老年慢性失眠患者认知功能损害可能与失眠严重程度及血清25(OH)D3水平降低、TNF-α水平升高相关。补充适量维生素D 可能改善老年慢性失眠患者的睡眠质量,并通过多种途径改善认知功能。同时,维生素D 还可调节衰老过程中的免疫炎症反应,降低促炎因子TNF-α 水平,对老年慢性失眠患者认知功能损伤的预防和治疗具有潜在的临床价值。但本研究样本量尚较小,且因老年人群的特殊性未行多导睡眠监测,25(OH)D3与TNF-α 的改变与老年慢性失眠患者认知损害之间的关系仍缺少更多、更直接的证据;因老年人群依从性较差,为简化评估流程,未进行失眠严重指数量表的评估,未来仍需进一步加大样本量,优化试验方法,深入探究老年慢性失眠患者认知损害的机制。
作者贡献:吴子幸进行文章的构思与设计,撰写论文,负责英文的修订;陶诗萌、何友军负责数据收集;蔡传云负责统计学分析;胡欣和江伟负责研究命题的提出及设计,最终版本修订,对论文整体负责。
本文无利益冲突。

