水稻lncRNA SVR及邻近SAUR基因在种子低温萌发中的表达
刘金朝,浦 娜,陈 淳,陈伟雄,王 慧,肖武名
(1 华南农业大学 国家植物航天育种工程技术研究中心,广东 广州 510642;2 广州市农业科学研究院,广东 广州 510338)
非编码RNA(Non-coding RNA,ncRNA)一般指不翻译成蛋白质的RNA[1],包括长链RNA和短链小RNA。其中,短链非编码RNA(Small noncoding RNA,microRNA)和小干扰RNA(Small interfering RNA,siRNA)的功能研究较多且作用机制已经比较清楚[2];长链非编码RNA(Long noncoding RNA,lncRNA)是一类长度超过200 nt的非编码RNA,不具有编码蛋白质的功能,直接以RNA的形式发挥作用,可通过染色质重塑、组蛋白修饰、抑制RNA聚合酶II在表观遗传、转录、转录后、翻译和翻译后水平上调控基因的表达[3]。随着二代测序技术的发展,越来越多的lncRNA被发现,据文献报道,哺乳动物的基因组中有80%的转录产物是lncRNA[4]。对人类lncRNA的研究较深,比如肺癌、乳腺癌、卵巢癌、肾病、心血管疾病、自身免疫疾病等多种疾病的发生和发展与lncRNA的异常表达或突变相关[5]。目前,在不同的植物中也鉴定出大量的lncRNA,但只有很少部分lncRNA的功能在一定程度上被阐明,而对其所在的生化途径和调控水平仍是认知有限,亟待进一步研究。
根据lncRNA的基因组位置,可将其分为以下几类:从基因间区域转录出来的lncRNA,被称为基因间lncRNA;完全从蛋白质编码基因的内含子转录出来的lncRNA,被称为内含子RNA;正义lncRNA是从蛋白质编码基因的模板链转录而来,包含来自蛋白质编码基因的外显子,与部分蛋白质编码基因重叠或通过内含子覆盖蛋白质编码基因的整个序列;反义lncRNA是从蛋白质编码基因的反义链转录而来,与外显子或内含子区域重叠或通过内含子覆盖整个蛋白质编码序列[6]。lncRNA调控基因的作用可分为顺式和反式作用。对于顺式作用的lncRNA,Kopp等[7]猜想了3种潜在的机制,一是lncRNA位点可以局部调节基因表达;二是lncRNA转录本本身通过将调控因子募集到位点,或者调节该因子功能来调节邻近基因的表达;三是顺式调节仅取决于lncRNA启动子或基因位点的DNA元件,完全独立于其产生的lncRNA。lncRNA由不同的位置转录而来,可能具有不同的功能,这需要我们进一步探索,lncRNA对基因的调控是顺式还是反式作用一般基于lncRNA和基因的相对物理位置,对邻近基因的调控,一般称之为顺式调控,相反,则为反式调控。本文针对lncRNA与邻近基因的顺式作用进行初步研究。
目前,鉴定到的大部分植物lncRNA都与其个体发育有关。这些lncRNA在个体发育中通过不同的作用机制来影响基因的表达[8]。而植物在生长发育过程中,会受到逆境胁迫,在胁迫下,lncRNA的表达可能比编码蛋白质的mRNA更加活跃,这些lncRNA能够作用于蛋白质编码基因,共同调节植物对逆境胁迫的响应[9]。张楠等[10]发现拟南芥中lncRNAAtR8在萌发种子的根尖端特异表达,在盐胁迫下,lncRNAAtR8表达下调,在缺失后能够抑制种子的萌发,表明lncRNAAtR8能够参与拟南芥的盐胁迫响应过程。Wang等[11]在水稻中鉴定到lncRNALAIR,是由邻近基因LRK基因簇的反义链转录而来,lncRNALAIR过表达增加水稻籽粒产量并上调几种LRK基因的表达,lncRNALAIR结合水稻细胞中的组蛋白修饰蛋白OsMOF和OsWDR5,使这些蛋白富集在LRK1基因区域,从而影响LRK基因的表达。蔡晶晶[12]研究发现lncRNA 13853正调节拟南芥干旱胁迫耐受性,其可能是在转录层面调控植物干旱胁迫应答,lncRNA 13853的表达受到外源ABA和PEG的抑制。张晓佩[13]发现在陆地棉中lncRNA973受到盐胁迫诱导表达,而lncRNA354受到盐胁迫抑制表达,研究结果表明,lncRNA354在棉花中沉默后可能抑制了H2O2和O2-的积累,从而增强植株耐盐性,提高株高及根系干质量;与对照植株相比,沉默lncRNA973植株的耐盐性降低,lncRNA973邻近基因在VIGS植株中的表达量无明显变化,它可能通过反式作用调控基因表达来响应盐胁迫。Wang等[14]在冷处理葡萄中鉴定出2 088个新型lncRNA转录本,预测了4个差异表达的葡萄lncRNA以顺式调节关系靶向100个蛋白质编码基因。Cao等[15]研究发现棉花幼苗中具有防御冷胁迫的功能性lincRNAXH123,沉默lincRNAXH123后,植物表现出对冷胁迫的敏感性和叶绿体损伤以及活性氧的内源水平增加。Moison等[16]研究发现lncRNAAPOLO与转录因子WRKY42相互作用并调节其与靶基因RHD6启动子的结合。Pacheco等[17]研究发现lncRNAAPOLO能够结合并积极控制几种细胞壁伸展蛋白编码基因的表达,并鉴定到lncRNAAPOLO和WRKY42的共同靶基因EXT3。总之,这些被鉴定出来的lncRNA都能够通过调控相关基因来响应非生物胁迫。
华南农业大学国家植物航天育种工程技术研究中心在前期研究中对水稻野生型品种‘Francis’种子进行常温和低温萌发处理,通过全转录组测序鉴定到lncRNA MSTRG.182510.4响应低温胁迫,遂命名为lncRNA SVR(Seed vigor related lncRNA),其在种子中表达量较高[18],通过对其上下游100 kb附近的基因进行相关性分析,发现在lncRNA SVR上游2 kb左右存在1个SAUR基因簇,包含Os09g0545300、Os09g0545400、Os09g0545700、Os09g0547033、Os09g0546100、Os09g0546200、Os09g0546700、Os09g0546900、Os09g0547000、Os09g0547100共10个SAUR家族基因,这些基因可能是lncRNA SVR的顺式作用靶基因。因此,本研究将进一步揭示lncRNA SVR在低温下与这些可能的顺式作用基因的转录调控关系,为下一步研究lncRNA SVR通过顺式作用调控靶基因响应逆境胁迫的机制奠定基础。
1 材料与方法
1.1 种子常温和低温萌发处理
试验使用的野生型材料为耐寒粳稻品种‘Francis’,转基因材料为2个敲除株系crlnc-5、crlnc-11。在每个培养皿(直径9 cm)中放入饱满、完好无损的干种子50粒,加入10 mL蒸馏水。常温处理放置在(25±1) ℃恒温培养箱中黑暗处理,在0、1、3、5、7 d取样(常温下9、11 d已长成明显的幼苗,故不再取样),每次取6粒种子;低温处理放置在(15±1) ℃恒温培养箱中黑暗处理,在0、1、3、5、7、9、11 d取样,每次取6粒种子。取样后的种子用锡纸包好,迅速放置液氮中,然后移入-80 ℃条件下保存备用。常温和低温每个时间点均开展3次生物学重复。
1.2 基因表达分析
采用qRT-PCR技术对lncRNA SVR和邻近的SAUR基因簇进行表达分析。将种子放在研钵中,加入液氮研磨至粉末状,使用美基生物科技有限公司的植物RNA快提试剂盒(货号:R4014-02)提取水稻种子总RNA,使用艾科瑞公司Evo M-MLV反转录预混型试剂盒(AG11728)进行mRNA的反转录,使用诺唯赞公司荧光定量试剂盒(Q111-02)进行qRT-PCR,反应体系为20 μL,其中2×AceQ qPCR SYBR Green Master Mix 10 μL、正反向引物各0.5 μL、50× ROX Reference Dye1 0.4 μL、模板cDNA 2.0 μL、ddH2O 6.6 μL。以OsActin(Os03g0718100)为内参,使用荧光定量PCR仪(ABI StepOne)进行基因表达量检测,每个基因进行3次生物学重复。本研究用于基因表达分析的引物信息如表1所示。
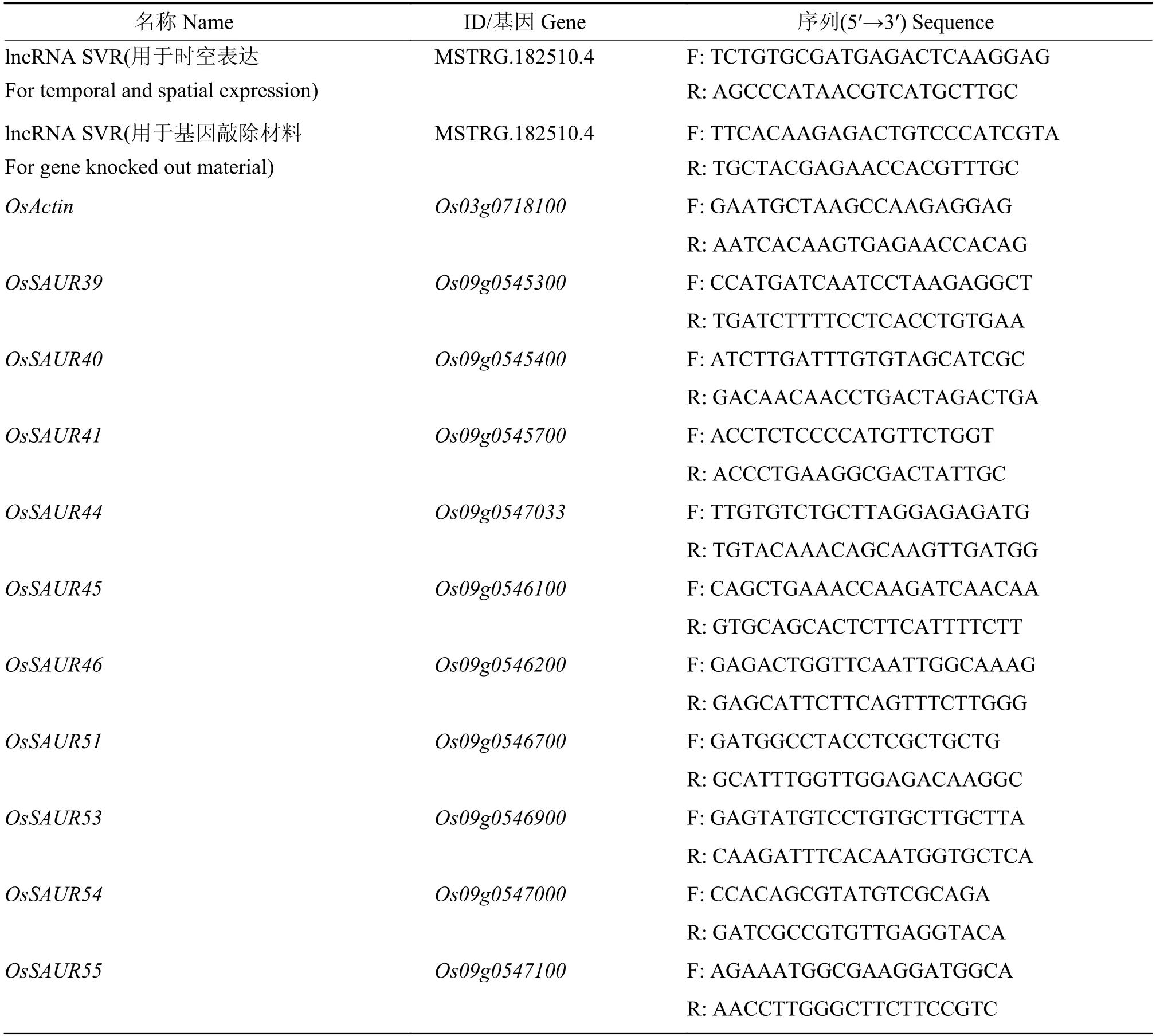
表1 本研究所使用的引物Table 1 qRT-PCR primers used in this study
1.3 lncRNA SVR冷胁迫基序比对和二级结构预测
使用EMBL在线网站(http://www.ebi.ac.uk/Tools/psa/)开展冷胁迫基序的比对分析,使用RNAfold WebServer (http://rna.tbi.univie.ac.at/)进行RNA二级结构预测。
1.4 数据分析和作图
用Excel 2016对所有的定量数据整合分析,采用相对定量方法进行分析[19],将数据导入GraphPad Prism 9.5,进行学术绘图。
2 结果与分析
2.1 lncRNA SVR序列中存在冷胁迫响应基序
二级结构预测结果表明,lncRNA SVR的最佳二级结构为典型的茎环结构,包含4个稍大一点的环与多个较小的环,最小自由能为-716.36 kJ/mol(图1A)。Di等[20]使用RNApromo预测了由共表达网络分组的lncRNA中的保守结构基序,有25组,共80个lncRNA,其中发现了一些与胁迫相关的结构基序。例如,发现富含AU的茎环(AUC=0.948,E=3.1×10-4,P<0.001)对冷胁迫有反应,该冷胁迫响应保守基序为AGAGAAAGAAAG,这些保守基序可能是导致RNA分子响应胁迫的原因。使用EMBL Water的史密斯-沃特曼算法对冷胁迫响应基序和lncRNA SVR序列进行比对,发现lncRNA SVR转录区域内的序列AGAAAAAGAAAC和该保守基序相似性达83.3%(10/12),该基序位于其二级结构的茎环相连接处(图1B)。分析结果表明,lncRNA SVR内部存在与已经报道的冷胁迫响应基序高度相似性的序列,这说明lncRNA SVR可能会响应低温逆境胁迫。

图1 lncRNA SVR序列中存在的冷胁迫响应基序Fig.1 Cold stress response motif in lncRNA SVR
2.2 常温和低温下水稻种子中lncRNA SVR的表达特性
前期研究发现lncRNA SVR在水稻种子中呈现组织特异表达特性,为了进一步验证lncRNA SVR是否响应低温胁迫,本研究对野生型材料种子进行常温萌发和低温萌发处理,检测lncRNA SVR在不同环境中的表达动态。结果(图2)发现,在低温条件下,lncRNA SVR的表达量在干种子(0 d)中最高,随后均处于明显降低的状态,但1 d的表达量仍明显高于之后的时间点;在常温下,1 d的表达量不但略高于0 d的表达量,还明显高于3、5和7 d的表达量,且3、5和7 d的表达量基本接近。总体而言,1、3、5、7 d该lncRNA SVR在常温下的表达量均明显高于其在低温下对应时间点的表达量。可见,在种子萌发过程中低温逆境可抑制lncRNA SVR的表达,说明lncRNA SVR在种子萌发过程中响应低温胁迫。

图2 lncRNA SVR在常温和低温萌发中表达的动态变化Fig.2 Dynamic changes of lncRNA SVR expression in seed germination at room and low temperatures
2.3 常温和低温下lncRNA SVR的邻近SAUR基因的表达特性
采用qRT-PCR分析lncRNA SVR上游SAUR基因簇中各个基因的表达特性,结果(图3)表明:OsSAUR39和OsSAUR40在常温下的表达量随着萌发时间的增加而逐步上升,且7 d的表达量最高;而在低温下OsSAUR39在5 d的表达量最高,OsSAUR40在3、5、7 d的表达量高于1 d、低于0 d。OsSAUR41在常温下1、3、7 d的表达量较为接近且处于较高的水平,是0、5 d的数十倍;而在低温下5、7 d的表达量明显高于0、1、3 d,仍明显低于常温1、3、7 d的表达水平。OsSAUR44在常温下1、3、5、7 d的表达量均高于0 d,且1 d的表达量最高;在低温下,3、5、7 d的表达量明显高于0、1 d,总体上高于常温下萌发的表达水平,说明该基因在萌发过程中受到了低温的强烈诱导。OsSAUR45在常温下1、3、5、7 d的表达量基本没有变化且均明显低于0 d;其在低温下5、7 d的表达量明显高于1、3 d,但仍低于0 d的表达量,总体上低温下的表达水平高于常温,可见该基因在萌发过程中也受到了低温的诱导。OsSAUR46在常温下1、3、5、7 d的表达量无明显差异,但均低于0 d;其在低温下0、1 d的表达水平基本接近,在3、5、7 d的表达量基本保持与0 d相同的水平,且低温下的表达水平明显高于常温,说明该基因在低温萌发过程也受到了一定的诱导。OsSAUR51与OsSAUR54在常温下1 d的表达量高于其他时间点,在低温下3、5、7 d的表达量均上升到较高的水平,总体而言其在低温下的表达水平明显高于常温,说明这2个基因在萌发过程中也受到了低温的强烈诱导。OsSAUR53与OsSAUR55在常温下1、3 d的表达水平维持在较高水平,5、7 d的表达水平与0 d较为接近,均呈现较低的状态;在低温下3、5、7 d的表达量上升到较高的水平,明显高于0、1 d,这表明在种子萌发后期,该基因受到低温的持续诱导。
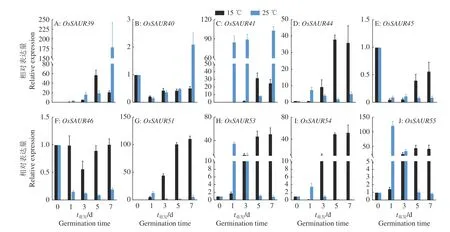
图3 SAUR基因簇在常温和低温的表达分析Fig.3 Expression analysis of SAUR gene cluster at room and low temperature
以上结果表明,OsSAUR39、OsSAUR40、OsSAUR41、OsSAUR44、OsSAUR45、OsSAUR46、OsSAUR51、OsSAUR53、OsSAUR54、OsSAUR55在常温和低温萌发下的表达水平差异较大,其中,OsSAUR44、OsSAUR46、OsSAUR51、OsSAUR53、OsSAUR54、OsSAUR55,在萌发过程中均受到了低温的诱导,OsSAUR44在低温处理后5、7 d表达量最高,低温处理可以持续诱导OsSAUR46并使其表达量维持在一定水平,OsSAUR51与OsSAUR54也受到低温的强烈诱导,二者在低温下的表达变化情况较为相似,OsSAUR53与OsSAUR55在种子萌发后期也受到低温的强烈诱导且呈现出相似的表达趋势。虽然这些邻近基因属于同一个SAUR基因簇,但是在常温和低温下的表达特性存在很大区别,分析这些基因在不同温度及不同萌发时间点表达的动态变化,对进一步研究SAUR基因簇响应冷胁迫功能具有较大的参考意义。
2.4 低温下lncRNA SVR与SAUR基因表达的相关性
在前面的研究中,我们分析了常温和低温下野生型材料中lncRNA SVR和SAUR基因簇中各个基因的表达情况,推测lncRNA SVR和SAUR基因可能会响应低温胁迫,为进一步明确它们之间的调控关系,有必要开展低温下lncRNA SVR与SAUR基因表达的相关性分析。以低温下lncRNA SVR和SAUR基因0 d时的表达量作为对照,选择了6个数据点(1、3、5、7、9、11 d)进行相关性分析,结果(图4)表明,lncRNA SVR的表达与OsSAUR39、OsSAUR45、OsSAUR51、OsSAUR53、OsSAUR55的表达负相关关系明显,其中lncRNA SVR与OsSAUR55的表达呈现显著的负相关关系,因此,lncRNA SVR可能与这些SAUR基因存在某种调控机制,值得进一步探索。
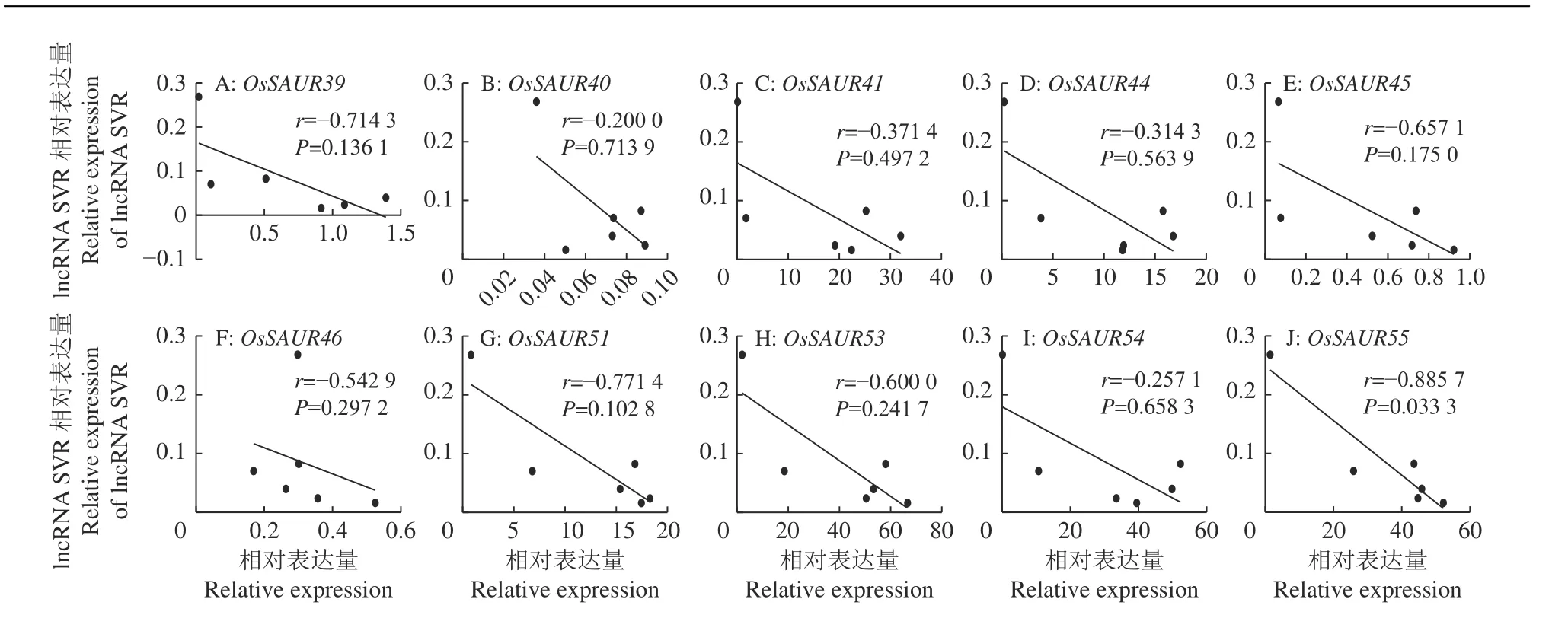
图4 lncRNA SVR和SAUR基因簇表达的相关性分析Fig.4 Expression correlation analysis of lncRNA SVR and SAUR genes
2.5 lncRNA SVR与SAUR基因的转录调控
前期研究通过Cas9/CRISPR技术创制了lncRNA SVR的2个纯合突变体,分别为crlnc-5(ACTT缺失)、crlnc-11 (T缺失),如图5所示。为了进一步探究低温胁迫下lncRNA SVR与SAUR基因的表达调控关系,对低温处理2、4 d后不同lncRNA SVR敲除材料中SAUR基因的表达水平进行分析。结果(图6)表明,在野生型材料和敲除材料中,4 d时lncRNA SVR的表达量均低于2 d的表达量,但在野生型中lncRNA SVR表达量的下降幅度明显高于在敲除材料中的下降幅度,这意味着敲除lncRNA SVR能够减小低温下lncRNA SVR表达水平的下降幅度。除了OsSAUR46外,与低温处理2 d相比,OsSAUR39、OsSAUR40、OsSAUR41、OsSAUR44、OsSAUR45、OsSAUR51、OsSAUR53、OsSAUR54、OsSAUR55在处理4 d野生型和lncRNA SVR突变体材料中的表达量均上升,考虑到lncRNA SVR表达量的下降趋势,它们之间的关系与前文描述的负相关较为吻合。因此,进一步分析lncRNA SVR在不同低温处理时间的表达对SAUR基因表达的影响,推测lncRNA SVR表达量下降的幅度越大,SAUR基因的表达量上升的幅度越大,相反,lncRNA SVR表达量下降的幅度越小,SAUR基因的表达量上升的幅度也越小。因此,我们在野生型和lncRNA SVR突变体材料中分析SAUR基因的表达变化,结果(图7)表明,与低温处理2 d相比,低温处理4 d时,OsSAUR41、OsSAUR53、OsSAUR54、OsSAUR55在lncRNA SVR突变体中的表达量上升幅度均在P< 0.01水平显著低于在野生型中的上升幅度,而其他SAUR基因的表达特性并不呈现明显的规律性。
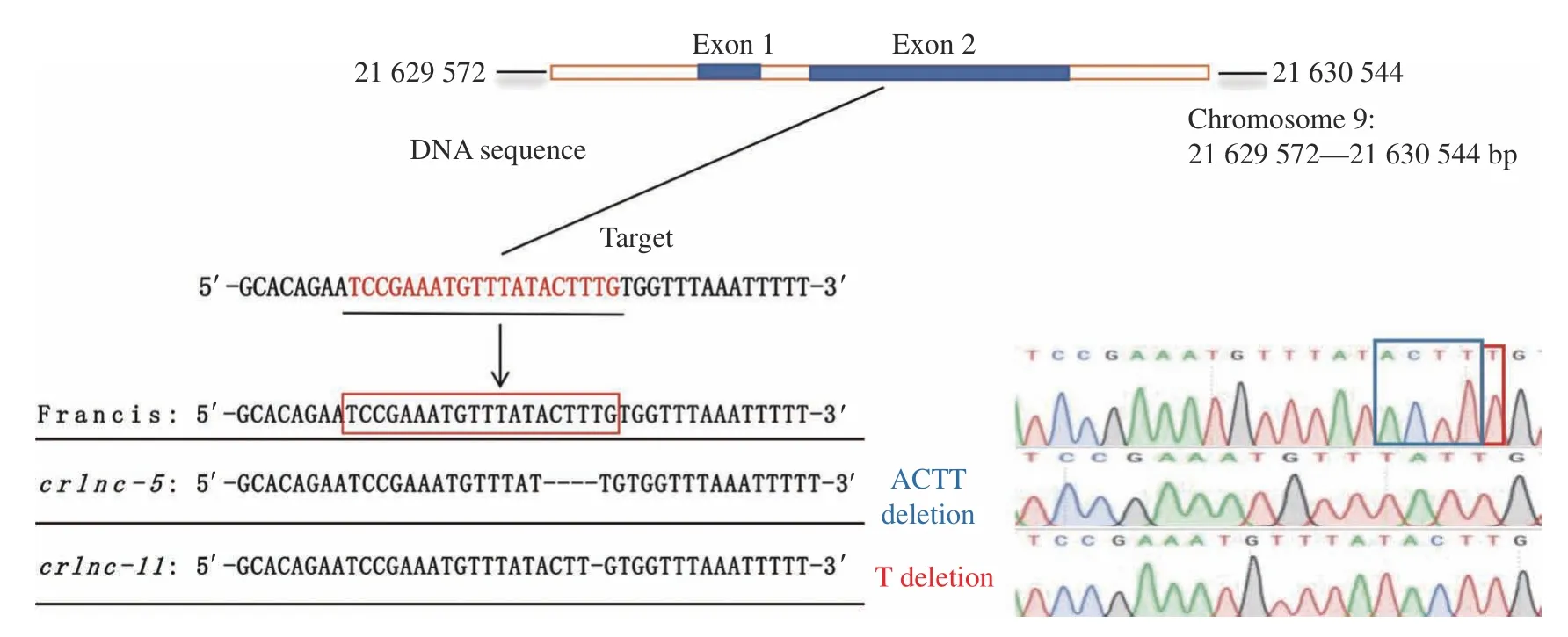
图5 lncRNA SVR突变体的靶点序列Fig.5 Target sequences of the lncRNA SVR mutants

图6 不同SAUR基因在lncRNA SVR转基因材料中的表达分析Fig.6 Expression analysis of different SAUR genes in lncRNA SVR transgenic materials
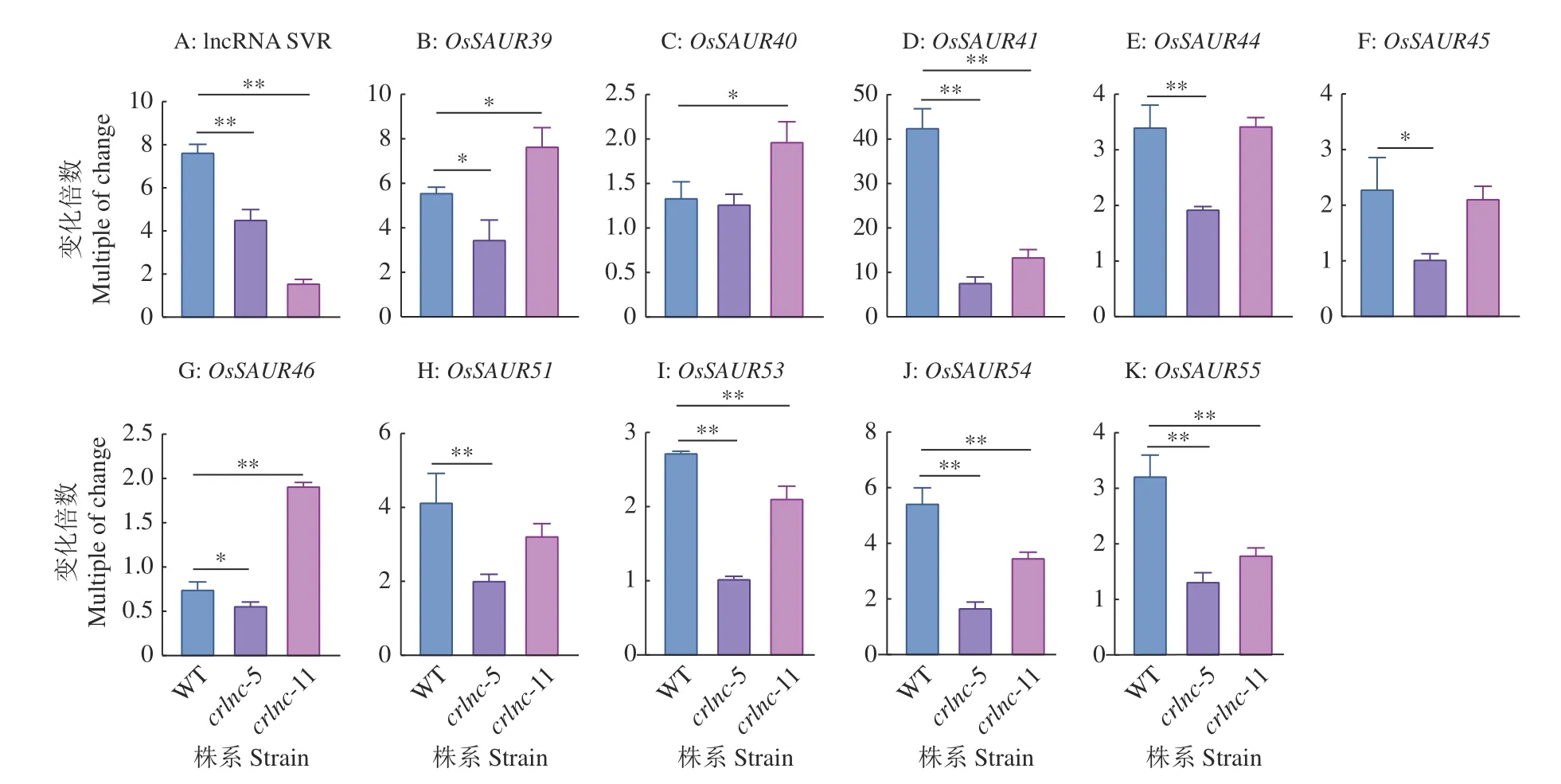
图7 不同SAUR基因在lncRNA SVR转基因材料中的表达变化Fig.7 Expression changes of different SAUR genes in lncRNA SVR transgenic materials
3 讨论与结论
低温胁迫会影响水稻种子萌发,进而导致出苗率降低,产量下降。SAUR基因家族是植物特有的、生长素响应因子中最大的一个家族,而且能够在生长素诱导的早期做出响应,是生长素早期应答的三大基因家族之一[21]。目前,对SAUR基因家族的研究在经济作物和模式作物中取得了一定的进展。Chae等[22]研究发现,表达SAUR63:GFP或SAUR63:GUS融合的转基因拟南芥的下胚轴、花瓣和雄蕊丝更长,表明这些蛋白质融合导致功能增强,SAUR63:GFP和SAUR63:GUS幼苗在下胚轴中积累的生长素含量也高于野生型幼苗。吴春梅[23]研究发现,常温(22 ℃)条件下培养4周,35S::SAUR16叶片数目和鲜质量较Col-0显著减少,35S::SAUR6、35S::SAUR14则无显著差异;低温(4 ℃)条件下植物生长缓慢,培养12周后所有SAUR转基因植株的叶片数目和鲜质量与Col-0相比均无显著差异。以上结果表明,SAUR6、SAUR14和SAUR16虽然属于同一基因家族,但不同SAUR基因对拟南芥生长的作用不同。翟立升[24]研究表明T1代OsSAUR10过量表达转基因植株苗期矮小、根系短,CRISPR敲除系种子的萌发率、结实率、分蘖数都降低,且在苗期矮小,说明OsSAUR10正向调控水稻种子萌发和苗期生长,超表达系和CRISPR敲除系在苗期的表型相似可能是由于响应不同的激素途径导致的。李明发[25]分析发现SAUR15的TDNA插入缺失突变体saur15-1的萌发速度低于野生型Col-0,而超表达植株pSAUR15::SAUR15-FLAG与35S::SAUR15-FLAG的萌发速度均高于Col-0;组织定位分析结果显示SAUR15在种子各萌发阶段中广谱表达,以上结果表明SAUR15在种子萌发过程中发挥正调控作用。SAUR基因家族属于生长素信号途径中的重要成员,生长素是植物中最重要的一种信号分子,调控植物生长发育的各个方面,生长素通过多条平行的途径被生物合成和失活,也通过典型和非典型途径被感受和转导,生长素在种子休眠和萌发中的作用主要受其生物合成与分解代谢以及信号转导途径的调控[26]。lncRNA对SAUR基因的调控鲜有报道,Sun等[27]研究发现MSTRG.85814的剪接变体MSTRG.85814.11正向调节且顺式靶向生长素上调基因SAUR32,使用pH成像技术,观察到MSTRG.85814.11和SAUR32过表达苹果植株根尖质外体的pH显著降低,MSTRG.85814.11被证明可以积极促进SAUR32的表达,揭示了lncRNA促进植物在缺铁胁迫下的响应机制。
本研究中,我们发现lncRNA SVR序列中存在冷胁迫响应基序,且在茎环连接处;对lncRNA SVR的表达特性分析表明,低温胁迫会持续降低lncRNA SVR的表达;还发现在种子萌发过程中lncRNA SVR邻近的多个SAUR基因在低温胁迫下的表达量明显高于其在常温下的表达量,这表明lncRNA SVR的邻近SAUR基因簇一定程度上能够和lncRNA SVR一样响应低温胁迫;低温胁迫下表达的相关性分析表明,lncRNA SVR的表达与OsSAUR39、OsSAUR45、OsSAUR51、OsSAUR53、OsSAUR55表达的负相关关系明显,其中,lncRNA SVR与OsSAUR55的表达呈现显著的负相关关系,值得注意的是,在低温下,lncRNA SVR与这些SAUR基因的表达关系均呈现负相关,这表明lncRNA SVR可能会顺式靶向且负调控SAUR基因的表达。因此,我们分析野生型种子和lncRNA SVR突变体种子低温处理2、4 d时lncRNA SVR和SAUR基因的表达关系,发现lncRNA SVR在突变体材料中表达量的下降幅度极显著低于在野生型中的下降幅度。前面我们推测lncRNA SVR对SAUR基因可能存在负调控作用,低温4 d与低温2 d相比,在lncRNA SVR突变体中,随着lncRNA SVR的表达量下降,SAUR基因表达量应呈上升趋势。因此我们进一步分析了SAUR基因的表达情况,结果表明,OsSAUR41、OsSAUR53、OsSAUR54、OsSAUR55在lncRNA SVR突变体中的表达量均上升,而且上升幅度极显著低于其在野生型中的上升幅度,这可能是由于lncRNA SVR在突变体中的下降幅度低于其在野生型的下降幅度所致。总之,根据在低温下lncRNA SVR和SAUR基因表达的相关性分析和SAUR基因在lncRNA SVR突变体中的表达量分析,lncRNA SVR很有可能负调控OsSAUR55的表达,进而响应低温胁迫。
目前,lncRNA对SAUR基因家族的调控鲜见报道,对lncRNA调控功能基因的机制更是知之甚少。本研究对lncRNA SVR突变体和野生型材料中lncRNA SVR和SAUR基因开展表达动态变化研究,能更准确地表明lncRNA SVR与SAUR基因在低温下的表达动态,进而分析lncRNA SVR对SAUR基因的调控关系,相比在单一时间点研究lncRNA SVR与SAUR基因的表达关系更为准确。有研究报道表明,lncRNA对基因的表达调控与正常的编码蛋白基因不同,lncRNA SVR是如何通过调控基因的表达来发挥功能,进而响应逆境胁迫,可能存在更复杂的调控机制,对于其中调控机理的研究,值得进一步探索。

