水稻溶血磷脂酸酰基转移酶基因(LPAT)家族生物信息学分析及在籽粒油脂合成中的作用
曹华盛,李 堂,2,熊 亮,王福军,李曙光,顾海永,何 高,罗文永,梁世胡
(1 广东省农业科学院 水稻研究所,广东 广州 510640;2 华中农业大学 植物科学技术学院,湖北 武汉 430070)
水稻OryzasativaL.是我国最重要的粮食作物之一,它以占全国 28.1%的粮食播种面积,生产出全国 40.2%的粮食[1],对保障我国的粮食安全和农业可持续发展具有举足轻重的意义。自20世纪50年代以来,经过几代育种家的不懈努力,水稻单产实现了3次质的飞跃,彻底解决了14亿中国人的温饱问题[2]。随着生活水平的提高,人们对稻米的品质要求也越来越高,产量高而米质不理想的“稻强米弱”现象显得愈发突出,因此“产量和品质协同提升”取代“产量优先”及“产量为先兼顾品质”,日益成为水稻育种家重视的课题。
随着饮食结构的精细化以及生活水平的不断提高,人们对大米的外观品质、适口性及营养品质的要求都不断提高。脂类作为稻米主要的储藏物质之一,不仅具有丰富的营养价值,而且对稻米品质尤其是蒸煮食味品质也具有较大影响[3-7]。脂类主要以贮藏脂肪形式存在于稻米中。水稻种子在开花后5~12 d 迅速积累贮藏油脂,其主要成分是三酰甘油(Triacylglycerol,TAG),由脂肪酸与甘油脱水缩合生成。溶血磷脂酸酰基转移酶(Lysophosphatidic acid acyltransferase,LPAT)催化溶血磷脂酸(Lysophosphatidic acid,LPA)sn-2位酰基化形成磷脂酸(Phosphatidic acid,PA),是油脂从头合成中的关键限速酶之一[8]。目前,研究人员已从多种植物中分离得到LPAT基因,包括拟南芥Arabidopsis[9-10]、棉花Gossypium[11-12]、玉米Zeamays[13]、花生Araxhis hypogaea[14]、蓖麻Ricinuscommunis[15]等。拟南芥基因组中存在 5个LPAT基因,广泛参与了拟南芥生长发育的各个生物学过程。其中,AtLPAT1参与叶绿体中的磷脂合成,它的缺失将导致胚胎致死现象的发生[16];内质网定位的AtLPAT2参与了磷脂的从头合成途径,在拟南芥生长发育各个阶段起着重要的作用,而且它能通过刺激磷脂的合成而参与拟南芥对低磷胁迫的响应[17-19];AtLPAT4和AtLPAT5参与内质网中磷脂的合成,从而正调控拟南芥对低氮胁迫的响应[20]。另外,有研究显示水稻LPAT2及其产物PA通过介导脱落酸(Abscisic acid,ABA)信号正调控水稻对高渗胁迫的响应[21]。除参与磷脂合成外,LPAT基因家族成员也参与了油菜Brassicanapus、棉花、花生和蓖麻等作物种子中油脂TAG的合成。研究表明,超表达BnLPAT2和BnLPAT5分别通过促进二酰基甘油的合成及磷脂酸的合成而显著提高油菜种子的含油量[22];在拟南芥中超表达花生AhLPAT2,能显著提高超表达材料种子中的含油量[23];在蓖麻中超表达RcLPAT2不仅能提高总含油量,还能提高油脂TAG中的不饱和脂肪酸含量[24]。
到目前为止,关于水稻LPAT基因家族在水稻籽粒油脂合成中的功能鲜见相关报道。因此,研究LPAT家族在籽粒油脂合成中的作用,挖掘LPAT家族各成员的可用遗传变异,对于高油性品质水稻品种的遗传改良和培育具有重要意义。LPAT家族在水稻基因组中存在5个成员,但目前仅有LPAT2被报道与高渗胁迫响应相关,其在水稻籽粒油脂合成中的功能鲜见相关报道。本研究通过生物信息学、比较转录组学和代谢组学等方法对水稻LPAT基因家族成员的可能功能进行分析,以期为深入解析该基因家族成员在水稻生长发育及籽粒油脂合成中的功能奠定基础。
1 材料与方法
1.1 供试材料
本研究所用水稻品种为‘广8B’(G8B)和‘象牙香占’(XYXZ),两者均系广东省农业科学院水稻研究所培育的优质水稻品种。其中‘广8B’为广东省大面积推广三系不育系‘广8A’对应的保持系,其饭味具有油性好、松软弹滑的特征[25]。
1.2 试验处理及样品准备
1.2.1 转录组分析 1)样品准备:种植水稻品种‘广8B’和‘象牙香占’分别在灌浆初期(授粉后10 d,10 DAF)、灌浆中期(授粉后20 d,20 DAF)、灌浆后期(授粉后30 d,30 DAF)取水稻种子样品;2)样品前处理:与叶片组织相比,水稻胚乳(种子)含有大量的淀粉,故抽提 RNA 时主要注意除去淀粉且防止 RNA 被淀粉粒包裹后一同沉降,抽提缓冲液的高浓度盐离子有助于达到这一目的。提取Buffer 为:4 mol 尿素,4 mol 盐酸胍,3 mmol EDTA,10 mmol HEPES(pH7.0),提取方法与 Trizol法类似;提取完成后检测 RNA 质量,将质量合格的RNA 送至武汉迈维代谢有限公司进行转录组测序;3)转录组测序:采用 Illumina HiSeq 测序平台进行测序,其程序主要包括 RNA 样品检测,富集mRNA,合成双链 cDNA,文库构建,文库检测和Illumina HiSeq 平台测序;4) 结果分析:根据测序结果分析脂质代谢相关基因的表达差异。
1.2.2 脂质代谢组分析 种植水稻品种‘广8B’和‘象牙香占’,分别在灌浆初期(10 DAF)、灌浆中期(20 DAF)、灌浆后期(30 DAF)取水稻种子样品;将稻米捣碎,称取米粉约 200 mg,加入内标(0.1 mg/mL,10 μL),再用正己烷 3 mL 超声提取 1 h,取上清,再加入异丙醇 3 mL 再次提取 30 min,合并两次上清,氮吹仪吹干,用异丙醇复溶至 1 mL,5 000 r/min离心 10 min,过 0.22 μmol 滤器;用UPLC-Qtof 法测定脂质成分及含量,其色谱系统为shimadzu UPLC LC-30AD,色谱柱为Phenomenex Kinete C18 column(100 Å×2.1 mm,2.6 μm),进样量10μL,流速0.4 mL/min,柱温60 ℃,样品室温度4 ℃。A 相:H2O∶MeOH∶ACN(含 5 mmol NH4Ac)体积比为1∶1∶1;B 相:IPA∶乙腈(含 5 mmol NH4Ac) 体积比为5∶1。梯度洗脱条件:0.5 min,体积分数(φ)为20%的B相;1.5 min,φ为40%的B相;3 min,φ为60%的B相;13 min,φ为98%的B相;13.1 min,φ为20%的B相;17 min,φ为20%的B相。质谱系统:ABSciex TripleTOF® 6 600,ESI 离子源,正模式,质谱采集的质量数范围为m/z100~1 200,质谱条件:Curtain Gas:35.000 psi;Ion Source Gas1:50.000 psi;Ion Source Gas2:50.000 psi;IonSpray Voltage:5 500.00 V;Temperature: 600 ℃。
1.3 生物信息学分析
1.3.1 同源基因查找 在拟南芥基因组数据库(https://www.arabidopsis.org)中下载拟南芥LPAT蛋白序列(At4g30580、At3g57650、At1g51260、At1g75020和At3g18850,),通过NCBI (https://www.ncbi.nlm.nih.gov/)的BLAST比对同源基因,得到候选水稻LPAT家族成员,同时,在Ensemble plant 水稻数据库(http://plants.ensembl.org/Oryza_sativa/Info/Index)中搜索关键词Lysophosphatidic acid acyltransferase,比较2个数据库中的搜索结果,最终确认水稻LPAT基因家族成员,并利用Expasy在线网站(http://www.expasy.org)分析相关蛋白的氨基酸长度、分子量、理论等电点、不稳定系数、水溶指数等。
1.3.2 保守结构域分析 分别通过Interproscan(https://www.ebi.ac.uk/interpro/)及SMART(http://smart.embl-heidelberg.de/)数据库分析水稻LPAT家族成员的保守结构域;保守基序和基因结构分析:利用MEME在线网站(https://memesuite.org/meme/tools/meme)对LPAT家族成员进行基序分析,利用GSDS(http://gsds.gao-lab.org/)分析OsLPAT家族成员基因结构,并使用TBtools软件进行可视化。
1.3.3 系统进化树分析 为了进一步了解LPAT在植物系统中的进化关系,本研究收集了水稻、拟南芥、雷蒙德氏棉Gossypiumraimondii、蓖麻、大豆Glycinemax、二穗短柄草Brachypodium distachyon、小麦Triticumaestivum、高粱Sorghum bicolor、花生、亚麻荠Camelinasativa、欧洲油菜Brassicanapus等11种作物的LPAT蛋白序列注释文件,利用MEGA软件构建系统发育树,建树完成后在Itol(https://itol.embl.de/tree/)网站进行进化树的进一步美化。
1.3.4 顺式作用元件分析 利用plantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plant care/html/)对水稻LPAT家族成员起始密码子上游2 kb序列进行顺式作用元件分析,以期揭示OsLPAT可能的生物学功能。
1.3.5 时空表达谱、激素和逆境表达谱分析 利用RAP-DB(https://ricexpro.dna.affrc.go.jp/)数据库分析水稻LPAT基因家族在水稻生长发育不同阶段组织中的表达量,以及在不同激素处理及非生物胁迫条件下的表达情况。
2 结果与分析
2.1 水稻LPAT家族成员鉴定及蛋白质理化性质分析
通过比对NCBI中BLASTP及Ensemble plant中关键词搜索结果发现,水稻LAPT基因家族共有5个成员,分别为Os10g0497100 (OsLPAT1)、Os11g0637800 (OsLPAT2)、Os04g0625200(OsLPAT3)、Os05g0502200 (OsLPAT4)和Os01g0782500 (OsLPAT5)。蛋白质理化性质分析结果表明,sLPAT基因家族成员编码蛋白的氨基酸数量在292~399,相对分子质量在32 317.06~45 773.74,等电点大于8.5,亚细胞预测均定位于内质网(表1)。

表1 水稻LPAT基因鉴定及其编码蛋白质的理化性质分析Table 1 Identification of rice LPAT genes and physicochemical properties analyses of encoded proteins
2.2 保守结构域分析
Interproscan数据库中的保守结构域分析结果表明,通过同源搜索得到的5个OsLPAT均具有PF01553(Acyltransferase C-terminus)这一保守结构域;另外,SMART数据库中的分析结果显示,OsLPAT家族成员均具有PlsC(Phosohate acyltransferases)保守结构域。除此之外,OsLPAT2、OsLPAT4、OsLPAT5均含Acyltransf_C端结构域(图1),上述结果表明,通过生物信息学分析得到的5个OsLPAT可能具有酰基转移酶活性,推测其在催化溶血磷脂酸向磷脂酸转化的过程中发挥作用。
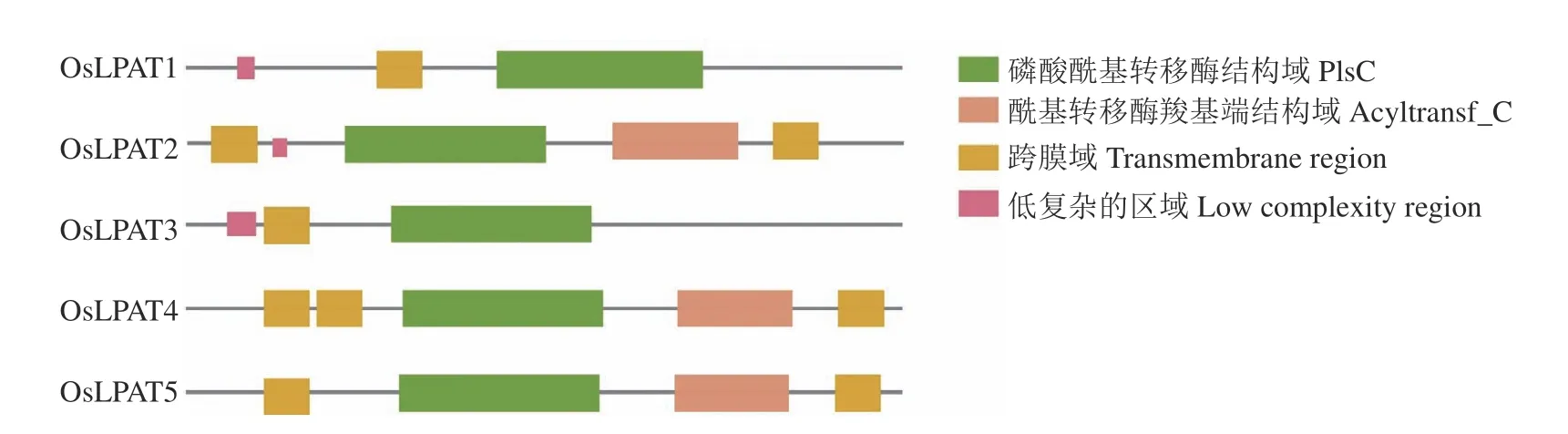
图1 OsLPAT家族保守结构域分析Fig.1 Conservative structural domain analysis of OsLPAT family
2.3 保守基序和基因结构分析
保守基序和基因结构分析是分析基因间同源性高低的重要手段。MEME分析结果显示,水稻LPAT家族成员之间保守基序数量存在较大差异(图2)。其中OsLPAT1和OsLPAT3仅分别存在1个保守的Motif(Motif 2和Motif 8),而OsLPAT4和OsLPAT5则存在8个同样的保守基序(Motif 1~Motif 8),这个结果表明,水稻LPAT家族成员之间功能可能存在分化,而OsLPAT4和OsLPAT5同源性较高,功能上可能存在冗余。另外,我们还分析了水稻LPAT基因家族成员的基因结构(图3)。结果显示OsLPAT1、OsLPAT3、OsLPAT4和OsLPAT6分别具有4~6个外显子,而OsLPAT2基因则由11个外显子和10个内含子组成。这个结果预示着OsLPAT1、OsLPAT3、OsLPAT4和OsLPAT6在进化上是比较保守的,而OsLPAT2在进化中可能经历了选择性剪接或基因复制事件。

图2 水稻LPAT家族蛋白保守基序分析Fig.2 The conserved motif analysis of rice LPAT family proteins

图3 水稻LPAT家族基因结构分析Fig.3 Gene stucture analysis of rice LPAT family
2.4 系统进化树分析
为了进一步了解LPAT在植物系统中的进化关系,本研究获取水稻、拟南芥、玉米、大豆、小麦、高粱等6种作物的LPAT蛋白序列注释文件,然后利用MEGA软件构建系统发育树。建树完成后,在Itol网站进行进化树的进一步美化。进化树分析结果显示,与拟南芥相比,水稻中LPAT蛋白家族同样存在5个成员,分别命名为OsLPAT1~OsLPAT5,而且OsLPAT2和OsLPAT3同源性较高,而OsLPAT4则与OsLPAT5同源性较高,这与我们利用MEME分析得到的结果是一致的。我们还发现除大豆外,其他植物中LPAT蛋白家族均可分为5个亚家族(Ⅰ、Ⅱ、Ⅲ、Ⅵ、Ⅸ)(图4)。我们的结果还显示,OsLPAT1、OsLPAT2、OsLPAT3和OsLPAT5与高粱、玉米的家族基因在进化分支上聚为同一类。表明同为LPAT基因在单子叶植物中是较为保守的,可能具有类似的生物学功能。

图4 植物LPAT家族系统进化树分析Fig.4 Phylogenetic analysis of LPAT family in plant
2.5 顺式作用元件分析
启动子区域的顺式调控元件不仅可能影响基因的时空表达模式,而且还会影响基因对外界环境(如激素和逆境胁迫)的响应过程。为了了解水稻LPAT家族成员的表达特性,我们将OsLPAT1~OsLPAT5这5个基因起始密码子上游2 kb序列进行了顺式作用元件分析。结果显示,OsLPAT3启动子区存在生长素响应、茉莉酸甲酯和赤霉素信号响应元件,OsLPAT4启动子区存在生长素响应元件,另外,在OsLPAT1、OsLPAT2、OsLPAT5启动子区均发现低温诱导元件,而在OsLPAT2启动子区则发现存在厌氧诱导元件(图5)。上述结果表明,OsLPAT家族成员可能参与了水稻对众多植物激素及逆境胁迫的响应过程。

图5 水稻LPAT基因家族启动子顺式作用元件分析Fig.5 Analysis of cis-acting elements in promoters of rice LPAT gene family
2.6 组织表达谱、激素和逆境表达谱分析
为了了解水稻LPAT家族基因的表达特性,我们利用转录组数据库提取了水稻LPAT基因在水稻叶片、叶鞘、根和茎,3~4 mm的幼穗以及授粉后7、14、28和42 d胚胎的表达量(图6)。结果显示:OsLPAT2和OsLPAT5在水稻整个生长发育过程中均有表达,其中OsLPAT2在根、茎、3~4 mm的幼穗和叶鞘、7 d的胚中表达量较高;OsLPAT4在胚、茎和3~4 mm的幼穗中呈现出较高表达量;OsLPAT3在叶鞘中表达量较高;而OsLPAT1各生长发育阶段表达量均较低。上述结果表明,水稻LPAT基因家族成员可能存在功能分化,分别参与了对水稻不同生长发育过程的调控。另外,为了进一步探讨水稻LPAT基因家族成员是否参与了水稻对激素及非生物逆境的响应,我们利用转录组数据库信息分析了LPAT基因家族各成员在ABA、油菜素内酯(Brassinosteroids,BR)、生长素(Auxin,IAA)、赤霉素(Gibberellin,GA)、茉莉酸(Jasmonic acid,JA)、细胞分裂素(Cytokinin,CTK)处理条件下的表达量,结果显示,与对照相比,OsLPAT2受到了各种激素及逆境胁迫的诱导,包括ABA、BR、CK、N-、P-的诱导。OsLPAT1、OsLPAT3和OsLPAT5受到ABA处理的诱导,其中OsLPAT3的表达量在ABA处理3 h后上升了将近100倍,而OsLPAT3的表达量特异性地受到了氧化胁迫的诱导(图7)。上述结果表明,水稻LPAT基因家族成员广泛参与了植物对激素和逆境胁迫的响应。

图6 水稻LPAT基因家族组织表达谱分析Fig.6 Tissue expression profile analysis of rice LPAT gene family

图7 水稻LPAT基因家族激素和逆境表达谱分析Fig.7 Hormone and stress expression profiles of rice LPAT gene family
2.7 OsLPAT家族成员在水稻籽粒油脂合成中的作用分析
为了进一步分析OsLPAT家族成员在水稻籽粒油脂合成中的作用,我们测定了水稻品种‘象牙香占’和‘广8B’抽穗30 d后籽粒中的油脂含量(图8A),测定结果显示‘广8B’(G8B)籽粒中的油脂含量(22 234 nmol/g)显著高于‘象牙香占’(XYXZ)籽粒中的油脂含量(17 058 nmol/g)。油脂TAG组分分析显示‘广8B’油脂各TAG组分显著高于‘象牙香占’,特别是TAG (50∶2)、TAG (54∶2)、TAG (56∶3)、TAG (54∶4)、TAG (54∶5)和TAG (54∶6)等富含不饱和脂肪酸的油脂组分(图8B)。为了进一步分析造成2个品种水稻籽粒油脂含量差异的原因,我们对这2个材料不同时期的籽粒样品(分别于抽穗后10、20和30 d取样)进行了转录组学测序,并对其中影响籽粒油脂代谢的相关基因的表达量进行了比较分析(图9)。通过分析‘广8B’与‘象牙香占’籽粒不同发育时期的转录组数据,我们发现油脂代谢通路相关基因在籽粒发育的不同阶段(前/中/后期)发挥作用,2个品种籽粒中油脂含量的差异可能是受多基因共同调控的结果。其中,在‘广8B’籽粒发育前期(授粉后10 d,10 DAF),OsLPAT5/OsPLDα6/OsPLDα8/OsPLDδ3基因的表达量显著高于其在‘象牙香占’相同发育时期籽粒中的表达量;在‘广8B’籽粒发育中期(授粉后20 d,20DAF),OsGPAT3/OsGPAT8/OsLPAT2/OsPLDδ1/OsPLDκ/OsNPC1/OsNPC3/OsWSD/DGAT-3的表达量显著高于其在‘象牙香占’相同发育时期籽粒中的表达量;而到了籽粒发育后期(授粉后30 d,30 DAF),我们同样观察到OsLPAT3/OsLPAT4/OsPLDα2/OsPLDβ1/OsPLDδ1/OsPLDδ2/OsDGAT2-2/OsWSD/OsDGAT-2在‘象牙香占’中的表达量显著低于其在‘广8B’相同时期籽粒中的表达量(图9、图10)。上述结果表明,在籽粒发育的不同时期,‘广8B’和‘象牙香占’油脂代谢相关基因的表达存在显著差异,预示着这些基因表达差异可能是形成两者籽粒中油脂含量差异的根本原因。

图9 水稻品种‘象牙香占’和‘广8B’籽粒油脂代谢相关基因表达量分析Fig.9 Expression analyses of genes related to grain oil metabolism in rice varieties ‘Xiangya Xiangzhan’ and ‘Guang 8B’

图10 水稻品种‘象牙香占’和‘广8B’籽粒油脂代谢相关基因差异表达分析Fig.10 Differential expression of genes related to grain oil metabolism between rice varieties ‘Xiangya Xiangzhan’ and‘Guang 8B’
3 讨论与结论
溶血磷脂酸酰基转移酶(LPAT; EC 2.3.1.51)催化溶血磷脂酸(LPA)sn-2位置上酰基化反应形成磷脂酸(PA)。越来越多的证据表明磷脂酸PA作为一个重要的信号分子在细胞信号转导过程中发挥着重要的作用,广泛参与了植物生长发育及逆境响应等众多生物学过程[26-27]。现有研究表明,PA的信号功能是通过其与靶标蛋白的互作实现的。在动物细胞中,人们最初认为 PA 的作用依赖于其去磷酸化后的产物二酰基甘油,但随后的研究发现,PA通过直接与靶标蛋白结合来发挥其功能。随着对 PA 信号研究的深入,不断有新的PA靶标被发现,包括一系列转录因子、蛋白激酶和蛋白磷酸酶等。研究表明,PA对生理活动的调节主要是通过对靶标蛋白的调控(增强/减弱其活性、影响其亚细胞定位等)而得以实现。在ABA信号响应中,PA和脱落酸钝感蛋白1(Abscisic acid insensitive 1,ABI1)互作将ABI1锚定在质膜上,阻止ABI1进入细胞核,从而阻断ABI1激活ABA信号负调节因子ATHB6的效应,最终实现PA对ABA 信号的正调控作用[26];此外,在拟南芥根中,PA能直接与转录因子Werewolf (WER) 互作并介导其入核发挥功能,从而调控根毛的生长[27]。在本研究中,我们发现OsLPAT3基因启动子区存在茉莉酸甲酯信号响应元件,OsLPAT4基因启动子区存在生长素信号响应元件,而OsLPAT5基因启动子区则同时存在生长素信号响应与茉莉酸甲酯信号响应元件,这些结果预示着水稻OsLPAT可能参与水稻对众多激素的响应过程。另外,在OsLPAT1、OsLPAT2及OsLPAT5基因启动子区还存在着低温响应元件及厌氧诱导元件等,暗示这些基因可能在水稻低温响应及厌氧条件下的生长发育中起作用。此外,我们的分析结果还显示,OsLPAT2和OsLPAT3受到了ABA处理的强烈诱导,特别是OsLPAT2,其表达水平在ABA处理条件下比对照增加了100倍。上述结果暗示水稻OsLPAT可能通过介导磷脂酸PA的合成及其信号转导而参与了水稻对各种激素信号及逆境胁迫的响应。但其具体功能及机制有待进一步研究。
油脂(主要是三酰基甘油TAG)及其衍生物不仅是植物体内重要的储能物质,同时也是植物中角质等生物聚合物的不可或缺的成分[28-29],在种子萌发和植物有性生殖等方面也发挥着重要的作用[30]。现有的研究表明,溶血磷脂酸酰基转移酶LPAT是油脂合成途径中的关键酶之一,其产物磷脂酸PA不仅具有脂质第2信使的功能,还是植物合成各种磷脂和油脂的重要中间产物,在提高种子含油量及改良种子油性品质等方面发挥着重要的作用。因此,LPAT与含油量的关系是前人研究LPAT功能的主要出发点。研究表明,在拟南芥中异位表达2个油菜LAPT异构酶,均能通过增加含油量和增加粒重的方式提高产量[10];研究人员通过研究油菜种子发育过程中Kennedy途径的各种酶的活性变化,发现LPAT活性最高,且高含油量品系中LPAT活性高于低含油量品系[31]。另外,有研究表明,花生种子含油量的积累速率与溶血磷脂酸酰基转移酶LPAT的表达量相对比,其变化是一致的[14]。在本研究中,我们发现水稻LPAT家族成员在籽粒发育的不同时期发挥着主导作用。在籽粒发育前期(抽穗后10 d),高含油量的水稻籽粒‘广8B’中LPAT5的表达量显著高于其在低含油量水稻籽粒‘象牙香占’中的表达量;在籽粒发育中期(抽穗后20 d),LPAT2在‘广8B’籽粒中的表达量显著高于其在‘象牙香占’中的表达量;而在籽粒发育后期(抽穗后30 d),LPAT3和LPAT4的表达量在不同含油量水稻品种籽粒中存在显著差异。上述结果表明,水稻LPAT基因家族各成员在籽粒发育的不同阶段发挥其磷脂酸PA合成的作用,其表达差异可能是形成高含油量与低含油量水稻品种籽粒中油脂含量差异的重要原因。目前为止,水稻中关于LPAT基因家族功能的报道较少,而关于该家族各成员在油脂合成中的作用更是鲜见报道,本研究对水稻LPAT基因家族详细的生物信息学分析及其在水稻籽粒油脂合成中的作用初探,将为进一步开展该家族基因功能的研究打下基础。

